基于p72蛋白的非洲猪瘟病毒抗体检测试纸研制
2023-11-14孙亚宁卢清侠邢云瑞杨苏珍乔松林张改平
孙亚宁,卢清侠,邢云瑞,杨苏珍,范 璐,乔松林,张改平
(河南省农业科学院动物免疫学重点实验室,河南 郑州 450002)
非洲猪瘟(African swine fever,ASF)是由非洲猪瘟病毒(African swine fever virus,ASFV)引起的一种急性、热性、高度接触性动物传染病,死亡率可高达100%[1]。2018 年下半年,ASFV 传入我国,对我国养猪业产生了前所未有的威胁[2],造成了严重的经济损失[3]。目前,ASFV 仍在广泛传播,传染源与污染源并未彻底清除,且出现了ASFV 变异株和经典强毒株共流行的局势[4]。ASFV 变异株包括基因缺失株[5]、自然变异株、自然弱毒株[6]等,与2018 年传入的ASFV 毒株相比,该类毒株的基因组序列、致病力等发生明显变化,猪感染变异株后排毒滴度低、间隙性排毒,难以早期发现,让防控形势变得更复杂[5]。对于目前ASFV 并没有疫苗及有效的治疗手段,建立敏感、特异、简便且能实现现场快速检测的ASFV 检测方法,实现感染猪的早期发现、实施“精准剔除”是实现猪场内部ASFV 净化、控制疫情的有效手段[7]。
ASFV 的检测技术主要包括检测抗原的聚合酶链式反应(PCR)等核酸检测方法和检测抗体的酶联免疫吸附分析(ELISA)等免疫学检测方法[8]。PCR已成功应用于猪样品(血液、器官等)[9]中ASFV 基因组的检测,是可以代替病毒分离鉴定的一种灵敏、特异、快速的ASFV 检测技术,在抗原检测技术中,较免疫学方法和荧光免疫分析法等具有更高的敏感性和特异性。但是PCR 无法应用于现场实时监测,且在ASFV 感染康复后及变异毒株感染的情况下,PCR 的漏检率非常高[10],无法满足目前ASFV 复杂感染情况下的检测需求。基于ASFV 感染后7~9 d 血清抗体转阳,包括康复后的动物,抗体阳性可持续终生等特点,在无可用疫苗的大背景下,抗体检测阳性则表明感染正在或者已经发生,开展现场实时ASFV 抗体快速检测可以大大提高检测效率及准确性,在ASFV精准剔除计划中意义重大[11]。
胶体金免疫层析技术是近年来迅速发展的一种体外诊断技术,相比ELISA 方法具有快速、准确、方便,无需任何人员及设备,几分钟即可出结果等优点,可以实现现场快速检测。因此,研制能够灵敏、准确检测ASFV抗体的试纸对控制ASFV疫情起到积极作用。目前,国内外已经针对ASFV 抗体检测试纸开展了研究[12-15],常用的检测抗原有p30、p54、CD2V 及p72 等。但是ASFV 抗体检测试纸在使用过程中存在敏感性低、准确性差等问题,成为ASFV 抗体检测试纸推广应用的瓶颈。影响抗体检测试纸敏感性及准确性的主要因素是检测抗原的质量及免疫层析试纸的产品化工艺。已有的ASFV抗体检测试纸的检测抗原多为原核表达,与病毒本身的蛋白结构相差较大,从而造成检测敏感性及准确性差;再者建立的试纸大多停留在实验室阶段,并未对产品的工艺参数进行细致优化。因此,ASFV抗体检测试纸并未在基层大面积推广应用。
ASFV 是直径为200 nm 的大型包膜病毒,病毒基因可编码200 多种蛋白质,其中包括50 多种结构蛋白质[16-20],常用的检测抗原中,p30、p54为ASFV感染早期表达的蛋白质[21-22],但是其在病毒中含量较少,产生抗体滴度较低。p72蛋白是构成ASFV二十面体结构的主要蛋白质,占病毒蛋白总量的32%[23],在病毒衣壳上以同源三聚体形式存在[24]。p72 抗原性强,表位非常保守[25],含有4 个主要抗原表位,可能参与受体的结合和中和性抗体的结合。为了解决目前ASFV 抗体检测试纸存在的问题,选择真核表达系统表达共转染p72基因及其伴侣蛋白基因的方法,获取正确折叠的p72重组蛋白为检测抗原,并研究蛋白质不同状态对检测试纸的影响,经条件优化,建立ASFV 抗体检测试纸,以期从原材料上入手提高产品检测敏感性,再通过优化试纸制备过程中的条件,形成较优的生产工艺,确保ASFV 抗体检测试纸的敏感性、特异性、准确性及稳定性能满足商品化需求,为ASFV 抗体检测在基层的广泛应用提供技术支撑。
1 材料和方法
1.1 材料
1.1.1 主要试剂 ASFV p72 蛋白三聚体及多聚体(HEK293F 细胞表达)、ASFV p72 单克隆抗体由河南省农业科学院动物免疫学重点实验室制备;43份ASFV抗体阴性血清(2018年以前收集)、22份ASFV抗体阳性血清、猪蓝耳病毒(PRRSV)抗体阳性血清、猪细小病毒(PPV)抗体阳性血清由河南省农业科学院动物免疫学重点实验室收集及保存;ASFV抗体标准阳性血清、伪狂犬病毒(PRV)抗体标准阳性血清、猪瘟病毒(CSFV)抗体标准阳性血清、猪圆环病毒2 型(PCV2)抗体标准阳性血清购自中国兽医药品监察所。
重组金黄色葡萄球菌A 蛋白(r-SPA)购自杭州纽龙生物科技有限公司;氯金酸、酪蛋白购自美国Sigma公司;无IgG、无蛋白酶的牛血清白蛋白(BSA)购自美国Jackson Immuno Research 公司;Tween 20购自美国默克公司;PVP-10、PEG20 000、Tris 购自美国Solarbio 公司;Triton X-100 购自美国Merck 公司;海藻糖购自日本Wako 公司;硝酸纤维素膜(HF13502S25,30 cm×2 cm)、玻璃纤维垫、吸水纸购自英国Millipore公司;ASFV ELISA 抗体检测试剂盒购自韩国金诺公司;氢氧化钠、叠氮钠等其他试剂为国内市售分析纯级。
1.1.2 主要仪器 93-3 定时恒温双向磁力搅拌器购自上海亚荣生化仪器厂;电热鼓风干燥箱购自上海一恒科学仪器有限公司;HGS802 压壳机购自杭州峰航科技有限公司;900 型薄膜连续封口机购自广州华丰包装设备有限公司;SIGMA4-16K 离心机购自德国Sigma 公司;加热磁力搅拌器购自德国IKA公司;U-3000 紫外可见分光光度计购自日本岛津公司;BioDot-XYZ3060 三维喷点系统、BioDot-CM 4000斩切机购自美国Bio-Dot公司;智能免疫层析定量分析仪由北京中农快检科技有限公司提供。
1.2 方法
ASFV 抗体检测试纸选择间接法原理建立。结构见图1。试纸由支撑底板、硝酸纤维素膜(NC膜)、结合垫、样品垫和吸收垫五部分组成。NC 膜上质控线(C 线)位置固定p72 单克隆抗体,检测线(T 线)位置固定SPA;结合垫上固定胶体金标记的p72 蛋白。当样品为阴性时,金标p72 蛋白随着液体流动到T 线位置时不与SPA 反应,流经C 线时与固定的p72 单克隆抗体反应,显示1 条红色条带;当样品为阳性时,样品中ASFV p72 抗体与金标p72 结合形成复合物,流经T线时与SPA反应被拦截,多余的金标蛋白被C 线拦截,试纸显示2 条红色条带。该试纸目测即可判定结果,也可借助智能免疫层析定量分析仪扫描T 线灰度值峰面积,根据读值进行数据分析,T 线显色强度在一定范围内与抗体滴度呈正比。
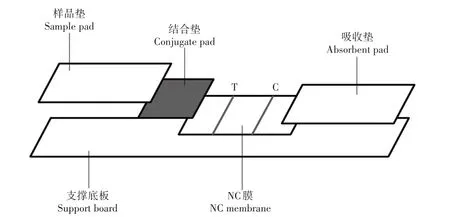
图1 ASFV抗体检测试纸结构Fig.1 Structure of the ASFV antibody test strip
1.2.1 胶体金制备及鉴定 以柠檬酸三钠法制备胶体金。在500 mL 烧杯中加入100 mL 超纯水,在加热磁力搅拌器上边搅拌边加热,煮沸后先加入1 mL 10 g/L 的氯金酸,然后再加入1.6 mL 10 g/L 柠檬酸三钠,观察颜色变为酒红色后再继续加热5 min,取下烧杯,自然冷却后用超纯水定容至100 mL,4 ℃保存。肉眼观测胶体金状态,使用紫外可见分光光度计进行光谱扫描,对胶体金质量及粒径进行鉴定。
1.2.2 不同状态p72重组蛋白的对比试验 在蛋白质纯化的过程中,经分子筛分离获得p72 三聚体蛋白和p72 多聚体蛋白,胶体金分别标记2 种蛋白质,并进行试纸条件优化建立检测方法,通过对比标记过程稳定性及试纸检测性能,对比蛋白质的不同状态对检测产品的影响,选择较优蛋白质状态组装试纸。
1.2.3 胶体金标记p72蛋白条件优化 分别对胶体金标记p72蛋白的pH值、标记量进行优化。
胶体金标记pH 值优化:用0.2 mol/L K2CO3调节胶体金pH 值,取7 个离心管,每管中加入1 mL 胶体金,再分别加入2、4、6、8、10、12、14 μL K2CO3,按照张改平等[26]所述方法测定各pH 值下最佳蛋白质标记量。按照测定的最佳蛋白质标记量将蛋白质加入不同pH 值的胶体金中,充分混匀,室温静置反应70 min,加入100 μL 100 g/L BSA 溶液封闭,反应10 min,12 000 r/min 离心25 min,弃上清,沉淀用金标蛋白保存液重悬。根据经验确定非优化环节的参数,组装试验用试纸(方法下同)[27],将不同pH 值条件下标记的金标蛋白,以1 μL/条的量点在金标垫上,检测ASFV 标准阴性及阳性血清。智能免疫层析定量分析仪扫描,计算阳性血清T线(P)与阴性血清T 线(N)的比值(P/N 值)。根据金标蛋白标记过程中的稳定性及试纸检测结果,确定最佳标记pH 值。最佳pH 值条件下,在蛋白质饱和度附近设定不同的蛋白质加入量,标记胶体金获得金标蛋白。将不同标记浓度标记的金标蛋白点于金标垫上检测ASFV 标准阴性及阳性血清,以检测结果确定蛋白质标记量。
1.2.4 NC 膜喷膜浓度优化 检测线(T 线)最佳喷涂条件确定:用PBS 配制SPA 质量浓度为0.1、0.25、0.5、0.75、1 mg/mL 的溶液,以1 μL/cm 的量喷于NC膜上,42 ℃干燥2 h,然后组装试验用试纸,检测ASFV 标准阴性及阳性血清,智能免疫层析定量分析仪扫描,选择P/N 值最大,且N 值最小的喷膜浓度为最佳喷膜质量浓度。
质控线(C 线)最佳喷涂条件确定:取抗p72 蛋白单克隆抗体,用PBS 稀释为2、1、0.5 mg/mL 质量浓度的溶液,以1 μL/cm 的量喷于NC 膜上C 线,同时喷涂T 线(最佳参数),42 ℃干燥2 h,然后组装试验用试纸,检测标准阳性血清效价,选择C 线清晰,且在检测强阳性血清时C线仍能显色的质量浓度为质控线喷涂条件。
1.2.5 样品垫配方优化 参照孙亚宁等[27]的样品垫配方,设置基础配方:0.1 mol/L PBS 含10 g/L 酪蛋白钠,5 g/L Triton X-100,NaN30.3 g/L。在此配方上固定其他参数调整单因素,分别调整缓冲液(如Na2B4O7·10H2O、Tris-HCl、MES 等)、大分子物质及蛋白质(PVP-10、PVP-40、BSA、PEG 等)、表面活性剂S1-S25,最终以试纸流动状态、P/N 值及N 值为判断标准,确定较优样品垫配方。
1.2.6 ASFV 抗体检测试纸生产 结合垫制备:在搅拌状态下将1 400 μL 0.2 mol/L K2CO3加入100 mL胶体金中调节pH 值,然后搅拌状态下逐滴加入16 mL p72 三聚体(用ddH2O 稀释的0.1 mg/mL 溶液),室温反应30 min,搅拌状态下加入10 mL BSA溶液(质量浓度100 g/L),室温反应10 min,12 000 r/min离心30 min,弃上清,沉淀用20 mL 金标蛋白保存液重悬。然后用BioDot-XYZ3060 三维喷点系统按7 μL/cm 的量喷涂在预处理的玻璃纤维棉(0.9 cm×30 cm)上,42 ℃干燥1 h,密封保存。
NC 膜制备:用BioDot-XYZ3060 三维喷点系统按1 μL/cm的量喷涂C线及T线,42 ℃干燥2 h,密封保存。
样品垫制备:将尺寸为1.8 cm×30 cm 玻璃纤维棉浸泡于样品垫溶液中,静置5 min,然后均匀平铺于干燥板上,42 ℃干燥4 h,密封保存。
试纸组装:按照图1,将NC 膜、结合垫、样品垫、吸收垫依次粘贴于支撑底板上,各组分间重合2 mm,切割机切割成规格为3.0 mm×70 mm 的试纸,将试纸装入卡壳中,加入干燥剂密封保存。
1.2.7 ASFV 抗体检测试纸显色时间优化 用试纸检测ASFV 阳性血清(生理盐水1∶100稀释),设3个平行,分别在显色5、10、15、20、25、30 min 时,用智能免疫层析定量分析仪扫描,确定最佳显色时间。
1.2.8 ASFV 抗体检测试纸敏感性鉴定及样品稀释倍数选择 用生理盐水将ASFV 标准阳性血清样品倍比稀释,然后用试纸检测,每个稀释倍数平行检测3 次,显色10 min 后用智能免疫层析定量分析仪扫描试纸,以T 线P/N ≥2.1 对应的最大稀释倍数确定为试纸检测效价,同时用ASFV ELISA 抗体检测试剂盒检测阳性血清效价,对比检测结果,评价试纸敏感性。
同时用试纸检测弱阳性血清效价,根据弱阳性血清及标准阳性血清机读结果确定样品稀释倍数。
1.2.9 ASFV 抗体检测试纸检测方法及结果判定
试纸检测方法:将试纸取出平放于桌面上;将猪血清样品用生理盐水进行1∶100 稀释;取稀释好的样品100 μL加入试纸加样孔中,静置反应10 min后目测或机器扫描读取结果。
目测结果判定:仅在质控线(C)处显现1条红色条带,而检测线(T)处不显现红色条带时,结果判为阴性;在质控线(C)和检测线(T)处同时显现2 条红色条带时,结果判为阳性,而且检测线颜色深度与抗体效价高低在一定范围内呈正比。
机读结果判定:当机读结果为11.18 时判为阴性,当机读结果大于23.48(P/N>2.1)时判为阳性,当结果在11.18~23.48时,建议4~7 d后复测。
1.2.10 ASFV 抗体检测试纸特异性鉴定 用ASFV抗体检测试纸分别检测ASFV、PRRSV、PPV、PCV2、PRV、CSFV阳性血清及ASFV阴性血清,显色10 min后,目测鉴定试纸特异性。
1.2.11 ASFV 抗体检测试纸均一性鉴定 取ASFV抗体检测试纸10 条,检测ASFV 标准阳性血清,显色10 min 后,用智能免疫层析定量分析仪扫描试纸,计算变异系数(CV),评价试纸均一性。
1.2.12 ASFV 抗体检测试纸准确性鉴定 取ASFV抗体检测试纸分别检测43 份ASFV 抗体阴性血清及22 份ASFV 抗体阳性灭活血清,读取结果,计算假阳性率及假阴性率,评价试纸准确性。
1.2.13 ASFV 抗体检测试纸稳定性鉴定 选择45 ℃加速试验评价ASFV 抗体检测试纸稳定性,45 ℃下保存37.5 d 相当于25 ℃下保存1 a,30 ℃下保存6 个月[9]。将包装好的试纸放入45 ℃鼓风干燥箱中,每隔5 d 取样检测ASFV 标准阳性血清效价,评价试纸稳定性。
1.2.14 临床样品检测 取ASFV 抗体检测试纸与ASFV ELISA 抗体检测试剂盒分别检测71份田间血清,对比检测结果,计算2 种检测方法的符合率,评价建立试纸的临床使用价值。
2 结果与分析
2.1 ASFV抗体检测试纸构建
2.1.1 胶体金质量鉴定 胶体金肉眼观测表明,胶体金呈酒红色,颜色透亮、无沉淀及漂浮物。紫外可见分光光度计扫描结果见图2,结果显示,胶体金的紫外吸收峰峰宽在500~550 nm,峰宽较窄,说明胶体金颗粒比较均匀;最大吸收为527 nm 处,经计算得出胶体金粒径为29 nm。综上所述,制备的胶体金颗粒均匀,质量较好,且颗粒大小适合用于免疫层析方法建立。
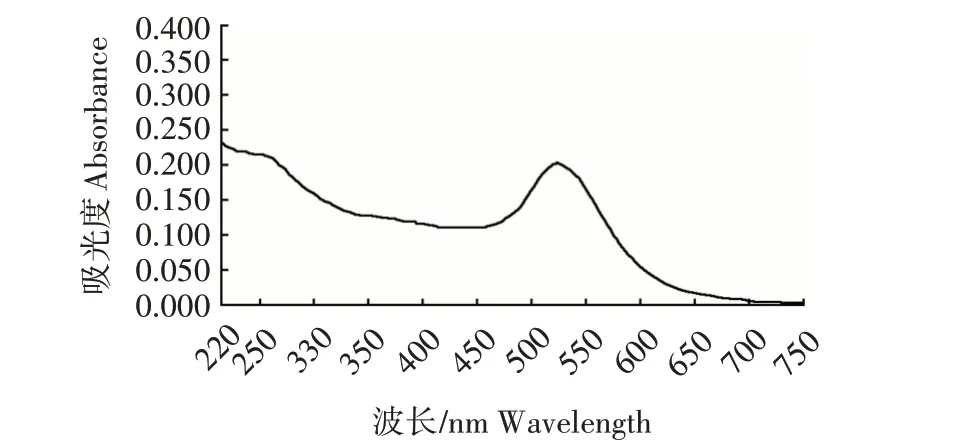
图2 胶体金紫外扫描鉴定Fig.2 Identification chart of colloidal gold by ultraviolet scanning
2.1.2 胶体金标记p72 蛋白状态选择及条件确定
同时优化p72 三聚体和多聚体的胶体金标记条件,从标记过程中的稳定性分析,p72多聚体在标记过程中稳定性稍差,金标蛋白颜色稍紫,p72三聚体的稳定性较好。2种蛋白质检测性能见图3,结果显示,三聚体蛋白检测阴性样品时背景更低,P/N 值更高,结合标记过程中的稳定性,选择p72三聚体为检测蛋白。
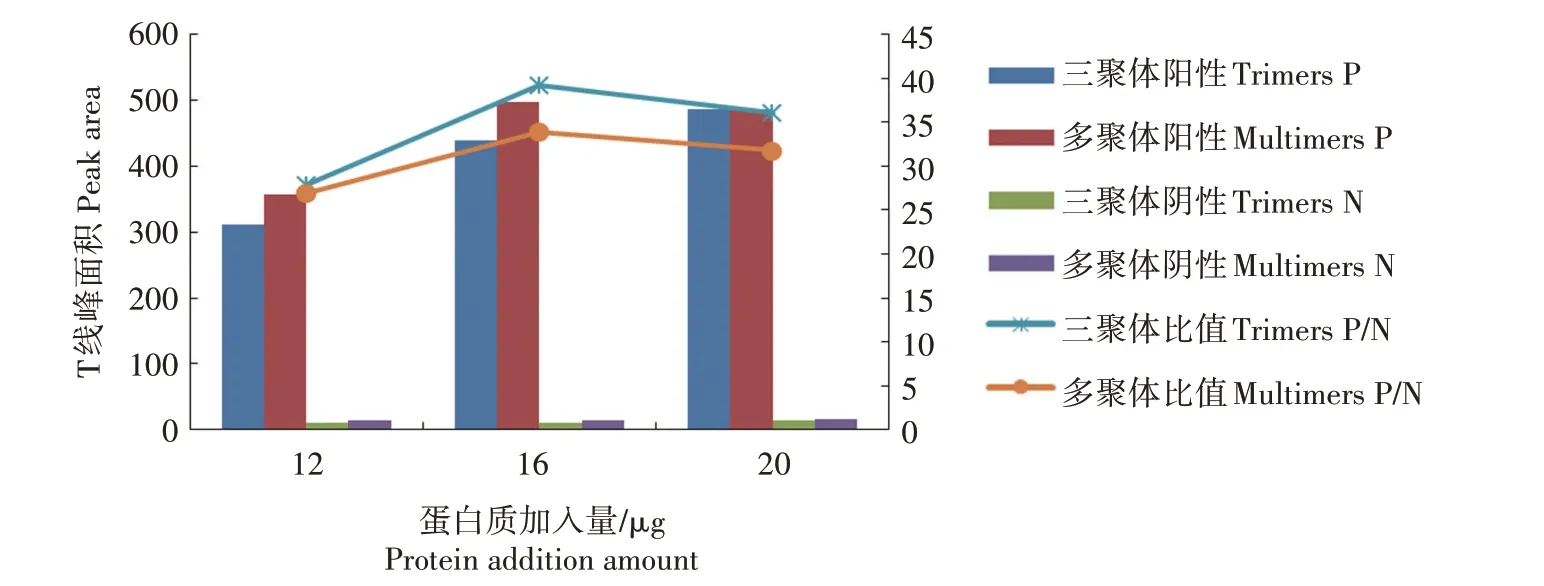
图3 胶体金标记p72蛋白量优化Fig.3 The optimization of gold labeled p72 protein amount
标记条件优化:标记pH值结果显示,当1 mL胶体金中K2CO3加入量小于10 μL 时,胶体金标记的过程不稳定,且检测阴性血清时有假阳性信号存在。当1 mL 胶体金中K2CO3加入量为12 μL 和14 μL 时,标记稳定性及阳性值显色无明显区别,为了保证体积放大后生产过程中标记的稳定性,选择1 mL 胶体金中加入14 μL K2CO3的量调节标记pH值。最佳标记量优化结果见图3,结果显示,当1 mL胶体金中标记量增加至16 μg 时可以明显提高显色强度,且阴性血清背景不增加,当加入量增加至20 μg 时,标记过程中出现金标蛋白挂壁的现象,且显色强度及背景均增加,P/N 值降低,因此,最佳标记量确定为1 mL 胶体金中加入16 μg p72 三聚体蛋白较合适。
2.1.3 NC膜喷膜质量浓度确定 NC膜喷膜质量浓度分析结果见图4。图4显示,当T线喷膜的质量浓度为0.75 mg/mL 时P/N 值最高,且N 值最低,随着SPA 质量浓度增加,N 值逐渐增加,为了检测的准确性,应严格控制N 值,因此,选择0.75 mg/mL 为T 线喷膜质量浓度。当C 线上p72 单克隆抗体喷膜的质量浓度为2 mg/mL 时,显色清晰,且在检测强阳性样品时仍能正常显色。因此,选择2 mg/mL 为C 线喷膜条件。
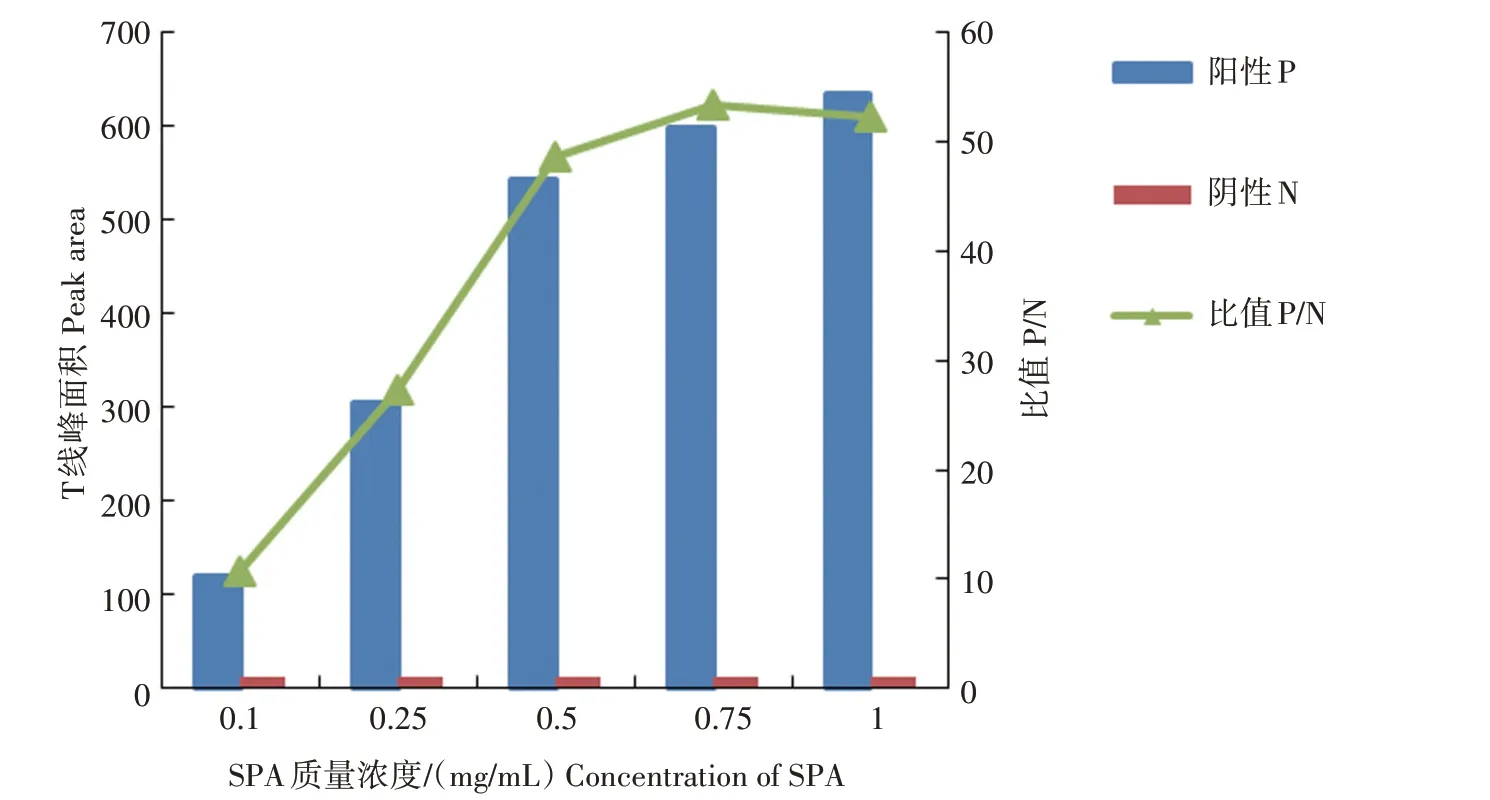
图4 检测线上SPA喷膜质量浓度优化Fig.4 The optimization of mass concentration of SPA coated on test line
2.1.4 样品垫配方确定 经过不同因素的调整,最终确定该试纸样品垫配方为Tris-HCl(pH 值7.4)中加入PVP-10、酪蛋白钠、S17及NaN3,金标蛋白跑板状态正常,N值最低,P/N值较大。
2.1.5 ASFV 抗体检测试纸显色时间确定 ASFV抗体检测试纸显色时间结果见图5,当显色10 min后,T线颜色基本稳定,据此确定显色10 min后可读取结果。根据观测检测过程中胶体金的释放情况,10 min 左右金标蛋白基本释放完全,20 min 时胶体金红色全部被吸收垫吸收,所有反应基本完成。可见,20 min 是最佳观测时间。随着反应时间的延长,NC 膜上水分会蒸发,可能导致样品垫上金标蛋白复合物回流等多种不良反应,容易造成结果的假阳性。因此,试纸检测必须在30 min 内判读结束。综上所述,试纸可以在10~30 min 内读取结果,且在此时间内结果稳定。比较宽的结果读取时间范围可以更好地保证大批量样品检测时结果的准确性。
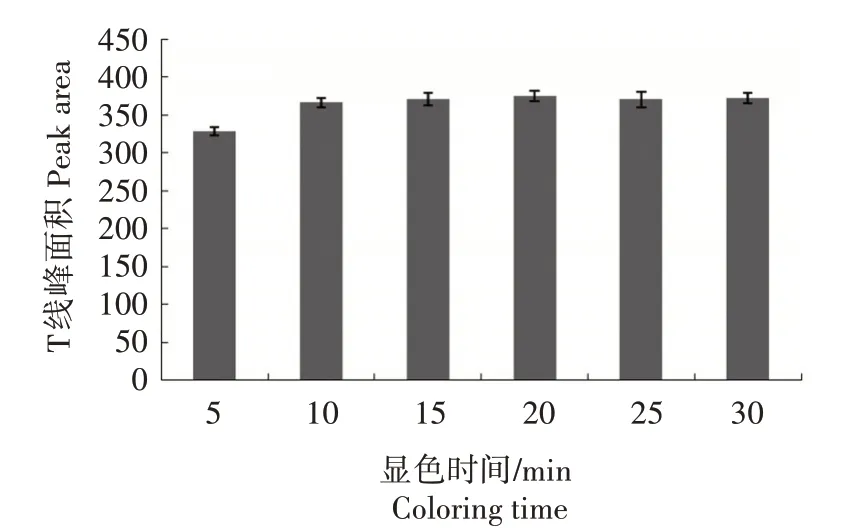
图5 ASFV抗体检测试纸显色时间确定Fig.5 The optimization of coloring time of ASFV antibody test strip
2.2 ASFV抗体检测试纸鉴定
2.2.1 ASFV 抗体检测试纸敏感性鉴定及样品稀释倍数选择 ASFV 抗体检测试纸检测ASFV 标准阳性血清结果见表1,根据P/N≥2.1 计算,该标准阳性血清的试纸效价为1∶51 200。使用ASFV ELISA 检测试剂盒检测ASFV 标准阳性血清效价为1∶6 400(根据说明书,S/P>0.4为阳性),因此,该试纸的敏感性优于ASFV ELISA抗体检测试剂盒。
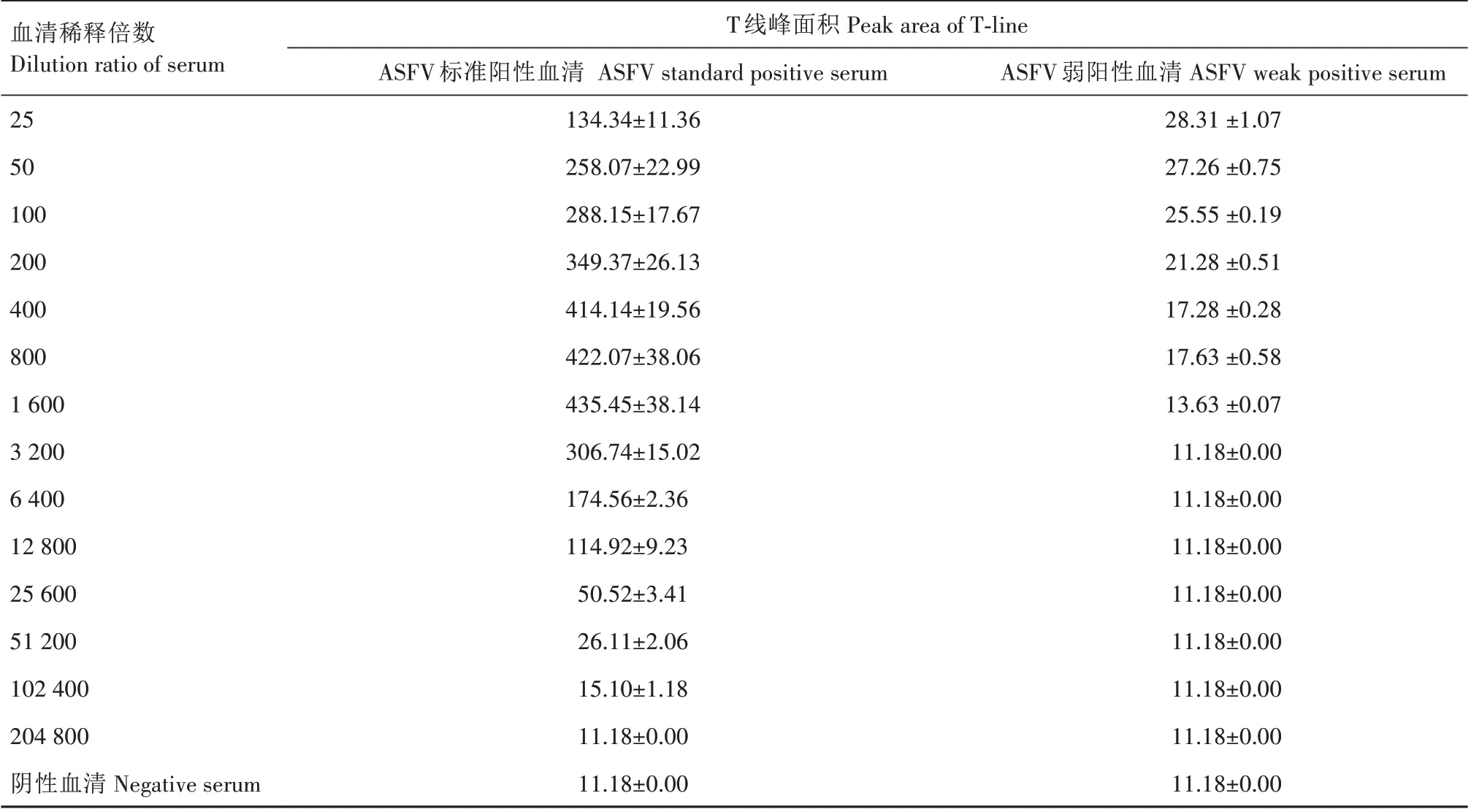
表1 ASFV阳性血清试纸效价Tab.1 The titer of ASFV positive serum detected by test strip
表1 中弱阳性血清试纸效价检测结果显示,根据P/N≥2.1 判定为阳性血清的标准,血清稀释倍数高于100 倍时无法判定为阳性;结合标准阳性血清的试纸效价结果,血清稀释倍数低于100 倍时钩状效应明显。因此,本研究选择样品稀释倍数为100倍,既能保证弱阳性血清检出,又可以降低强阳性血清的钩状效应。
2.2.2 ASFV 抗体检测试纸特异性鉴定 ASFV 抗体检测试纸特异性鉴定结果见图6,结果显示,试纸不与PRRSV、PPV、PCV2、PRV、CSFV 阳性血清及ASFV 阴性血清反应。因此,研制的ASFV 抗体检测试纸具有很好的特异性。
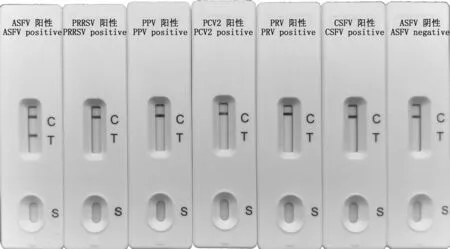
图6 ASFV抗体检测试纸特异性鉴定Fig.6 Specific evaluation of ASFV antibody test strip
2.2.3 ASFV 抗体检测试纸均一性鉴定 均一性鉴定结果如表2所示,ASFV抗体检测试纸的变异系数为7.9%。通常试纸检测的变异系数小于10%,表明其具有很好的均一性。本研究制备的ASFV 抗体检测试纸均一性良好。
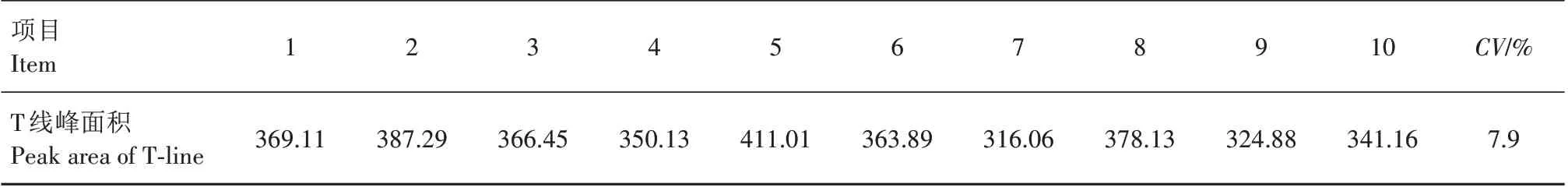
表2 ASFV抗体检测试纸均一性鉴定Tab.2 Homogeneity evaluation of ASFV antibody test strip
2.2.4 ASFV 抗体检测试纸准确性鉴定 用试纸检测43份ASFV抗体阴性血清及22份ASFV抗体阳性灭活血清,结果见图7。由图7 可知,43 份阴性血清检测结果均为阴性,未见假阳性;22 份阳性血清均为阳性,未见假阴性。说明制备的ASFV 抗体检测试纸具有很好的准确性。

图7 ASFV抗体检测试纸准确性鉴定Fig.7 Accuracy evaluation of ASFV antibody test strip
2.2.5 ASFV 抗体检测试纸稳定性鉴定 将包装好的ASFV 抗体检测试纸于45 ℃保存,进行加速稳定试验,结果见表3。试纸在45 ℃保存45 d,试纸的敏感性不变,也未出现假阳性。可见,本研究制备的ASFV 抗体检测试纸具有很好的稳定性,可以室温保存1 a以上。
2.2.6 ASFV 抗体检测试纸临床样品检测结果 用ASFV 抗体检测试纸与商业化ASFV ELISA 试剂盒同时检测71份田间样品,评价该试纸是否可应用于临床检测中,结果见表4。由表4 可以看出,ELISA试剂盒检测出阳性样品14 份,试纸均检测出为阳性,阳性复合率为100%;ELISA 试剂盒检测出阴性样品52 份,试纸检测阴性为51 份,阴性符合率为98.1%;ELISA 试剂盒检测出5 份可疑样品,试纸检测均为阳性。2种检测方法的总符合率为91.6%。
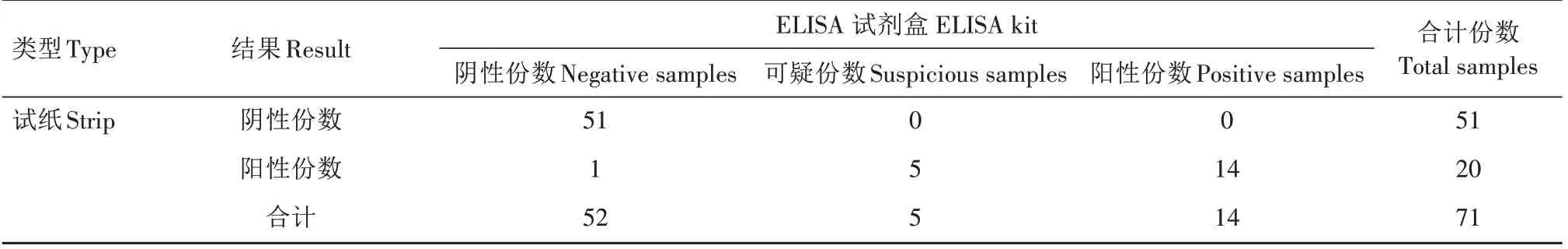
表4 ASFV抗体检测试纸临床样品检测结果Tab.4 The detection results of clinical samples by the ASFV antibody test strip
3 结论与讨论
目前,基于p72 蛋白的ASFV 抗体检测方法多是采用的截短或单独表达的p72蛋白[28-29],蛋白质状态以不均一的聚集物存在。利用pB602L 与p72 蛋白共表达时,可以获得折叠正确、均匀分布的三聚体状态[30],而本研究选择与伴侣分子pB602L共表达的p72 重组蛋白,再利用分子筛将p72 的三聚体及多聚体分离,然后分别作为检测蛋白构建试纸,对比不同形态的p72蛋白对免疫层析试纸检测性能的影响,经对比以三聚体形式存在的p72 蛋白具有更好的敏感性、稳定性及特异性。本研究结果提示,在蛋白质纯化的过程中重组蛋白的不同状态对产品性能的影响也非常明显,在纯化及保存的过程中应该充分考虑蛋白质状态并对其进行控制,从而保证产品检测性能的稳定。
SPA是一种从金黄色葡萄球菌细胞壁分离的蛋白质,能与多种哺乳动物的IgG 及少量的IgM 和IgA特异性结合,对猪、狗、兔、人、猴、鼠及牛等种属IgG亲和力较强;对大白鼠、绵羊等种属的IgG 亲和力稍差;基本不与马、山羊等哺乳动物IgG 反应,常被用于广谱二抗使用,且具有多种优势:首先SPA 可以通过表达纯化获得,制备及纯化简单、分子高度均一、性质稳定且不受Fc 受体影响;其次SPA 与IgG的亲和力比传统二抗强,可以大大提高检测敏感性;而且SPA 可以和多种属的IgG 反应,制备的检测产品不仅可以检测猪血清,对野猪、鼠、狗等种属同样适用。因此,本研究选择SPA 为拦截线,可以提高检测敏感性及适用范围。WAN 等[28]利用重组的p30 蛋白及截短的p54 蛋白建立了双重ASFV 抗体检测试纸,检测敏感性为1∶256,与商业化ELISA 试剂盒相当。ZHU 等[29]以酵母表达系统表达的p72 蛋白,建立了ASFV 抗体检测试纸,检测敏感性为1∶10 000。本研究制备的ASFV 抗体检测试纸,检测敏感性为1∶51 200,有效提高了试纸的检测敏感性。
间接法免疫层析试纸检测血清中抗体时会出现钩状效应,就是当抗体浓度过高时试纸显色反而会降低,其原因为样品中存在大量的抗体,一部分抗体在流经结合垫时与金标蛋白反应形成金标抗原抗体复合物,但是流经拦截线时,样品中大量的游离抗体封闭了SPA 的拦截位点,从而降低了二抗拦截金标抗原抗体复合物的能力,造成显色强度降低,甚至会出现假阴性结果,为了避免假阴性结果的出现,通常可以通过增加稀释倍数的方法解决。但是对于弱阳性血清增加了稀释倍数就会造成检测敏感性降低,因此,样品稀释倍数的选择对免疫层析试纸产品检测准确性非常重要。本研究根据强阳性血清及弱阳性血清的检测结果综合分析,确定样品稀释倍数为100 倍,既能保证弱阳性血清检出,也能降低强阳性血清的钩状效应,使检测结果更加准确。
间接法免疫层析试纸的C线为抗检测蛋白质的抗体,通过拦截金标蛋白显色,因此当检测样品为阳性时,金标蛋白-抗体复合物会被T 线拦截,从而导致C 线显色信号降低,甚至会出现强阳性血清时C线不显色的情况,因此,在试纸制备过程中可以适当增加金标蛋白的量及C 线喷膜浓度,改善C 线的显色。或者采用独立的C 线显色系统,比如生物素亲和素等建立与试纸本身不反应的一组独立的组分进行标记和C线的喷涂,从而保证C线显色。
关于临床样品检测符合率的问题,本研究选择的ELISA 试剂盒设置了0.3<S/N<0.4为可疑区间,本次检测的临床样品中有5 份的可疑样品,试纸检测结果为阳性,从而造成了本研究符合率偏低的结果。试纸检测敏感性试验结果显示,该试纸的检测敏感性要高于ELISA 试剂盒,因此将试剂盒判为可疑的样品检测为阳性是试纸敏感性较高的体现,可以更早地诊断出ASFV 感染的存在,从而更好地实现“精准剔除”,控制ASFV疫情。
本研究选择p72 重组蛋白三聚体为检测蛋白,以SPA 为拦截线,经胶体金标记条件、NC 膜喷膜条件、样品垫缓冲体系及成分、显色时间等因素优化,确定ASFV 抗体检测试纸产品化的具体参数,建立了ASFV 抗体检测试纸,并对试纸的特异性、均一性、准确性及稳定性进行了鉴定,为ASFV 抗体检测试纸的推广应用及产业化奠定基础。
本研究确定了ASFV 抗体检测试纸的产品化参数;以p72 重组蛋白三聚体为检测抗原;1 mL 胶体金中加入14 μL 0.2 mol/L K2CO3、16 μg p72 蛋白三聚体为胶体金标记条件;以0.75 mg/mL SPA 喷涂T线,2 mg/mL p72 单克隆抗体喷涂C 线;以Tris-HCl(pH 值7.4)含PVP-10、酪蛋白钠、S17 及NaN3为样品垫处理液;检测10~30 min 判定结果。对建立的ASFV 抗体检测试纸的检测性能进行鉴定,试纸的检测敏感性为1∶51 200,优于商业化ASFV ELISA检测试剂盒;试纸不与PRRSV、PPV、PCV2、PRV、CSFV 阳性血清及ASFV 阴性血清反应,具有良好的特异性;变异系数为7.9%,具有良好的均一性;在临床样本检测中未见假阴性及假阳性结果,具有良好的准确性;经加速稳定试验验证,可以室温保存1 a以上;与进口商品化试剂盒的总符合率为91.6%。本研究制备的试纸检测性能良好,可以满足商业化需求,为基层ASFV 抗体的快速检测提供了技术手段。
