亚成体大熊猫异常发情及探究
2023-11-13刘娟韦华魏荣平魏明殷涛邓涛
刘娟,韦华,魏荣平,魏明,殷涛,邓涛
中国大熊猫保护研究中心,大熊猫国家公园珍稀动物保护生物学国家林业和草原局重点实验室,邛崃山濒危野生动植物保护生物学国家长期科研基地,四川 都江堰 611830
大熊猫(Ailuropoda melanoleuca)作为我国野生动物保护领域的旗舰物种,因其数量稀少曾一度濒临灭绝,多年来一直受到众多野生动物保护工作者的关注。近年来得益于大熊猫迁地保护政策的实行,曾经的“三难”问题被逐一攻克,圈养大熊猫的繁殖成功率大幅提升,种群数量有了显著增加。由于对大熊猫内在生殖机理缺乏深入清晰的认识,在大熊猫的发情和妊娠过程中仍存在一些现象缺乏科学合理的解释,为实行圈养大熊猫优生优育带来了一定的阻碍,不利于提高种群质量。
亚成体大熊猫“暖暖”2015 年8 月日出生于马来西亚国家动物园,2017 年11 月返回中国大熊猫保护研究中心都江堰青城山基地,在2018 年和2019 年连续两年出现明显的如:外阴开口外翻、水肿,同时出现减食、活动量增大、蹭阴、咩叫等大熊猫发情期的典型行为。本文通过行为观察记录和收集到的一些尿液进行激素监测,从遗传基因、个体状况、环境条件等方面探讨导致雌性大熊猫提早发情的潜在原因,旨在为探索大熊猫的生殖生理提供有用信息,有助于大熊猫饲养管理和繁育工作的开展。
1 观察对象与方法
1.1 研究地点
中国大熊猫保护研究中心青城山基地(103°34´06"—103°34´37" E,30°51´36"—30°51´56" N)位于四川省都江堰市青城山镇,面积约50.7 hm2,属中亚热带湿润气候区,馆舍周边是次生的常绿、落叶阔叶混交林。
1.2 观察对象
大熊猫“暖暖”,系谱号977。
1.3 研究方法
采用外部观察法进行行为观察记录,将活动量、戏水、蹭阴等与发情密切相关的行为依据活动强度分为5 个等级,由饲养师每日记录。在出现明显发情行为后,收集尿液进行激素监测(2018 年未收集到尿液)。
2 结果
2.1 行为表现
“暖暖”在2018 年4 月首次出现了活动量增加,戏水等行为,期间精神状态良好,食欲未见明显变化。2019 年3 月再次出现了上述情况,其后有所恢复,在4 月开始出现采食量明显下降并伴有戏水、蹭阴、咩叫等典型的发情行为(具体行为见表1)。

表1 发情期行为比较Tab.1 Comparison of estrus behavior
2.2 生殖器与激素变化
在两次行为异常时期,“暖暖”的外阴均有变化。2018 年有轻度开口,未见明显肿胀。2019 年则变化极为明显,外阴由前期出现开口;后逐渐外翻,水肿,呈粉红色或潮红色,偶有乳白色液体流出;后期肿胀逐渐消退并向内收缩,颜色变粉变淡。在出现明显的发情行为后收集检测“暖暖”尿液中的雌激素含量,显示有较大幅度的变化,因此认为亚成体大熊猫“暖暖”处于发情状态。
3 分析与讨论
动物的初次发情是生长发育过程中的重要阶段,这意味着个体生殖系统发育成熟开始具有繁殖能力。初情期的内在机制十分复杂,是动物个体在遗传基因调控的基础上与外界环境因素共同作用的结果,除遗传因素外,营养和个体发育状况、环境与气候的变化均会导致初情期的提前或推迟。
3.1 遗传和内分泌调节
动物的生殖性能主要受生殖内分泌系统调控,而在内分泌激素发挥调节作用的过程中又会受到遗传基因表达的影响。下丘脑促性腺激素释放激素(gonadotropin releasing hormone,GnRH )是启动动物初情期的关键物质,作用于垂体使其分泌释放促性激素,促进卵泡发育和精子产生,并产生性激素。在初情期以前的下丘脑GnRH 神经元对性激素的负反馈作用而一直处于抑制状态分泌量较少,在初情期启动时与之密切相关的KISS-1 等相关基因表达急剧升高,直接刺激释放大量GnRH,促使FSH和LH 的释放,进而促进初情期的产生。KISS-1 基因自身的突变或缺失亦会导致性早熟或无法启动初情期[1,2]。DNA 甲基化作为表观遗传修饰方法的方式之一,可以通过影响基因的表达从而对动物的生殖状态产生调控作用。哺乳动物中DNA 甲基化主要发生在CpG 部位,通常位于启动子区域,也可扩展到基因的内含子和外显子区域。对大鼠注射一种DNA 甲基化抑制剂后,发现体内DNA 甲基化水平降低,大鼠阴门开启的时间有明显推迟,且性腺发育迟缓,其初次发情过程明显被延迟[[3]。进入青春期和成年期的恒河猴与幼年时期相比较,下丘脑内侧GnRH 基因表达有显著升高的趋势,同时5’端CpG岛甲基化水平显著降低,由此可以认为GnRH 神经元体外成熟过程中肽释放的增加可能是GnRH 中CGI 的DNA 去甲基化的结果[[4-5]。在山羊的初情期前后发现,下丘脑全基因组甲基化总体水平保持不变,而不同基因中CpG 位点上甲基化的状态有较明显差异,相较而言,单个基因的甲基化状态比整体甲基化水平对发情启动的影响更大[6]。因此,在动物初次发情的过程中神经内分泌调节并不是唯一途径,以DNA 甲基化代表的遗传基因调控机制也发挥着不可忽视的重要作用,虽然目前还未出现与大熊猫有关的报道,但可作为后期研究关注的新方向。
3.2 营养与发育
营养水平与动物繁殖机能存在直接联系,是影响动物发情或不发情的主要外在因素之一。营养不足可导致代谢机能减弱,影响生殖激素分泌,大多数营养不良的动物都会出现初情期推迟甚至不发情;营养过高则会导致肥胖和初情期提前。在部分地区有关少年儿童性成熟调查的报道中发现,肥胖和体重超标的儿童发育较为提前,出现性早熟的几率显著高于正常体重的儿童,高热量饮食习惯导致的营养过剩是诱发这一现象的主要因素[7-9]。在动物实验中也发现以高热量饲料饲喂的肥胖大鼠较正常体重的大鼠体内的雌激素水平更高,性发育有明显的提前倾向[[10]。在家畜牛、羊等反刍动中营养水平与体重对初情期的出现影响更大[11]。与野外相比较,圈养条件下没有复杂多变的外在威胁且有稳定丰富的食物供给,人工饲养的大熊猫各方面的生长发育明显优于野生大熊猫,其中以体重这一项尤为明显。1.5 岁的雌性大熊猫平均体重可达47.7±5.4 kg,3 岁为84±3 kg[12],而本文研究对象大熊猫“暖暖”两岁半时体重已达98 kg。此前也曾有过亚成体大熊猫提早发情的报道[[13],同样存在体重超重的现象,它们的体重超出同龄大熊猫,接近甚至达到成年大熊猫的体重(表2)。由此可见,营养过剩导致体重超重是影响大熊猫初情期的一个重要因素。

表2 过早发情大熊猫的比较Tab.2 Comparison of premature estrus in giant pandas
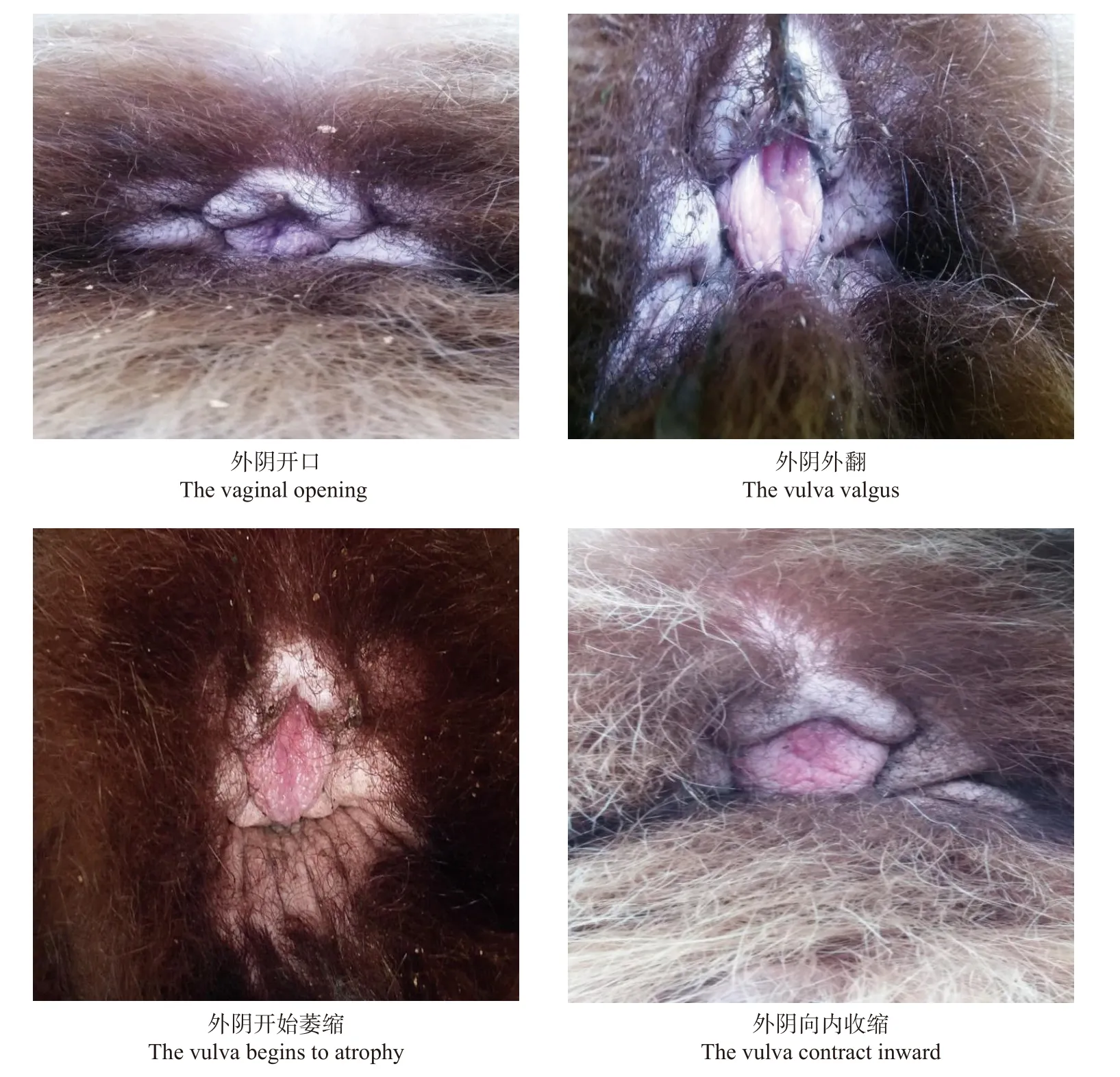
图1 2019 年发情期外生殖器的变化Fig.1 Changes of vulva during oestrus in 2019
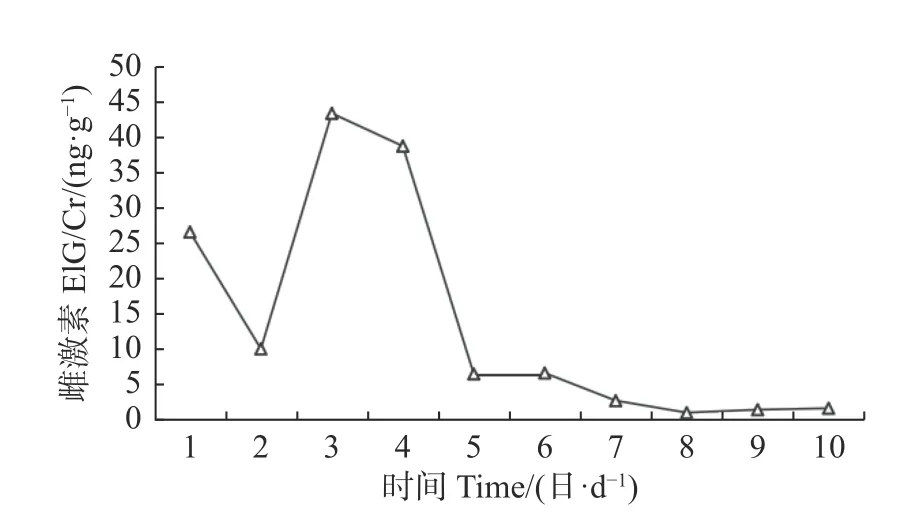
图2 2019 年尿中雌激素的变化Fig.2 Changes of estrogen in urine in 2019
3.3 气候与环境
大熊猫分布具有一定的地域属性,它们的生活习性受环境气候影响较大。曾有圈养大熊猫因科研和文化合作交流的需要前往其他国家和地区,由于当地与原分布区和饲养地迥然不同的气候导致大熊猫出现了一定的应激反应,性周期紊乱,出现不发情或者异常发情的情况,在采取人为调整光周期和温湿度等改善措施后,逐渐恢复正常[14-17]。暖暖出生于马来西亚吉隆坡,并在当地生活两年多之后回到四川都江堰。马来西亚属热带国家,光照强度较强,气候炎热,常年气温在25℃~30℃,都江堰处于亚热带区域,年平均气温处于10℃~22℃之间,四季分明气候凉爽。两地之间较大的气候和环境差异对“暖暖”产生了一定的刺激,促使其过早发情。
关于大熊猫的性成熟年龄目前已有广泛的研究,各饲养单位和研究机构对大熊猫性成熟年龄的看法各不一致,但普遍认为雄性大熊猫性成熟在5 岁以后,雌性大熊猫稍早一些,多在4 岁以后[17-20]。像“暖暖”这样处于低龄就连年出现明显发情行为的情况仍属罕见。大部分动物的性成熟滞后于体成熟,在初情期后还需要经历性成熟期才可进行交配繁育后代。因此,虽然亚成体阶段大熊猫身体机能已基本发育成熟,但并不意味着其具有正常交配,繁育后代的能力。这提示我们在大熊猫饲养管理中,应根据不同年龄阶段大熊猫的生长特征来制定饲养管理措施,使其在不同的生长阶段保持适宜的生长速度,合理控制好日常供应尤其是精饲料等高热量食物的进食量,科学调整超重个体的饮食,如此方能减少或避免出现过早发情状况。
