牛蒡子苷元对葡聚糖硫酸钠诱导的小鼠炎症性肠病的治疗作用及机制①
2023-11-13李家驹黄佑娇李远迪何可可贵州医科大学基础医学院贵阳550025
李家驹 黄佑娇 李远迪 何可可 苏 敏 (贵州医科大学基础医学院,贵阳 550025)
炎症性肠病(inflammatory bowel disease,IBD)是一种由肠黏膜上皮破坏引起的慢性、复发性炎症疾病,主要包括溃疡性结肠炎(ulcerative colitis, UC)和克罗恩病(Crohn's disease, CD)。IBD 是环境和遗传因素相互作用的结果,通常导致肠道黏膜免疫反应异常和肠道炎症发生[1-2]。此外,肠道表面由黏膜组成,主要由紧密连接(tight junction,TJs)覆盖,而TJs是肠道的主要屏障[3]。TJs 蛋白的异常表达与IBD密切相关[4]。我国IBD 的发病率显著上升,然而其发病机制和病因尚未阐明。目前用于治疗IBD的药物存在明显的不良反应,如全身免疫抑制、头痛、恶心和疲劳[5-6]。因此,探索可用于治疗IBD 的药物具有重要意义。
许多天然产物由于具有抗炎作用和相对低的毒性而获得了相当多的关注。牛蒡子是菊科牛蒡属植物干燥成熟的果实,是一种传统中药,广泛用于治疗风热邪咳嗽、咽喉肿痛等。牛蒡子苷元是从牛蒡子中提取分离而来的木质素类化合物。作为牛蒡子的主要活性成分,牛蒡子苷元被发现具有抗病毒和抗炎等作用。据报道,牛蒡子苷元能抑制炎症和氧化应激,但其在IBD 中的作用还有待研究[7]。本研究旨在探究牛蒡子苷元对脂多糖(lipopolysaccharide,LPS)诱导的人肠道细胞Caco-2 和葡聚糖硫酸钠(dextran sulfate sodium,DSS)诱导的小鼠结肠炎模型的作用及其相关的机制。
1 材料与方法
1.1 材料 6~8 周龄C57BL/6J 雄性小鼠(20~22 g,SPF 级)购自贵州医科大学实验动物中心;Caco-2 细胞购自中国科学院科学细胞库(上海,中国);牛蒡子苷元(纯度≥98%;分子量372.411 7)购自上海源叶生物科技有限公司。胎牛血清和DMEM 购自美国Gibco公司;DSS购自美国Sigma公司;ELISA 试剂盒购自美国Thermo Fisher Scientific 公司;磷酸化细胞核因子κB p65(nuclear factor kappa-B p65,NF-κB p-p65)、紧密连接蛋白(zonula occludens-1,ZO-1),GAPDH 抗体均购自美国Abcam 公司;HRP 标记的山羊抗兔IgG 购自上海碧云天生物科技有限公司;Multiskan FC酶标仪购自美国Thermo Fisher Scientific公司;蛋白电泳凝胶仪和The Trans-Blot Turbo 蛋白转膜仪购自美国Bio-Rad 生物有限公司;OLYMPUS AX70显微镜购自日本Olympus公司。
1.2 方法
1.2.1 小鼠IBD 模型建立 采用DSS 建立IBD 小鼠模型[8]。C57BL/6 小鼠随机分为4 组:空白对照组、模型组、牛蒡子苷元低剂量组(10 mg/kg)和牛蒡子苷元高剂量组(40 mg/kg)。对照组小鼠自由饮用自来水,其余各组小鼠通过连续饮用4%(wt./vol)DSS 7 d制备小鼠IBD模型。模型鼠在造模第3~4天后,小鼠会表现出明显的疾病迹象,包括驼背、皮毛隆起、腹泻和黏液脓血便。随机挑选3只模型鼠,处死后取出结肠组织,通过组织病理学观察可见溃疡、隐窝脓肿、杯状细胞丢失、黏液层丢失和大量中性粒细胞浸润到固有层,表明造模成功。小鼠在造模前连续灌胃牛蒡子苷元2 d,于第3 天进行DSS 造模,各给药组均连续灌胃给予相应药物10 d,1次/d,对照组和DSS 组给予等体积生理盐水。给药期间,小鼠标准饮食、自由饮水。该动物实验获得贵州医科大学动物保护和使用委员会批准。动物使用许可证号:SYXK(黔)2016-0003。
1.2.2 细胞培养 Caco-2 细胞(1×105个/ml)接种于96 孔板,培养在含有10%胎牛血清、100 U/ml 青霉素和100 µg/ml 链霉素的PRMI1640 中,并置于37 ℃和5%CO2的培养箱中。当96 孔板中的Caco-2细胞贴壁后,分为4 组:空白对照组、LPS 组、LPS+10 µmol/L 牛蒡子苷元组,LPS+40 µmol/L 牛蒡子苷元组。Caco-2 细胞与牛蒡子苷元(10、40 µmol/L)孵育1 h,然后37 ℃下用LPS(1 µg/ml)刺激24 h,与对照组比较差异显著,表明建模成功[9]。
1.2.3 ELISA 测定各组细胞上清中TNF-α、IL-1β、IL-6、MDA 和SOD 水平 在洗净的小鼠结肠中加入3 倍的生理盐水,采用超声粉碎法将结肠组织匀浆,按试剂盒说明书方法操作,ELISA 对小鼠结肠组织中TNF-α、IL-1β、IL-6、MDA 和SOD 的 含 量 进 行测定。
1.2.4 Western blot 分析 使用RIPA 裂解液提取细胞和组织中的蛋白;取20 µl 蛋白样品采用10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(120 V,2 h);电转法将蛋白转至聚偏氟乙烯膜(250 mA,2 h);10%脱脂奶粉室温封闭1 h,一抗4 ℃过夜孵育,二抗室温孵育2 h。凝胶成像仪检测蛋白条带,Image-Pro Plus软件分析条带灰度值。
1.2.5 HE 染色 采用HE 染色评价结肠组织病理学变化。在实验完成后,小鼠被处死,移除每只小鼠的整个结肠。将5 mm 长的结肠用4%多聚甲醛中过夜固定。随后,将石蜡包埋的结肠切片用苏木精和伊红进行HE 染色。采用显微镜下观察组织病理改变。
1.2.6 胸腺指数与脾脏指数计算 将各组中的小鼠脱颈椎处死后称量体质量(g)。无菌条件下剪开腹腔摘取小鼠的胸腺和脾脏。使用滤纸吸干胸腺和脾脏的残血后,称重(mg)。计算胸腺指数=(胸腺重量mg/小鼠体质量g)×10;脾脏指数=(脾脏重量mg/小鼠体质量g)×10。
1.3 统计学处理 采用SPSS23.0统计学软件进行数据分析。实验数据以±s表示。两组间比较采用t检验,多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 牛蒡子苷元抑制LPS诱导的人肠道细胞Caco-2炎症因子分泌 ELISA 结果显示:与空白对照组比较,LPS 处理后,Caco-2 细胞炎症因子TNF-α、IL-1β和IL-6 分泌显著增加(P<0.05);与LPS 组比较,牛蒡子苷元治疗24 h 后降低了炎症因子的分泌,而高剂量牛蒡子苷元(40 µmol/L)的治疗效果明显优于低剂量牛蒡子苷元(10 µmol/L)(P<0.05)。见图1。2.2 牛蒡子苷元减轻LPS诱导的人肠道细胞Caco-2氧化应激 ELISA 结果显示:与空白对照组比较,LPS处理后,Caco-2细胞中SOD 含量显著下降,MDA含量显著上升(P<0.05);而10 µmol/L 或40 µmol/L牛蒡子苷元处理显著增加了SOD 含量,减少了MDA含量(P<0.05)。见图2。

图1 牛蒡子苷元抑制Caco-2细胞中炎症因子表达Fig.1 Arctigenin inhibits expressions of inflammatory factors in Caco-2 cells
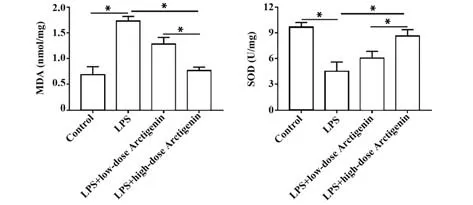
图2 牛蒡子苷抑制Caco-2细胞中氧化应激Fig.2 Arctigenin inhibits oxidative stress in Caco-2 cells
2.3 牛蒡子苷元抑制LPS 诱导的人肠道细胞NF-κB 通路激活 Western blot 结果显示,LPS 诱导Caco-2 细胞后,NF-κB p65 蛋白的磷酸化水平显著升高,其下游蛋白ZO-1 表达显著降低(P<0.05);10 µmol/L 或40 µmol/L 牛蒡子苷元处理后,逆转了LPS 诱导的NF-κB p65 蛋白磷酸化水平上升和ZO-1表达水平降低。见图3。
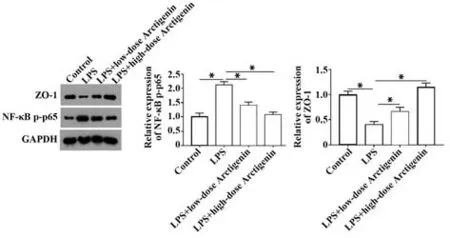
图3 牛蒡子苷元抑制Caco-2细胞中NF-κB通路激活Fig.3 Arctigenin inhibits activation of NF-κB pathway in Caco-2 cells
2.4 牛蒡子苷元减轻DSS 诱导的IBD 小鼠炎症因子分泌 与对照组比较,DSS 诱导的IBD 模型组小鼠结肠组织中TNF-α、IL-1β 和IL-6 含量显著增加(P<0.01)。牛蒡子苷元低和高剂量组(10 mg/kg 和40 mg/kg)TNF-α、IL-1β 和IL-6 含 量 明 显 降 低,40 mg/kg牛蒡子苷元组效果更为显著(P<0.01)。见表1。
表1 牛蒡子苷元对DSS诱导小鼠结肠组织炎症因子含量的影响(±s,n=6,pg/mg)Tab.1 Effect of arctigenin on content of inflammatory factors in colon tissues of mice induced by DSS(±s,n=6,pg/mg)

表1 牛蒡子苷元对DSS诱导小鼠结肠组织炎症因子含量的影响(±s,n=6,pg/mg)Tab.1 Effect of arctigenin on content of inflammatory factors in colon tissues of mice induced by DSS(±s,n=6,pg/mg)
Note:Compared with control group, 1)P<0.01; compared with model group, 2)P<0.01; compared with 10 mg/kg Arctigenin, 3)P<0.01.
Groups Control Model 10 mg/kg Arctigenin 40 mg/kg Arctigenin F TNF-α 26.75±12.51 366.83±28.131)229.07±19.752)IL-1β 55.01±7.30 303.82±28.441)205.52±16.392)IL-6 72.79±6.22 163.48±14.701)136.28±11.522)110.42±12.333)66.34 108.22±9.263)370.40 91.09±8.553)255.60
2.5 牛蒡子苷元减轻DSS 诱导的IBD 小鼠的氧化应激 与对照组比较,DSS 处理的小鼠结肠组织中SOD 活性降低,而10 mg/kg 或40 mg/kg 牛蒡子苷元可显著提高SOD 活性(P<0.01)。与对照组小鼠相比,DSS 诱导的IBD 模型组小鼠MDA 浓度显著增加,而10 mg/kg 或40 mg/kg 牛蒡子苷元治疗小鼠的MDA浓度明显降低(P<0.01)。见表2。
表2 牛蒡子苷元对DSS诱导的小鼠结肠组织MDA和SOD含量的影响(±s,n=6)Tab.2 Effect of arctigenin on contents of MDA and SOD in colon tissues of mice induced by DSS (±s,n=6)

表2 牛蒡子苷元对DSS诱导的小鼠结肠组织MDA和SOD含量的影响(±s,n=6)Tab.2 Effect of arctigenin on contents of MDA and SOD in colon tissues of mice induced by DSS (±s,n=6)
Note:Compared with control group, 1)P<0.01; compared with model group,2)P<0.05,3)P<0.01;compared with 10 mg/kg Arctigenin,4)P<0.01.
SOD/(U·mg-1)29.71±3.52 18.67±1.581)21.89±1.172)28.53±2.544)29.60 Groups Control Model 10 mg/kg Arctigenin 40 mg/kg Arctigenin F MDA/(nmol·mg-1)1.32±0.16 2.81±0.091)2.26±0.133)1.46±0.074)212.20
2.6 牛蒡子苷元抑制DSS 诱导的IBD 小鼠NF-κB通路激活 与对照组相比,模型组小鼠结肠组织中NF-κB p-p65 蛋白表达增加,ZO-1 表达下降(P<0.05);10 mg/kg 和40 mg/kg 牛蒡子苷元组逆转了DSS 诱导的NF-κB p-p65 表达增加和ZO-1 表达降低(P<0.05)。见图4。

图4 牛蒡子苷元抑制DSS 诱导的IBD 小鼠NF-κB 通路激活Fig.4 Arctigenin inhibits DSS-induced activation of NFκB pathway in IBD mice
2.7 牛蒡子苷元增强免疫功能和减轻结肠组织损伤 免疫功能的强弱可通过胸腺指数和脾脏指数反映。与对照组相比,DSS诱导后,小鼠胸腺指数和脾脏指数显著降低(P<0.01);10 mg/kg 或40 mg/kg牛蒡子苷元治疗后,小鼠的胸腺指数和脾脏指数升高(P<0.01)。见表3。HE 染色结果显示:对照组小鼠的结肠组织结构完整,组织绒毛排列整齐,无炎症细胞浸润和坏死。IBD 模型组小鼠结肠组织细胞浸润绒毛排列紊乱,黏膜上皮细胞结构被破坏,有中性粒细胞浸润迹象,个别区域细胞坏死明显。10 mg/kg 牛蒡子苷元组小鼠结肠组织损伤程度减轻,组织结构层次分明,局部组织炎症细胞浸润减少,组织形态较好。40 mg/kg 牛蒡子苷元组结肠组织结构基本完整,肠腺排列整齐,黏膜上皮细胞淋巴细胞浸润显著减少。见图5。
表3 胸腺指数和脾脏指数(±s,n=6)Tab.3 Thymus index and spleen index (±s,n=6)
Note:Compared with control group, 1)P<0.01; compared with model group, 2)P<0.05; compared with 10 mg/kg Arctigenin, 3)P<0.05.
Spleen index 0.006 16±0.000 57 0.004 08±0.000 391)0.004 77±0.000 432)0.005 42±0.000 483)21.29 Groups Control Model 10 mg/kg Arctigenin 40 mg/kg Arctigenin F Thymus index 0.001 83±0.000 12 0.001 31±0.000 181)0.001 52±0.000 142)0.001 74±0.000 183)24.79
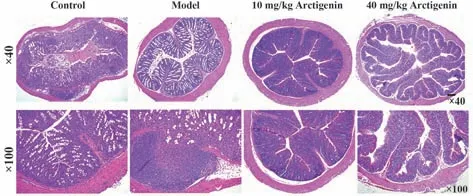
图5 牛蒡子苷元对DSS诱导的IBD小鼠结肠组织病理学的影响Fig.5 Effect of arctigenin on colonic histopathology of DSS-induced IBD mice
3 讨论
IBD 是消化道常见的一种复发性、长期性的炎症性疾病,对患者的身心健康有害。此外,IBD 属于自身免疫性疾病,可能增加结直肠癌患病风险。目前用于改善IBD相关临床症状和炎症的药物包括糖皮质激素、氨基水杨酸、免疫抑制剂和其他生物制剂。然而,这些药物也有副作用。因此,开发更安全、有效和靶向治疗IBD的药物是必要的。
越来越多的研究表明牛蒡子苷元具有多种生物功能。牛蒡子苷元已被报道可抑制小鼠免疫细胞防止急性肝炎引起的肝损伤[10]。HYAM 等[11]发现牛蒡子苷元通过抑制PI3K/AKT 通路将M1 巨噬细胞极化为M2 样巨噬细胞来改善体外和体内炎症。ZHANG 等[12]发现牛蒡子苷元通过抑制MAPK、HO-1 和iNOS 的信号传导,降低LPS 诱导的急性肺损伤,其分子机制可能与其抗炎和抗氧化应激的能力有关。此外,已有文献报道牛蒡子苷元显示出较高的抗癌活性,可以促进结肠癌细胞凋亡[13]。鉴于以上结果,本研究通过体内和体外实验探讨牛蒡子苷元对IBD 的治疗作用及机制。体外研究结果表明,LPS刺激人肠道细胞Caco-2后,炎症因子TNF-α、IL-1β 和IL-6 分泌显著增加,SOD 活性降低,MDA 含量增加。牛蒡子苷元可明显降低炎症因子的分泌以及氧化应激水平。本研究通过小鼠自由饮用4%DSS 溶液7 d 诱导溃疡性IBD 小鼠模型,从而进行体内研究。造模3 d 后,小鼠的脾脏指数和胸腺指数降低,表明免疫功能被抑制;同时观察到,小鼠结肠黏膜损伤,结肠组织中MDA和炎症因子TNF-α,IL-1β和IL-6水平均上升,SOD水平下降。高剂量牛蒡子苷元可明显减轻DSS 诱导的肠黏膜损伤,抑制炎症因子分泌和氧化应激水平。
目前有关IBD的病因和发病机制仍不明确。大量的文献表明,IBD 的发病机制涉及复杂的炎症反应。IBD 时肠黏膜促炎细胞因子表达升高,而抑炎细胞因子分泌相对不足,使肠黏膜发生炎症反应,引起肠道损伤[14-15]。氧化应激在慢性炎症过程中发挥直接作用,可导致中性粒细胞和巨噬细胞的数量增加,从而促进炎症反应的发生[16]。NF-κB 通路已被证明与炎症反应和IBD 密切相关。在IBD 中,miR-19b 通过上调Runx3、阻断NF-κB 和PI3K/AKT信号通路缓解LPS 诱导的Caco-2 细胞炎症损伤[17]。IBRAHIM 等[18]发现,PIK3R3 通过NF-κB 通路调控炎症性肠病中ZO-1 表达,抑制PIK3R3 使NF-κB 通路失活,ZO-1表达下调,进而减轻IBD。以上研究表明,抑制NF-κB 通路的激活,可显著改善IBD。已有研究对牛蒡子苷元与NF-κB 通路的关系进行了探究。ZHOU 等[19]发现牛蒡子苷元通过抑制小鼠PI3K/AKT 和NF-κB 信号通路,抑制炎症因子的表达,从而防止骨关节炎。牛蒡子苷元通过HMGB1/TLR4-和TNF-α/TNFR1-介导的NF-κB 信号通路激活减轻神经炎症,发挥抗抑郁作用[20]。然而,牛蒡子苷元是否可以通过抑制NF-κB 激活减轻炎症从而缓解IBD 尚未见报道。因此,本课题组对牛蒡子苷元进行研究。体内和体外实验结果显示,牛蒡子苷元通过降低NF-κB p-65 蛋白表达,抑制NF-κB 通路激活,促进ZO-1表达,减轻IBD。
综上所述,本研究结果表明了牛蒡子苷元通过调节NF-κB/ZO-1 通路抑制炎症因子分泌和氧化应激,从而对IBD有显著的改善作用。
