耐盐闽粤石楠组培快繁体系的建立
2023-11-13向星星干雨露于奕宁
向星星,丰 锋,干雨露,于奕宁
(广东海洋大学滨海农业学院,广东 湛江 524088)
【研究意义】闽粤石楠(PhotiniabenthamianaHance)属蔷薇科石楠属多年生灌木或小乔木,分布于我国广东、福建、湖南、浙江等地,位于陆地与海洋交界带的红树林滩涂,是生产力最高的生态系统之一,是海岸带区域重要的生态屏障。由于人们对沿海滩涂随意采伐、养殖和无序开发等行为,以及全球气候变化的加剧,红树林正面临多种威胁[1-2]。资源调查发现,在红树林沿海滩涂中,伴生多株耐盐闽粤石楠,利用这些耐盐单株建立耐盐闽粤石楠组培快繁体系,可在短时间内获得大量优质种苗,为沿海滩涂绿化提供种苗支持,具有非常重要的经济价值和生态价值[3-4],应用前景广阔。【前人研究进展】石楠属植物适应性较强,对土质要求不高,耐瘠薄、耐盐碱[5],其应用涉及生态绿化、医疗食品和生化产品等多个领域,在绿化产业生态建设中发挥着不可或缺的积极作用。目前关于石楠属植物的研究主要集中于扦插育苗技术[6-7]、容器育苗技术[8]、病虫害防治[9-10]等。在石楠属植物组培快繁研究方面,孔祥生等[11]最早以石楠侧枝嫩芽为外植体建立组培快繁体系;李明银等[12]以红叶石楠叶片和茎段为外植体诱导愈伤组织,结果表明TDZ 和AgNO3对愈伤有促进作用,诱导率最高达55%;吴丽君等[13]以红叶石楠‘鲁宾斯’的茎段为外植体进行组培技术研究,但其离体培养存在增殖率高、生根率低的问题,生根率仅有49%;孙利忠等[14]以红叶石楠‘红罗宾’的带芽茎段诱导出不定芽并进 行增殖、生根,仍存在增殖倍数低、分化率不高等问题。国外也有通过红叶石楠茎段组织培养的相关研究[15]。【本研究切入点】目前仍未见组培快繁繁殖耐盐闽粤石楠种苗的报道,因此建立一套完整、系统的耐盐闽粤石楠组培快繁体系具有重要现实意义。【拟解决的关键问题】本研究以耐盐闽粤石楠实生苗带芽茎段为材料,探讨无菌材料获得、腋芽诱导、不定芽增殖和生根培养的培养基,进而建立组培快繁体系。通过筛选耐盐闽粤石楠最佳外植体灭菌处理、离体快繁激素浓度最佳组合,旨在建立比较系统完整的耐盐闽粤石楠组培快繁体系,为沿海滩涂利用提供种苗支持。
1 材料与方法
1.1 试验材料
2021 年11 月,在广东省深圳市大鹏新区红树林湿地采集耐盐闽粤石楠种子。试验于广东海洋大学实验室开展,将采集的种子洗净暗红色果皮,去除杂质后,用1% NaClO 浸泡消毒20 min。将经过消毒的种子与细沙以体积比3∶1 混匀置于自封袋内,湿度保持30%~40%,于4 ℃冰箱中低温沙藏。经低温沙藏保存3 个月后播种,获得耐盐闽粤石楠实生苗。
1.2 试验方法
1.2.1 外植体预处理及灭菌 选择长势健壮、规格统一的耐盐闽粤石楠实生苗,以耐盐闽粤石楠茎段为外植体,去掉叶片,用洗衣粉漂洗20 min,自来水冲洗60 min 后,备用。外植体预处理后,在超净工作台中,首先将外植体用无菌水清洗1 次,置于无菌空瓶中,分别以75%乙醇(10、20、30 s)、0.15%氯化汞(1、3、5 min)组合处理对外植体进行灭菌,然后切成1 cm 左右的茎段,接种于MS 基本培养基,每个处理接种10 瓶,每瓶 接种1 个外植体,3 次重复。接种后30 d 统计污染率、成活率。
污染率(%)=污染外植体数/接种外植体数×100
成活率(%)=萌芽不污染外植体数/接种外植体数×100
1.2.2 不定芽诱导培养 按照1.2.1 的方法,将预处理后的外植体用75%乙醇灭菌10 s、0.15%氯化汞灭菌3 min,接种至不同诱导培养基中。以MS 为基本培养基,以6-BA(0.5、1.0、2.0 mg/L)、NAA(0.1、0.2、0.3 mg/L)组合处理对外植体进行不定芽诱导,每个处理接种10 瓶,每瓶接种2个茎段,3 次重复。接种后30 d 统计不定芽诱导率和平均萌芽数。
诱导率(%)=诱导出不定芽外植体数/接种外植体数
平均萌芽数(个)=总萌芽个数/无菌外植体数
1.2.3 不定芽增殖培养 将1.2.2 诱导的不定芽培养60 d,转接到不同增殖培养基。采用L9(34)正交试验设计方法,以基本培养基(MS、1/2MS、WPM)、6-BA(1.0、2.0、3.0 mg/L)、NAA(0.1、0.25、0.5 mg/L)组合处理进行不定芽增殖培养,每个处理接种10 瓶,每瓶接种1 个不定芽,3 次重复。接种后30 d 统计增殖系数。
增殖系数=增殖培培养后的不定芽数/接种的不定芽数
1.2.4 不定芽生根培养 将1.2.3 增殖培养获得的不定芽培养2~4 代后,转接到不同生根培养基。采用单因素试验设计方法,以1/2MS 为基本培养基,分别以NAA(0.2、0.4、0.6、0.8 mg/L)和IBA(0.2、0.4、0.6、0.8 mg/L)进行不定芽生根培养,每个处理接种10 瓶,每瓶接种3~5 株不定芽,3次重复。接种后60 d统计生根率、根长和根系数量,用直尺测定根长。
上述培养基均添加琼脂5.5 g/L、蔗糖30 g/L,pH 5.8;培养 条件为:温度25(±1)℃、光照强度2 000 Lx、光照时间12 h/d。
试验数据分析采用DPS 软件进行方差分析和多重比较分析(Duncan)。
2 结果与分析
2.1 不同灭菌方法对耐盐闽粤石楠茎段灭菌效果的影响
如表1 所示,不同灭菌方法处理的耐盐闽粤石楠茎段污染率和成活率不同。随着75%乙醇和0.15%氯化汞处理时间的延长,外植体的污染率降低,成活率也降低。当75%乙醇消毒20 s、0.15%氯化汞消毒5 min 后,外植体污染率 为0,但外植体呈深褐色、不能诱导出不定芽,表明外植体受到了伤害。综合污染率和成活率,最佳的灭菌处理是75%乙醇10 s+0.15%氯化汞3 min,此时污染率为19.0%、成活率为76.67%,与其他处理差异显著。
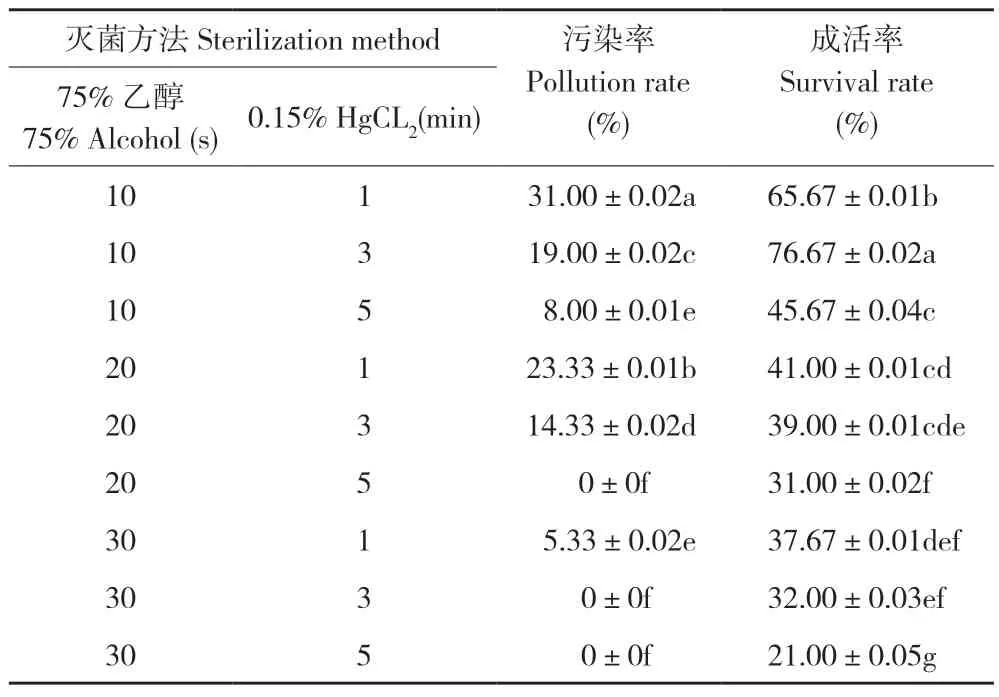
表1 不同灭菌方法对耐盐闽粤石楠茎段灭菌效果的影响Table 1 Effects of different sterilization methods on the sterilization effect of salt-tolerant Photinia benthamiana Hance stems
2.2 6-BA 与NAA 不同浓度组合对耐盐闽粤石楠茎段诱导的影响
观察接种第14 天的耐盐闽粤石楠茎段发现,腋芽在6-BA 与NAA 不同浓度组合的9 种诱导培养基中均可萌发,少量培养基基部可见愈伤组织形成。如表2 所示,当NAA 浓度一定时,随着6-BA浓度的升高,不定芽的诱导率显著提升;当培养基中添加1.0 mg/L 6-BA、0.2 mg/L NAA 时,不定芽诱导率最高、达73.33%,平均萌芽数1.03 个,生长状况良好(图1),与其他处理差异显著。添加0.5 mg/L 6-BA、0.1 mg/L NAA 以及添加2.0 mg/L 6-BA、0.3 mg/L NAA 的处理诱导率均低于50%,表明培养基添加激素浓度过高或过低均不利于诱导不定芽产生。耐盐闽粤石楠不定芽最佳诱导培养基为MS+1.0 mg/L 6-BA+0.2 mg/L NAA。

图1 耐盐闽粤石楠茎段诱导培养生长情况Fig.1 Growth of salt-tolerant Photinia benthamiana Hance stems of induction culture
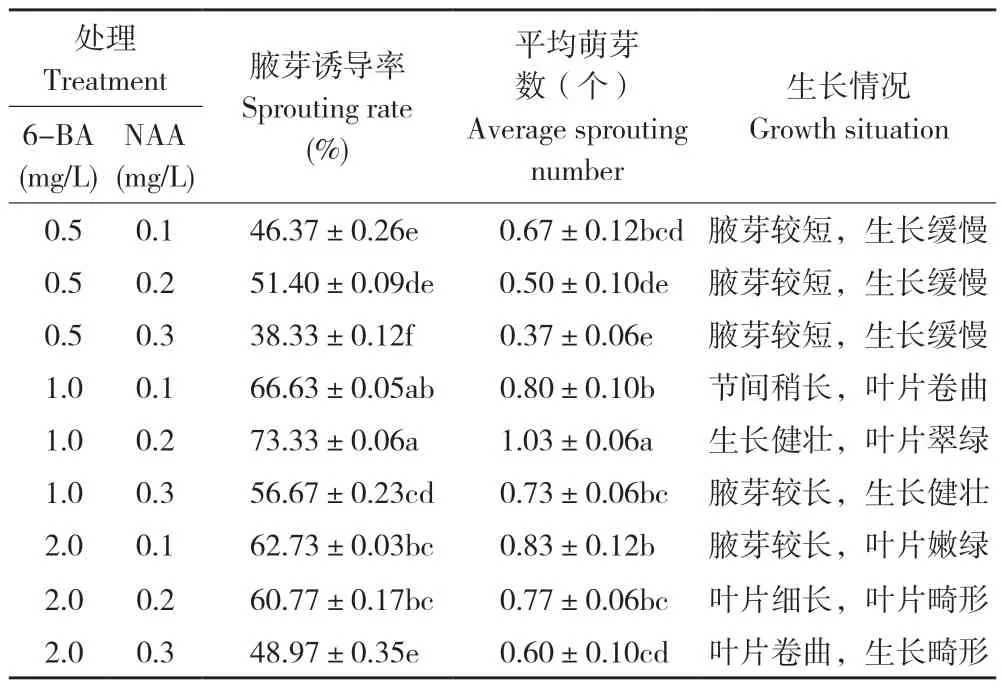
表2 不同激素浓度对耐盐闽粤石楠茎段诱导培养的影响Table 2 Effects of different hormone concentration on induction culture of salt-tolerant Photinia benthamiana Hance stem segments
2.3 基本培养基、6-BA 和NAA 对耐盐闽粤石楠不定芽增殖的影响
如表3 所示,以1/2MS 为基本培养基处理的闽粤石楠不定芽增殖系数较高,且不定芽长势较好,叶片嫩绿;以WPM 为基本培养基处理的不定芽生长较矮;随着6-BA 浓度增加,不定芽增殖系数逐渐升高,当6-BA 浓度为2.0 mg/L 时,平均增殖系数为2.83,较1.0、3.0 mg/L 6-BA 处理分别高0.29 和0.52。通过对各因素进行极差分析发现,基本培养基、6-BA 和NAA 的极差值R分别为0.3、0.5、0.2,表现为6-BA >基本培养基>NAA,说明6-BA 为增殖培养的主要影响因子,其次是基本培养基。综上,耐盐闽粤石楠最佳增殖培养基为1/2MS+2.0 mg/L 6-BA+0.5 mg/L NAA,增殖系数达3.1,且不定芽生长健壮(图2)。

图2 耐盐闽粤石楠不定芽增殖培养生长情况Fig.2 Growth of adventitious buds of salt-tolerant Photinia benthamiana Hance of proliferation culture

表3 基本培养基、6-BA 和NAA 对耐盐闽粤石楠不定芽增殖的影响Table 3 Effects of basic medium,6-BA and NAA on the proliferation of adventitious buds of salt-tolerant Photinia benthamiana Hance
2.4 NAA 和IBA 对耐盐闽粤石楠不定芽生根的影响
截取2~3 cm 的不定芽进行单株生根培养,如表4 所示,组培苗在未添加激素的1/2MS 培养基中,生根率为0;随着添加激素浓度提高,茎秆更加粗壮、根系变粗,基部产生大量愈伤组织(图3),其中IBA 较NAA 对耐盐闽粤石楠不定芽的生根诱导效果更好,当IBA 浓度为0.4 mg/L 时,生根率为87%,平均根长为3.78 cm,平均根数为6.22 条,显著高于其他处理。综上,耐盐闽粤石楠的最佳生根培养基为1/2MS+0.4 mg/L IBA。
图3 耐盐闽粤石楠不定芽生根培养生长情况Fig.3 Growth of adventitious buds of salt-tolerant Photinia benthamiana Hance of rooting culture
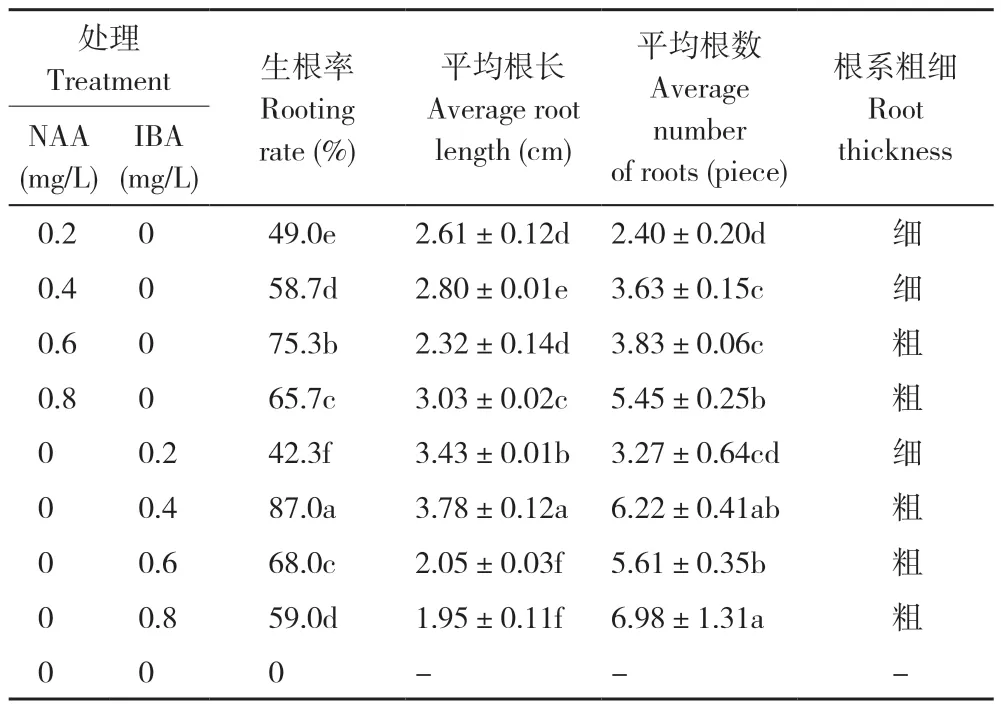
表4 NAA 和IBA 对耐盐闽粤石楠不定芽生根的影响Table 4 Effects of NAA and IBA on rooting of adventitious buds of salt-tolerant Photinia benthamiana Hance
3 讨论
本研究采用耐盐闽粤石楠茎段为外植体直接诱导不定芽,进而进行增殖和生根培养,缩短了从外植体到组培苗的整个诱导周期,是一种更加快速高效的再生体系[16]。降低耐盐闽粤石楠外植体污染率是研究其组培快繁技术需解决的重要问题,通常取自田间的外植体带菌较多,较难彻底消毒灭菌[17]。因此寻求最佳的灭菌药剂及其浓度和时间的组合,控制外植体污染和成活率,是灭菌环节的重要问题[18-19]。本试验通过取当年生耐盐闽粤石楠实生苗茎段为材料进行75%乙醇灭菌10 s+0.15%氯化汞灭菌3 min,外植体污染率为19%,成活率为76.67%,有效解决了无菌体系建立面临的污染率较高问题。刘松青等[20]在桑芽组织快繁技术研究中采用消毒75%酒精处理1 min+5%次氯酸钠溶液处理10 min 进行筛选试验,效果较好。
增殖培养是种苗扩繁的重要阶段[21],生长素类物质和细胞分裂素物质对种苗质量和培养效率有很大影响[22-23]。正交实验设计也是一种高效率的方法[24]。本研究发现,6-BA 和NAA 对耐盐闽粤石楠不定芽诱导均有显著影响。龚霄雯[25]研究发现,在添加1.0 mg/L 6-BA 和0.1 mg/L NAA 的培养基中,红叶石楠‘红罗宾’的腋芽萌发率达95%;独山石楠在添加2.0 mg/L 6-BA+0.1 mg/L NAA 的MS 培养基中,腋芽萌发率达83.3%。基本培养基对不定芽的增殖系数和生长状况也有显著影响[26],MS 培养基是增殖培养中常用的基本培养基,这与邢建宏等[27]研究结果相似。为更全面探讨不同培养基对耐盐闽粤石楠增殖效果的影响,本试验采用L9(34)正交试验设计,探讨MS、1/2MS、WPM 培养基对其增殖培养的影响,发现1/2MS 培养基的增殖效果优于MS 培养基。这可能是由于MS 培养基盐离子浓度过高,造成较高的渗透压,导致一定程度上抑制了植物细胞的分裂分化[28],表明基本培养基对石楠外植体的增殖培养中有一定影响。
木本植物生根是离体培养的关键步骤。研究表明,基本培养基及激素浓度配比、蔗糖和琼脂等添加物都会影响组培苗的生根效果[29]。NAA和IBA 是诱导不定根形成的常用激素,其浓度配比影响植物生根效果,在保证生根的情况下,使根多且粗壮,利于移栽成活[30]。高浓度激素条件下,茎段基部产生大量愈伤组织,根数增加,但生根率降低,根长变短。由此推测,低浓度激素有利于促进耐盐闽粤石楠组培苗生根。
4 结论
本研究以耐盐闽粤石楠茎段为材料,建立了一套外植体灭菌、腋芽诱导、不定芽增殖和生根培养的组培快繁体系。其中,茎段经75%乙醇灭菌10 s+0.15%氯化汞灭菌3 min 处理后,灭菌效果最佳,污染率19%,成活率76.67%;诱导培养以MS+6-BA 1.0 mg/L+NAA 0.2 mg/L 最佳,诱导率为73.33%,平均萌芽数1.03 个;增殖培养以1/2MS+6-BA 2.0 mg/L+NAA 0.5 mg/L 最佳,增殖系数为3.1,丛生芽生长快且健壮;生根培养以1/2MS+0.4 mg/L IBA 最佳,生根率为87%,平均根数6.22 条,平均根长3.78 cm。
