香蕉miR164-NAC 调控模块的鉴定与分析
2023-11-13孔祥锦朱孝扬温玲蓉屈红霞蒋跃明
朱 虹,曾 俊,2,孔祥锦,2,彭 宽,2,朱孝扬,温玲蓉,屈红霞,蒋跃明
(1.中国科学院华南植物园/华南国家植物园,广东 广州 510650;2.中国科学院大学生命科学学院,北京 100049;3.华南农业大学园艺学院,广东 广州 510642)
【研究意义】香蕉(Musaacuminata,AAA group)是芭蕉科芭蕉属植物,营养丰富,经济价值高。在我国,香蕉多以鲜食为主,而鲜食对于果实品质的要求比加工更为苛刻。一方面,香蕉属于呼吸跃变型果实,一旦启动呼吸跃变,果实会迅速完成后熟,难以继续贮藏和运输。香蕉对乙烯十分敏感,因此抑制乙烯产生和延缓呼吸跃变的到来是控制香蕉后熟及贮藏保鲜的关键[1]。另一方面,作为热带水果的典型代表,香蕉对低温十分敏感,田间生长低温或采后贮运温度过低都易发生冷害,严重影响产量和果实品质[2]。鉴于种质资源缺乏和果实成熟及冷害调控的复杂性,目前针对香蕉采后成熟和冷害的控制仍面临较大挑战。因此,深入研究其后熟和冷害发生规律及调控机制,对于维持和提升香蕉采后品质以及减轻冷害损失,具有重大的理论和实践意义。【前人研究进展】microRNA(简称miRNA)是真核生物中广泛存在的一类对基因表达调控具有重要影响的非编码小分子RNA,长度在20~24 个核苷酸。一般产生于基因的间隔区域,通过与靶基因互补配对的原则在转录后水平调控基因表达。成熟miRNA 序列在不同物种间表现出高度的进化保守性,而其表达则具有严格的时空特异性,并受到环境条件的影响[3]。其中,miR164 最先在拟南芥和水稻中被报道,此后通过同源比对、克隆及高通量测序等技术,先后在多个植物物种中鉴定出miR164 家族的成员。经miRBase 22.0 版数据库检索,miR164 家族目前共有70 个成员,来自39 个不同物种。虽然这些miR164 家族成员源自不同物种或同一物种不同的基因位点,且具有各异的前体序列,但它们的成熟序列却高度同源,超过半数的成员在不同植物物种中的序列是完全相同的[4]。部分植物miR164 的功能已得到解析。例如,拟南芥中miR164 调控营养生长及花器官形成,且伴随叶片衰老,miR164 的表达量会出现下降[5]。甜橙miR164 在球形胚发育过程中特异性表达,与球形胚的形成关系密切[6]。过表达miR164 的番茄出现花朵脱落延迟、果形奇特且不产种子的表型,证实miR164 参与调控花器官形成及果实发育[7]。此外,环境胁迫如低氮或盐渍条件下,杨树和棉花的特定miR164家族成员均表现出早期的上调表达,通过靶基因调节根系生长以适应逆境胁迫[8-9]。尽管生信预测miR164 可能作用于多种类型的靶基因,但基于现有的研究报道,miR164 最主要的作用靶标为NAC 家族转录因子。换言之,绝大多数植物都是通过miR164-NAC 这一保守的调控模块来行使功能。例如,拟南芥miR164 家族中的3 个成员,分别靶向5 个与分生组织形成和器官边界建成相关的NAC 家族转录因子。其中CUC1和CUC2基因在拟南芥球形胚的叶原基之间表达,miR164 通过负调控CUC1/2影响分生组织的发育和器官原基的边界建立。NAC基因在胚发生和花发育过程中有重要作用,其功能缺失会导致花芽发育异常[10]。Guo 等[11]证 实miR164-NAC 调控模块和生长素信号通路存在密切的互作关系,miR164 功能缺失突变体中NACmRNA 积累,生长素信号通路受阻,最终导致侧根增加。相反,miR164 过表达会引发侧根数目减少。近期研究揭示了miR164-GhCUC2 模块通过调控脱落酸合成影响棉花的株型[12],而番茄SlMIR164A可以通过控制SlNAM2和SlNAM3的表达调节果实的成熟及营养品质[13]。NAC 家族是植物特异性转录因子超家族,广泛存在于植物界,其结构域最初的特征在于来自NAM、ATAF1/2 和CUC2 的共有序列[14]。大多数NACs 蛋白具有保守的DNA 结合域,N 端包含约150 个氨基酸,参与行使NAC蛋白的多种独特功能,而C 端具有高度可变的转录调节区域,富含丝氨酸、苏氨酸等残基,且该区域在不同亚群中存在差异,可能赋予不同亚群NACs 蛋白间的功能变异。某些NAC 转录因子还在C 末端含有负责锚定到质膜或内质网的跨膜基序,在需要表达时被蛋白水解切割后转移至细胞核。通过对数百个不同物种NACs基因的进化关系分析表明NAC 超家族内部存在多个亚群,这些NAC 家族成员在植物生长发育、果实成熟衰老以及生物和非生物胁迫响应等多个生物过程中发挥着关键作用[15]。另一方面,对NACs 蛋白的结构解析也取得一些进展,如通过X 光衍射分别获得ANAC019 和OsNAC1 保守域的晶体结构,并推断大多数NACs 蛋白可能以同源二聚体的形式发挥调控作用[16-17]。【本研究切入点】解析果实成熟与抗逆调控机制一直是采后生物学的重要科学问题,目前相关研究还有待深入和拓展,特别是针对microRNA-靶基因模块介导香蕉采后品质形成和冷害发生的调控机制尚不清楚。【拟解决的关键问题】本研究以香蕉为试验对象,对其采后成熟及低温胁迫下不同阶段的香蕉果实进行小RNA 测序,筛选分析与香蕉后熟及冷害密切相关的miR164 和NAC 转录因子,明确香蕉中的miR164-NAC 调控模块,并对该模块在香蕉后熟和冷害过程中的表达模式进行分析,以期为深入探究香蕉miR164-NAC 调控模块的功能奠定基础。
1 材料与方法
1.1 试验材料及处理
鉴于‘巴西蕉’高产优质,一直是我国香蕉的主栽品种,本试验选取其作为研究对象。果实于2019 年8 月采自广东省广州市南沙区万顷沙蕉园,采收时果实饱满度为7~8 成,采收后立即运回实验室。落梳后分为单个蕉指,清水清洗后再用0.1%施保克浸果3 min 后自然晾干。挑选大小均匀、无病虫害及机械伤的单果分成4 个处理:(1)对照组:自然后熟,置于23 ℃、相对湿度85%~90%条件下贮藏;(2)实验组1:100 μL/L C2H4密闭处理18 h 后,置于23 ℃、相对湿度85%~90%条件下贮藏;(3)实验组2:0.5 μL/L 1-MCP 密闭处理18 h 后,置于23 ℃、相对湿度85%~90%条件下贮藏;(4)实验组3:置于6 ℃、相对湿度85%~90%条件下贮藏。每个处理150个果实,设置3 次生物学重复。分别在贮藏第0、2、4、6、8 d 取对照组与处理组的香蕉样品,分离果皮和果肉,冻存。
1.2 试验方法
1.2.1 香蕉miR164 家族成员的鉴定及进化分析 首先基于前期的sRNA 高通量测序分析[18],获得香蕉中6 条MIR164基因家族成员的前体基因组定位、长度、自由能、miRNA 成熟序列及miR* star 序列等信息。根据前体序列信息,利用在线RNAfold 网络服务器(http://rna.tbi.univie.ac.at/cgi-bin/RNAWebSuite/RNAfold.cgi)分析香蕉MIR164基因家族前体序列的二级茎环结构。随后从miRBase 数据库(www.mirbase.org)下载所有植物物种MIR164基因家族成员的前体序列和成熟序列,按科属分类统计,利用Clustal Omega(https://www.ebi.ac.uk/Tools/msa/clustalo/)网络服务器对香蕉和其他代表性物种(选取禾本科、蔷薇科及十字花科代表)MIR164s基因的前体序列和成熟序列进行多重序列比对,分析进化特征,并在此基础上用iTOL 在线软件基于参数临近法对前体序列构建系统进化树。
1.2.2 香蕉NAC基因家族成员的miR164 靶位点预测及验证 从前期香蕉sRNA 测序结果中获取全部的成熟miR164 序列,使用Target prediction for plant microRNAs(TAPIR,http://bioinformatics.psb.ugent.be/ webtools/tapir/)对香蕉NAC基因家族的蛋白编码序列进行miR164 靶位点预测,Score 值设为5.0,自由能比值设为0.6。预测结果使用TBtools 中的Gene structure view 功能进行可视化[19]。另一方面,基于香蕉降解组测序分析[18],鉴定高置信度的miR164 的靶基因,以明确香蕉中特定的miR164-NAC 调控模块。利用烟草瞬时表达体系进一步验证miR164 与靶基因的互作需要两类载体[20]:一类为miRNA 超表达载体pBI121。设计引物用PCR 方法获得MIR164基因的前体,替代pBI121 载体中的β-葡萄糖醛酸酶(GUS)基因完成miR164 超表达载体的构建。另一类为改造过的绿色荧光蛋白GFP 超表达载体pMS4,其中GFP基因前有两个酶切位点XhoI 和XbaI,双酶切后用于插入miR164 在靶基因上的结合位点片段,该片段由两段寡核苷酸DNA 退火后合成。miR164 和靶位点如果能在烟草叶片上互作,则GFP 表达被抑制,荧光信号减弱。
1.2.3 香蕉NAC基因家族成员的鉴定分析 从第4 版香蕉基因组数据库(Version 4.3)下载全基因组文件,包括全部氨基酸序列和gff3 注释文件。分别在拟南芥基因组数据库(TAIR,http://www.arabidopsis.org/)和植物转录因子数据库PlantTFDB(http://planttfdb.gao-lab.org/)下载拟南芥和水稻的NAC 同源氨基酸序列,经手动去重后,共得到100 个拟南芥和141 个水稻的NACs 蛋白,建立参考序列库。采用TBtools 软件[19]的BLAST工具来检索香蕉基因组中的潜在NACs基因,其中E-value cutoff 设置为e-10,其他参数默认。从PFAM 蛋白数据库(http://pfam.xfam.org/)下载氨基酸序列NAM 保守结构域(PF02365)的HMM文件,在E-value cutoff 为0.01、其他参数默认的设置下,使用TBtools 软件的Simple Hmm Search来搜索香蕉基因组中的NACs基因。将BLAST 和Hmm Search 结果合并,手动去重,将所有筛选出的候选NACs基因氨基酸序列使用Pfam 和NCBI的CDD 数据库验证蛋白序列保守结构域。含有NAM 结构域的序列被确定为香蕉NAC基因家族成员,并根据其所在染色体位置的先后顺序对它们进行重命名。通过TBtools 中的Gene location visualize from GTF/GFF 工具,使用香蕉基因组的GFF3 注释文件来创建香蕉NACs基因的染色体定位图。使用MCScanX 对香蕉基因组内的同源复制事件进行分析,并通过TBtools 中的Advanced Circos 对香蕉NACs基因进行共线性分析。借助NCBI CDD 数据库确定香蕉NACs 蛋白保守结构域NAM 域所在的具体位置,并使用TBtools 中的Gene structure view 功能对香蕉NACs基因结构进行可视化[19]。同时,利用ExPASy(www.expasy.org)网站中的ProtParam 工具对香蕉NACs 蛋白的理化性质进行分析。
1.2.4 香蕉NACs 系统进化树的构建 使用ClustalX 2.0 对拟南芥、水稻和香蕉NACs 进行氨基酸多序列比对,利用TBtools 中的trimAL Wrapper 对多序列比对后的结果文件进行修剪,通过IQ-Tree 构建系统进化树,参数默认,最后使用iTOL 在线网站进行美化。
1.2.5 香蕉RNA 提取及小分子RNA 的Northern杂交 香蕉总RNA 的提取在热硼法基础上略有改动,具体参考曾俊[21]方法。小分子RNA Northern 杂交实验参考文献[20]并略作改动。配制15% PAGE 工作液,充分溶解后迅速加入10% APS 和凝固剂TEMED,随即灌胶插梳。等胶凝固后拔出梳子,电泳槽中加入适量1×TBE电泳液,120 V 预电泳30 min。RNA 样品制备:取总RNA 20 μL(浓度为1 μg/μL),加入20 μL 2×上样缓冲液,98 ℃变性2 min,快速置于冰上备用。预电泳结束后用注射器冲洗点样孔数次,点入RNA 样品。60 V 电压电泳30 min,接着调整为120 V 电泳90 min,直至下层溴酚蓝指示剂迁移至距离胶底部约1 cm 左右停止电泳。然后使用Mini 垂直电转槽(Bio Rad),设置60 V 电压,转膜90 min。随后紫外交联固定样品,60 ℃烘膜2 h 后装袋,4 ℃保存。使用Chemiluminescent Hybridization and Detection Kit(Thermo Scientific)进行杂交及信号检测,3’端生物素标记的杂交检测探针与miR164 成熟序列反向互补,选择香蕉U6 片段作为内参,探针由上海生工生物合成,序列见表1。配制杂交工作液,将膜正面朝内,贴放于玻璃杂交管中,加入杂交工作液在37 ℃预杂交30 min,随后在预杂交液中加入5 μL 生物素标记的miR164 探针(浓度为5 μmol/L),同样37 ℃杂交16~20 h。第2 d 在37 ℃杂交炉内,滚动洗膜。弃去杂交管中的严谨洗膜液,加入5 mL 显色试剂盒(Chemiluminescent Nucleic Acid Detection Module)中提供的封阻液,杂交炉温调至25 ℃,滚动封阻15 min。再取20 μL 链亲和素-辣根过氧化物酶(HRP,Streptavidin-Horseradish peroxidase conjugate),加入1 mL 封阻液中,再将混合液加入上一步封阻液中,继续室温滚动15 min。弃封阻液,加入10 mL 1×检测洗液洗膜。将膜从杂交管转移至干净洗盒中,加入底物平衡液50 mL,室温匀速摇动5 min,混合250 μL 鲁米诺溶液(Luminol/Enhancer solution)和250 μL H2O2溶液配制底物工作液。膜正面朝上平铺于透明夹膜上,加入底物工作液使其均匀覆盖整个膜,暗处室温孵育5 min。使用ChemiDocTMTouch Imaging System 成像系统(Bio Rad)检测杂交信号。根据信号强弱调整曝光模式及时长。

表1 RNA 探针和实时qPCR 引物序列Table 1 RNA hybridization probes and primers for real-time qPCR
1.2.6 香蕉NAC靶基因反转录及定量PCR 采用TaKaRa PrimescriptTMRT reagent Kit with gDNA Eraser 试剂盒(RR047A)对质量过关的香蕉总RNA 进行反转录,参照试剂盒说明书操作。将所得cDNA 溶液浓度统一稀释成50 ng/μL。靶基因定量PCR 采用TaKaRa TB GreenTMPremix Ex TaqTMII(Tli RNaseH Plus)试剂盒,依次加入10 μL TB Green Premix Ex Taq II(2×)、0.4 μL ROX Reference Dye II(50×)、0.4 μL Forward Primer(10 μmol/L)、0.4 μL Reverse Primer(10 μmol/L)、6.8 μL 超纯水以及2 μL cDNA,总体系为20 μL。使用ABI 公司7500 Fast 荧光定量PCR 仪进行反应,程序为:95 ℃预变性5 min,95 ℃变性5 s,60 ℃退火30 s,40 个循环。反应结束后,设置熔解反应95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s,60 ℃15 s。使用Beacon Designer 8.0 软件设计靶基因定量PCR 的引物,交由上海生工生物合成。定量PCR 选择香蕉RPS2作为内参基因,靶基因定量PCR 引物见表1。
2 结果与分析
2.1 香蕉miR164 家族成员的鉴定及进化分析
基于前期sRNA 测序结果,在香蕉中鉴定到6 个MIR164基因家族成员(相应成熟miR164 序列分别命名为mac-miR164 a~f),通过将这6 条前体序列比对到香蕉基因组V4.3,发现它们定位在第6、8 和11 号3 条染色体上,其中4 条位于4 个编码基因的内部,另外2 条则位于基因间区(详见数据附表 S1)。定位于第11 号染色体上的2 条MIR164基因前体与编码基因的外显子部分重合,而定位于第8 和第6 号染色体上的2条前体则完全处于编码基因的内含子区域(图1A)。经搜索和基于植物MIRNA基因位点鉴定标准进行筛选,从miRbase 数据库中共获得131条MIR164基因的前体序列,共产生70 条非冗余的成熟miR164 序列。依据现有数据库,miR164家族分布于18 科39 个植物物种中,属于保守度较高的一类MIRNA基因家族。其中,禾本科报道的MIR164最多、达30 条,成熟序列有18 条,分布于7 个物种中;其次是蔷薇科的4 个物种,有18 条前体序列和8 条成熟序列;排在第3 位的是十字花科5 个物种,共报道16 条前体序列和10 条成熟miR164 序列。从分布上看,miR164广泛分布在单双子叶植物中,甚至也同样存在于被子植物最原始的无油樟科植物互叶梅中。将香蕉中鉴定到的miR164 成熟序列与39 个已报道植物物种中的非冗余miR164 成熟序列进行比对,结果显示miR164 成熟序列在5’端较为保守,尤其是前8 位,而3’端序列呈现多变性,特别是第17、20 和21 位的序列,在不同物种中差异较为明显,其中香蕉miR164 也贡献了部分多样性(图1B)。比对结果表明该家族的基因扩张在进化过程中存在明显的重排和筛选,暗示其在不同物种中调控的复杂性,值得深入研究。接着分析测序鉴定到的香蕉6 条miR164 家族成员前体序列的二级结构。如图1C 所示,这些前体序列的长度介于100~120 nt,具有MIRNA基因前体典型的发夹茎环结构和较低的自由能(-70~-45 kcal/mol)。图中红色和蓝色标记的序列分别代表miRNA 成熟序列和miR* star 序列,其中有2 条前体未检测到miR*star 序列的表达。通过对香蕉与禾本科、蔷薇科及十字花科代表物种拟南芥的MIR164基因前体序列构建系统进化树,发现该家族能在单、双子叶植物间明显区分开来。但香蕉的6 条MIR164基因前体并没有全部聚在一起,而是分布在3 个亚群中,其中有5 条均与热带双子叶植物番木瓜聚为一类,包括测序丰度较高的mac-miR164a/b 和mac-miR164c,仅有一条低丰度的mac-miR164f 与单子叶禾本科植物聚为一类(图1D),这暗示香蕉MIR164基因家族的起源与双子叶植物更为接近。

图1 香蕉miR164 家族成员鉴定及进化分析Fig.1 Identification and evolutionary analysis of miR164 family members in banana
2.2 香蕉miR164 靶基因及miR164-NAC 调控模块鉴定
首先利用psRNATarget在线软件(http://plantgrn.noble.org/psRNATarget/)对香蕉miR164 家族成员所有可能的靶基因进行预测,发现大多数是编码NAC 结构域的转录因子(详见数据库附表S2)。同时,结合香蕉NACs基因家族成员的鉴定,预测miR164 的结合位点。然而,在鉴定到的所有香蕉NACs基因中,仅有5%具有miR164 的靶位点,这暗示着miR164-NAC 调控模块可能在香蕉物种进化过程中出现较晚,且miR164 靶点均位于接近NAM 保守结构域的3’UTR 区域(图2A)。另一方面,前期的香蕉降解组测序共鉴定到4 条受miR164 切割的NACs靶基因(均属于0类高置信靶基因,详见数据库附表S3)。降解组t-plot 证实,miR164 对这几个NACs靶基因都有较高的剪切效率,且切割位点较为一致(图2B~图2D)。烟草叶片的瞬转实验则进一步验证了miR164c 对香蕉NAC176的抑制作用(图2E)。而香蕉中这几个miR164 的NACs靶基因均位于第9 号染色体上。
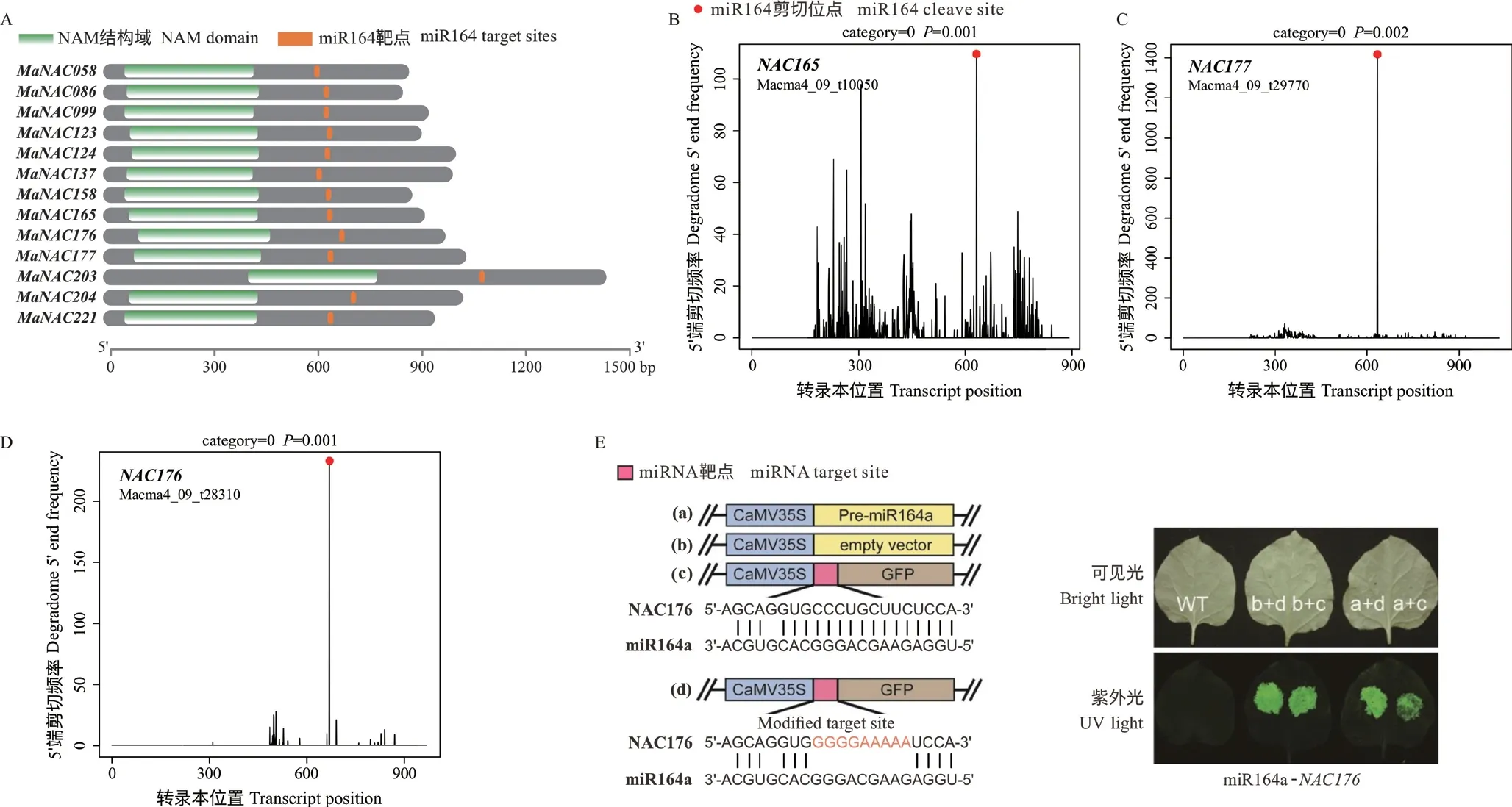
图2 香蕉miR164 靶基因及miR164-NAC 调控模块鉴定Fig.2 Identification of miR164 target genes and miR164-NAC regulatory module in banana
2.3 香蕉NAC 基因家族成员的鉴定分析
通过同源序列比对结合手动验证蛋白保守结构域,从第4 版香蕉基因组中共鉴定到222 个NACs成员,比基于第2 版基因组鉴定的结果多出41 个[22],按照所在染色体位置分别命名为MaNAC001~MaNAC222(详见数据库附表S4)。如图3 所示,这222 个香蕉NACs不均匀地分布在所有11 条染色体上。其中,6 号染色体编码最多、达32 个NACs基因,其次是10 号染色体、含28个NACs基因,8 号染色体仅编码12 个NACs基因。这些数量庞大的NACs基因可能源自芭蕉属谱系中发生的3 轮全基因组复制(WGD)事件。此外,串联重复和区段复制在香蕉NAC家族的显著扩张中也可能起到重要作用[23-24]。

图3 香蕉NAC 基因家族成员的染色体定位Fig.3 Chromosomal locations of in NAC gene family members in banana
使用默认参数,通过MCScanX 对每个香蕉NAC基因的重复事件进行分析,在222 个香蕉NACs中共鉴定出134 对同源基因,其中1、2 和4 号染色体上共存在4 对串联重复基因,其余130对同源基因均为区段复制,表明香蕉NACs基因进化的主要动力来源于基因的区段复制事件(详见数据库附表S5)。如图4 所示,香蕉NACs基因位于几乎所有染色体的同线性区块内。相应地,含有较多NACs基因的6 号和10 号染色体上区块间存在较多共线性关系。然而,1 号染色体虽然也编码数量较多的NACs基因,但却基本聚集在染色体的末端位置,且仅存在1 对串联重复和4对片段复制的同源基因,因而共线性关系也相对简单(图4)。

图4 香蕉NAC 基因家族成员在染色体上的关联Fig.4 Interchromosomal association of NAC gene family members in banana
2.4 香蕉NAC 基因家族成员的进化分析
为研究香蕉NAC基因家族的进化特征,对香蕉、拟南芥和水稻NACs 蛋白序列进行比较系统发育和亚群分布的分析。系统发育树将NAC 家族蛋白划分为23 个不同的亚群,比先前报道的分类[22]多出5 个亚群。如图5 所示,没有任何香蕉NACs基因分布在S5、S13 和S20 亚群中,而另一些香蕉NACs基因则形成独立的亚群,如S1、S2、S3、S8、S21 和S23。此外,绝大部分混合亚群同时含有来自单子叶植物和双子叶植物的NACs基因,表明这一超家族在单、双子叶物种中并非完全独立进化。总体而言,香蕉NACs基因在大多数进化分支中占据主导地位,尤其是S14 亚群(图5)。香蕉NACs基因在S14 亚群中的数量最多达61 个,其次是S15 和S12 亚群,分别包含36 个和20 个NACs基因。在香蕉NACs基因形成的6 个独立亚群中,数目较多的是S1 和S2 亚群,分别含有24 个和14 个NACs基因,表明这些香蕉NACs很可能是在水稻中丢失后又在香蕉中分化获得的,暗示其可能具有特定功能。但转录组数据显示,仅有不到30%的NACs基因在香蕉后熟过程中或低温胁迫下有表达(详见数据库附表S6),表明香蕉NACs基因高度冗余,或某些NACs基因可能只在特定条件下才表达及发挥功能。

图5 香蕉与拟南芥、水稻NAC 转录因子的系统发育分析Fig.5 Phylogenetic analysis of NAC transcription factors from banana,Arabidopsis thaliana and Oryza sativa
2.5 香蕉NACs 基因的结构与功能分析
基于蛋白比对构建系统发育树,在此背景下对有表达的66 个香蕉NACs基因结构进行注释,明确其外显子-内含子组成,并通过TBtools 进行可视化。结果(图6)表明,除MaNAC079仅含一个外显子、无内含子外,大部分香蕉NACs基因均含有3 个外显子和2 个内含子、占比65%。其中MaNAC062含有最多的外显子(44 个)和内含子(43 个),这是由于第4 版香蕉基因组中的MaNAC062基因整合先前第2 版基因组中的2个基因(5’端为旧版基因)的缘故。这些香蕉NACs基因中NAM 结构域的长度,除MaNAC079(141 bp)外均介于315~411 bp。多数情况下,同一亚群内的NACs基因有较为相似且保守的结构,但同时也存在单个内含子丢失或获得的情况,但S7、S10、S12、S16 和S22 组内成员的基因结构相差较大。此外,同源基因对的外显子/内含子结构分析也进一步验证了系统发育树和重复事件的分析结果。另一方面,理化分析结果表明,所有香蕉NACs 编码蛋白的平均长度为353 个氨基酸,平均分子量为39.5 kDa,等电点范围为4.44~10.33。除MaNAC079 外,所有香蕉NACs 蛋白均为亲水性,且仅有不足15%的NACs 属于稳定蛋白(详见数据库附表S4)。

图6 香蕉NAC 家族蛋白聚类及基因结构Fig.6 Protein clustering and gene structure of NAC family members in banana
图5 中用蓝色三角形标记了已报道的16 个香蕉NACs基因(详见数据库附表S7),有5 个分布在含香蕉NACs基因数目最多的S14 亚群,其中3 个(MaNAC177、MaNAC176、MaNAC207)被报道在乙烯诱导的香蕉后熟过程中发挥作用[25],而另外2 个(MaNAC210、MaNAC217)则与次生细胞壁的形成密切相关[26]。然而,同样受乙烯上调的MaNAC121、MaNAC132和MaNAC126则分别位于S16、S21 和S21 亚群中。这些结果表明香蕉NACs基因在果实后熟过程中所起的作用可能是多元化的。此外,香蕉NACs还能对各类胁迫作出响应,通过多种渠道发挥抗逆作用。例如,MaNAC129 通过调节气孔关闭及H2O2含量来增强香蕉的耐旱性[27],MaNAC085和MaNAC141 均正向参与了香蕉对高盐和干旱胁迫的响应[28],MaNAC176 可通过与WRKY 家族蛋白互作,增强香蕉抵抗炭疽菌过程中病程相关基因的表达[29]。
2.6 miR164-NAC 模块在香蕉后熟和冷害过程中的表达分析
结合sRNA 测序数据,首先对香蕉miR164家族6 个成员的表达进行Northern 杂交检测,分别选取后熟和冷害进程中不同时期的香蕉样品进行检测(图7A)。其中,mac-miR164 d~f 未检测到杂交信号,表明丰度极低,而另外3 个丰度较高的成员均在香蕉后熟过程中上调表达,miR164a(图7B)。此外,杂交结果显示伴随后熟进程,miR164a 的表达在乙烯处理的香蕉果皮和果肉中均持续增强。1-MCP 处理后,香蕉miR164a 在果皮中的表达未受明显影响,但在果肉中出现先降低后上升现象(图7B)。随后检测受miR164 靶向调控的2 个表达量较高的MaNAC165和MaNAC176的转录本在后熟过程中的丰度变化,图7C 显示,MaNAC176在果皮和果肉中均响应乙烯处理且随后熟进程逐渐下调表达,这与乙烯处理后果皮和果肉中miR164a 的表达模式正好相反。1-MCP 处理下MaNAC176的表达无明显变化,仅第8 天在果皮中的表达显著升高。相比MaNAC176而言,MaNAC165在果皮和果肉中的转录本丰度更高,在乙烯处理后的果皮中其表达呈现先升高后快速下降的趋势,而在果肉中则持续下调(图7C)。总体而言,1-MCP处理对MaNAC176和MaNAC165的表达影响不明显,特别是果肉样品。另一方面,在冷害的果皮样品中,香蕉miR164a 的表达则被显著诱导,相应地,MaNAC165和MaNAC176两个靶基因的表达均出现明显下调(图7B、图7C)。
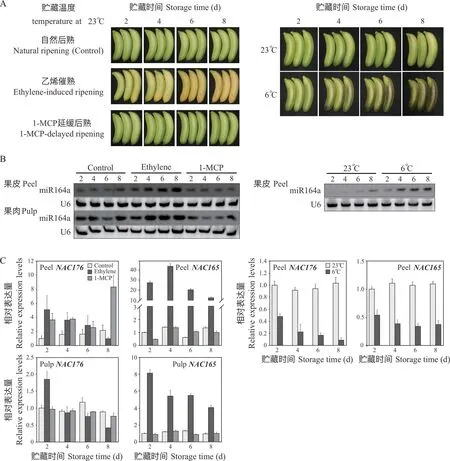
图7 香蕉后熟和冷害过程中miR164-NAC 模块的表达变化Fig.7 Expression changes of miR164-NAC module during banana ripening and chilling injury
3 讨论
香蕉基因组共编码222 个NACs成员,数量相当庞大。然而,转录组数据显示仅有不足30%的NACs基因产生表达,特别是聚集于第1、4和10 号染色体上的多个NACs基因均无表达,表明香蕉中该家族大多数成员存在功能冗余或时空表达特异性。另一方面,只有5%的NACs基因具有miR164 的靶切位点,这一比例在有表达的NACs基因中上升为20%。但相比香蕉中其他保守miRNA-靶基因模块(如miR156-SPL、miR482-NBS-LRR)而言,香蕉miR164-NAC 模块中的NAC靶标的范围仍较为局限,暗示该调控模块可能在香蕉的物种演化过程中出现较晚。
作为植物中一个高度保守的miRNA 家族,miR164 保守的靶基因NAC也是植物特有的一类转录因子,且miR164-NAC 模块已被证实在调控植物生长发育和抗逆过程中发挥重要作用。研究发现,草莓des突变体相比野生型,其miR164a的成熟体在第19 位核苷酸上存在碱基突变,miR164a 通过靶向植物组织器官发育相关基因FvCUC2,影响草莓叶片和花器官的形态建成[30]。另有研究发现乙烯处理后,猕猴桃miR164 的表达受到显著抑制,且与靶基因AdNAC6、AdNAC7的表达呈明显负相关。AdNAC6、AdNAC7 能够结合猕猴桃乙烯生物合成、细胞壁降解和香气合成基因的启动子,进而调控猕猴桃品质形成及后熟进程[31]。在香蕉中,MaNAC089 蛋白(又名MusaATAF2-like)可通过调节叶绿素降解和H2O2积累诱导香蕉叶片衰老[32],进一步研究发现,该蛋白还可以通过诱导细胞分裂素超敏和类黄酮积累,调节香蕉植株幼苗的生长[33]。
本研究基于sRNA 高通量测序,发现香蕉miR164 家族中共有6 个成员(miR164a/b/c/d/e/f),其中miR164a/b/c 的积累水平与其对应NAC靶基因的表达量呈明显负相关关系。然而,与同为呼吸跃变型果实的猕猴桃不同,香蕉中miR164 的表达受到乙烯强烈诱导,且随后熟进程呈上调趋势,而其靶向的MaNAC176的表达则随香蕉后熟进程逐渐减弱。miR164 另一个靶基因MaNAC165在乙烯催熟的果皮中出现先上升后下降的趋势,基本上与miR164 的表达模式相反。NAC 类转录因子在香蕉果实后熟调控中的作用已有不少相关报道。早期研究发现,MaNAC128、MaNAC129的表达在自然后熟、乙烯催熟和1-MCP 延缓后熟的香蕉果实中,随着乙烯释放和后熟进程而不断增强[34]。作为转录激活子,MaNAC128和MaNAC129 均能够结合乙烯合成关键基因MaACS1和MaACO1的启动子,激活乙烯的生物合成,加速香蕉后熟与品质形成[35]。与此相反,MaNAC197在香蕉后熟过程中明显下调,而其作为转录抑制子,通过结合MaACS1和MaACO1的启动子抑制其表达[34]。类似地,MaNAC085 和MaNAC198 也相继被报道是香蕉成熟衰老过程中的负调控因子[36-37]。总体来看,上述结果暗示着MaNAC176 和MaNAC165 很可能是香蕉后熟的负调控因子,而miR164 则通过负调控这两个靶基因的表达,参与促进香蕉后熟进程中的乙烯合成。另一方面,本研究结果表明,香蕉miR164能够被低温诱导,同样可能通过负调控其靶基因MaNAC176和MaNAC165来应对冷害。前期报道多个香蕉NAC 家族成员参与调控逆境胁迫响应,如MaNAC121 通过与CBF1 蛋白互作参与果实采后的低温胁迫应答[38],MaNAC129 通过调节气孔开合度和H2O2含量增强香蕉抗旱性[27],MaNAC085 和MaNAC141 均能提高香蕉对高盐和干旱的耐受性[28]。近期报道指出,MaNAC127和MaNAC164 可通过上调磷脂降解相关基因,促进磷脂降解积累磷脂酸,从而引发香蕉的冷害症状[39]。本研究发现的香蕉miR164-NAC165/176 模块很可能是香蕉发生冷害的又一个关键调控通路,具体的分子机制还需通过转基因手段进一步证实。
4 结论
本研究基于高通量测序及第4 版香蕉基因组信息,鉴定出6 个香蕉miR164 家族成员,详细描述其染色体定位、序列同源性、前体二级结构及其与代表性物种间的系统进化关系。明确了香蕉miR164 在不同NACs基因上的切割位点,并通过降解组和烟草瞬时共转化验证香蕉中多条miR164-NAC 调控模块。利用更新版香蕉基因组注释,鉴定出222 个香蕉NACs成员,明确其在基因组上的定位、重复事件、与拟南芥和水稻的系统发育关系,并结合转录组数据呈现部分香蕉NAC 家族成员的基因结构。分别设置香蕉后熟和低温实验,通过小分子RNA 杂交和qRT-PCR,分析鉴定到的香蕉miR164-NAC 调控模块在后熟和冷害两种过程中的表达情况。综上,本研究系统筛选了与香蕉后熟及响应低温胁迫密切相关的miR164 及其靶基因NAC 转录因子,可为后续香蕉miR164-NAC 模块的克隆及功能验证奠定基础。
