代谢组学在失眠症及其中医药干预研究中的应用进展
2023-11-13韦姗姗邱祥玉方留斌杨梦霞汤滴微
胡 金 韦姗姗 邱祥玉 方留斌 阳 吉 杨梦霞 汤滴微
(1 云南中医药大学基础医学院,昆明,650500; 2 云南中医药大学第二临床医学院,昆明,650500)
失眠作为现代社会普遍存在的健康问题,严重影响人们的生命质量和身心健康,甚至会加重或引发其他疾病。长期失眠是肥胖、糖尿病、高血压、心脏病和中风的危险因素,从长远来看,可能会导致过早死亡[1]。大量流行病学研究显示,失眠在人群中已相当普遍,其发病率达35%~50%[2]。失眠已被证明是生物、心理和社会因素相互作用的结果,但其影响睡眠时间和睡眠质量的病理作用机制目前尚未被阐明[3-4]。多导睡眠图是诊断原发性失眠的金标准,但其价格昂贵且耗时,在临床实施过程中存在一定困难[5]。因此,目前失眠的诊断仍依靠患者的自我报告,缺乏准确、快速、客观的失眠诊断标志物。
代谢组学是一种通过评估现有条件所带来的“净”生物效应(无论是健康、疾病还是干预)来认知整体的生理或病理状态的综合方法[6]。能够直接反映在特定时刻发生的代谢途径的活动,并可以放大在基因组水平上控制的微小变化,在生物标志物发现、药物作用机制、发病机制的补充、中医辨证等方面发挥着不可替代的作用。近年来,研究者运用代谢组学方法发现原发性失眠与氨基酸代谢通路、神经递质代谢通路、能量代谢、脂质代谢通路密切相关。并基于代谢组学探究相关催眠药物(包括中药、中药单体、化学药物)对相关代谢标志物的调控作用。本文总结了代谢组学在失眠方面的研究进展,以求对失眠的生物标志物和代谢途径有更深刻的认识,为诊断、预防、治疗失眠提供新的思路。
1 代谢组学技术及其运用
代谢组学被定义为定量测量生命系统对病理生理刺激或基因修饰的时间相关多参数的一门学科[7]。其基于高效液相色谱、气相色谱-质谱联用、液相色谱-质谱联用、磁共振成像等技术平台,以血液、尿液、脑脊液、组织、粪便、细胞等为检测样本,以获得差异性代谢物,并基于差异性代谢物进行快速和全面的分析来阐明生理或病理途径[8]。此外,代谢组学具有降低检测限制和持续监测的优势,其无创性、敏感性和持久性等特性在诊断标志物发现、疾病预后、药物作用机制、药效评价、中医辨证方面发挥着自己独特的作用[9]。
2 失眠与相关代谢途径
2.1 失眠与氨基酸、神经递质代谢 睡眠调节包括3个基本过程:一是调节清醒时睡眠倾向上升和睡眠时睡眠倾向消散的稳态过程;二是调节昼夜节律过程,基本上独立于先前的睡眠和觉醒状态,并决定睡眠倾向高低的周期交替;三是在睡眠中发生的经典过程,表现为非快速眼动睡眠(Non-Rapid Eye Movement Sleep,NREM)和快速眼动睡眠(Rapid Eye Movement Sleep,REM)2种基本睡眠状态的交替过程[10]。其调节是复杂的,涉及不同的大脑回路和神经递质。一方面,睡眠和觉醒控制是由唤醒促进神经元和促进睡眠的神经元相互协调并创建一个系统的“开关”,以此来调控睡眠觉醒行为。其中觉醒由唤醒促进神经元控制,包括蓝斑的去甲肾上腺素能神经元、中缝核的5-羟色胺能神经元、结节乳头核的组胺能神经元和下丘脑外侧区的食欲素神经元。促睡眠神经元包括间脑的褪黑素神经元和视前腹外侧核/中间核、视前正中核和脑干面旁区的γ-氨基丁酸能神经元[11]。另一方面,清醒和睡眠状态之间的复杂调节过程需要由脑实质中不同的神经化学变化协调。如参与唤醒的分子,食欲素、血清素、去甲肾上腺素、组胺、多巴胺、肾上腺素;用于NREM的γ-氨基丁酸、腺苷、前列腺素和用于REM的乙酰胆碱和谷氨酸等分子负责每个阶段的表达和维持[12]。
氨基酸及其代谢产物在神经系统健康和功能中发挥着重要作用,它们不仅是蛋白质的组成部分,也是大部分神经递质合成的前体。研究表明,作为自身神经递质的氨基酸(如甘氨酸、谷氨酸、天冬氨酸)通常很难通过血脑屏障,而一些作为大脑中各自神经递质前体的氨基酸如色氨酸、酪氨酸、精氨酸、苏氨酸、甘氨酸等则更容易穿过。因此,这些神经递质的合成可能会受饮食提供的这些前体分子的可用性的影响[13]。
其中,色氨酸是神经递质5-羟色胺的前体,经色氨酸羟化酶催化首先生成5-羟色氨酸,再经5-羟色氨酸脱羧酶催化成5-羟色胺。色氨酸是一种可减少睡眠潜伏期的氨基酸[14]。一般来说,大脑中的色氨酸是不饱和的,因此服用色氨酸会导致5-羟色胺合成增加[15]。此外,色氨酸也是合成褪黑素的前体,色氨酸在色氨酸羟化酶的作用下合成5-羟色胺,在脱羧酶的作用下进一步形成血清素,在5-羟色胺-N-乙酰转移酶和N-乙酰血清素O-甲基转移酶的催化作用合成褪黑素[16]。褪黑素已被证明可以同步昼夜节律,并改善睡眠的开始、持续时间和质量[17]。
酪氨酸是儿茶酚胺类神经递质多巴胺、去甲肾上腺素、肾上腺素合成的前体物质,其首先在酪氨酸羟化酶的作用下形成二羟基苯丙氨酸,在脱羧的作用下进一步形成多巴胺,在多巴胺羟化酶的作用下形成去甲肾上腺素,进一步在苯乙胺-N-甲基转移酶酶的作用下合成肾上腺素[18]。多巴胺的细胞外水平在清醒期间较高,而在NREM期间较低,这表明多巴胺神经元具有清醒活性[19]。去甲肾上腺素由几个脑干核团产生,在激活交感神经系统的情况下有助于产生唤醒。蓝斑是前脑去甲肾上腺素的主要来源,其在清醒时放电最快,在NREM期间活动较少,而在REM期间几乎沉默[20]。夜间睡眠期间的肾上腺素浓度显著低于清醒期间,而REM期间的肾上腺素浓度显著低于NREM,在早晨清醒后肾上腺素浓度逐渐开始升高,表明交感神经系统肾上腺素的分泌在睡眠觉醒中起到关键作用[21]。研究发现,容易出现睡眠问题的人具有过度活跃的交感神经系统[22]。
支链氨基酸(包括亮氨酸、缬氨酸和异亮氨酸)被积极用作氨基酸供体以在大脑中合成谷氨酸[23]。而三羧酸循环的中间产物α-酮戊二酸是形成谷氨酸的前体物质,其在乙酰辅酶A的作用下进入三羧酸循环通过转胺反应生成谷氨酸,谷氨酸在γ-氨基丁酸旁路代谢过程中在谷氨酸脱羧酶催化作用下谷氨酸脱羧生成γ-氨基丁酸[24]。γ-氨基丁酸能神经元和神经递质调节杏仁核中的大脑回路,以调节REM和NREM,尤其是慢波睡眠睡眠和调节视交叉上核昼夜节律[25-26]。
组氨酸是组胺的前体,经脱羧后可形成组胺[27]。由于其能够穿过血脑屏障,故血液中的组氨酸水平可能反映了结节乳头核的脑组胺水平和组胺能神经元活动,它们在维持觉醒中起着关键作用[28]。结节乳头核放电率和组胺释放在清醒时最高,在NREM睡眠时较低,在REM睡眠时最低[29-30]。服用组胺或组胺受体激动剂可增加皮层激活和觉醒,同时减少NREM和REM睡眠[31-32]。相反,减少组胺信号转导的药物,包括经典抗组胺药,如H1受体拮抗剂苯海拉明、吡拉明和低剂量多塞平会增加NREM和REM睡眠[33]。胆碱和乙酰辅酶A相互作用生成乙酰胆碱[34],其在REM的触发和长期调节中都起着重要作用[35]。神经递质合成的前体物质及其作用见图1。
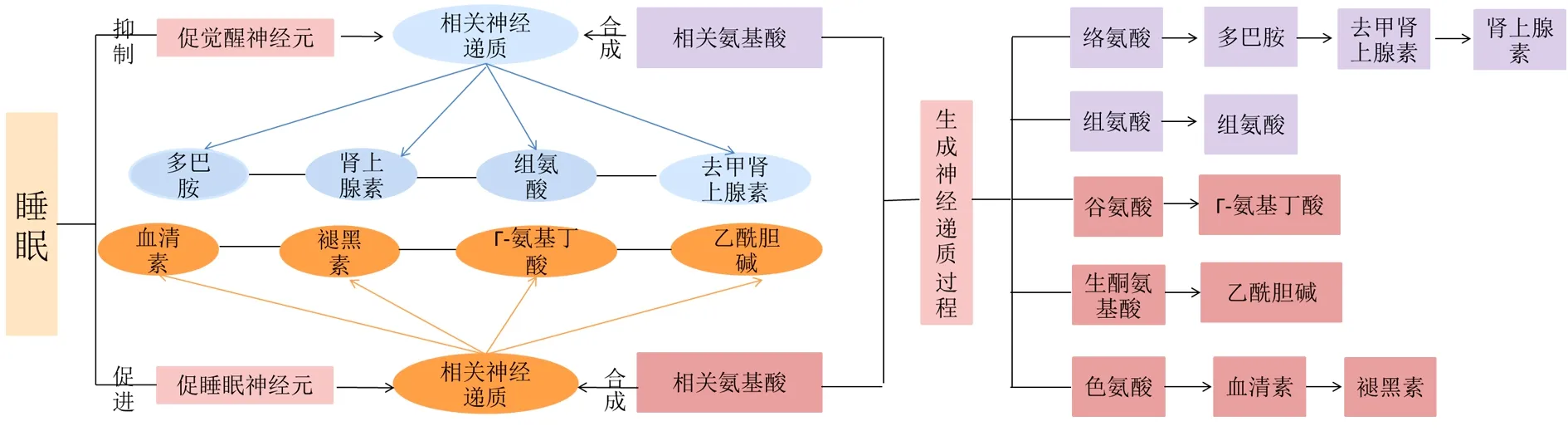
图1 睡眠与氨基酸、神经递质代谢关系
2.2 失眠与糖、神经递质代谢 大脑具有独特的代谢特征,只能通过三羧酸循环和氧化磷酸化分解有氧葡萄糖来获得所需的能量[36]。糖酵解可以忽略不计,仅在长时间禁食时观察到来自脂肪酸的酮体的使用。神经元的活动水平与大脑中的能量消耗密切相关,随着神经元活动的增加,能量消耗也随之增加[37]。从能量的角度来看,睡眠主要功能之一是恢复由清醒的能量需求引起的大脑能量代谢[38]。在睡眠期间,ATP生成增加,使能量储备增加,从而减少炎症,促进细胞存活。而在睡眠剥夺期间,ATP的生成显著减少。大脑不再能够启动修复,导致神经细胞死亡。细胞死亡最终会导致情感障碍、记忆和学习障碍以及认知功能障碍[39]。这与突触稳态理论一致,大脑每天需要与环境断开一段时间,以恢复清醒时消耗的能量,在不断学习生活经验的过程中建立新的突触并加强突触网络[40]。
腺苷是“能量货币”ATP水解的最终产物。腺苷和睡眠的增加与完整的胆碱能系统有关,腺苷代谢和通过三磷酸腺苷、二磷酸腺苷和单磷酸腺苷的转运使腺苷与细胞的能量代谢直接相关[37]。在中枢神经系统中,神经元活动的增加会增加能量消耗以及细胞外腺苷浓度。在大脑大多数区域,细胞外高腺苷浓度作用于腺苷受体会降低神经元活性,从而降低能量需求。而在睡眠剥夺期间,腺苷浓度增加将会诱导睡眠,但在这一过程中也会阻止腺苷浓度增加从而取消恢复性睡眠。随着研究的深入,糖原对睡眠的影响也逐步进入了研究者们的视线。Benington和Heller提出的理论指出,长时间清醒会导致大脑糖原储存的消耗进一步导致睡眠需求的增加[41]。这一理论得到了大量实验数据的支持,并引起了人们对星形胶质细胞调节睡眠的关注(糖原几乎完全储存在星形胶质细胞中)[42]。
2.3 失眠与脂质代谢 改变脂肪酸代谢会影响睡眠信号[43]。CRISPIM等[44]研究发现高脂肪摄入,特别是在晚餐,与睡眠效率降低、第一次快速眼动发作的时间延长、在第二阶段睡眠花费时间延长,REM时间减少,以及在睡眠开始后醒来清醒的时间增加有关,而纤维摄入则与深度睡眠、恢复性睡眠有关。因此,保持富含纤维、低糖和其他非纤维碳水化合物的饮食可能是改善睡眠不良者睡眠深度和结构的有效方法[45]。睡眠时间的改变可以直接影响脂肪细胞释放瘦素,从而改变饥饿的神经内分泌调节。研究表明,在睡眠期间,与对照组比较,睡眠呼吸暂停低通气综合征(Obstructive Sleep Apnoea,OSA)患者的游离脂肪酸显著增加,并且这种增加在整个睡眠期间持续存在,尤其以NREM睡眠为主[46]。而儿童受试者比成人OSA受试者表现出更多与碳水化合物和氨基酸代谢异常相关的代谢产物。此外,成人OSA似乎与肥胖更相关,这可以解释为什么脂代谢异常在成人中比在儿童OSA患者中更普遍[47]。脂质代谢途径在OSA中已经凸显其发现诊断标志物的潜能。如根据6种代谢产物(4-羟基戊烯酸、阿拉伯糖、甘鹅去氧胆酸-3-硫酸盐、异亮氨酸、丝氨酸和黄嘌呤)的表达水平,可以将OSA患者与健康人区分开来,其敏感度和特异度分别为75%和78%[48]。提示这些差异性代谢物可能成为OSA的潜在标志物。代谢产物见图2。
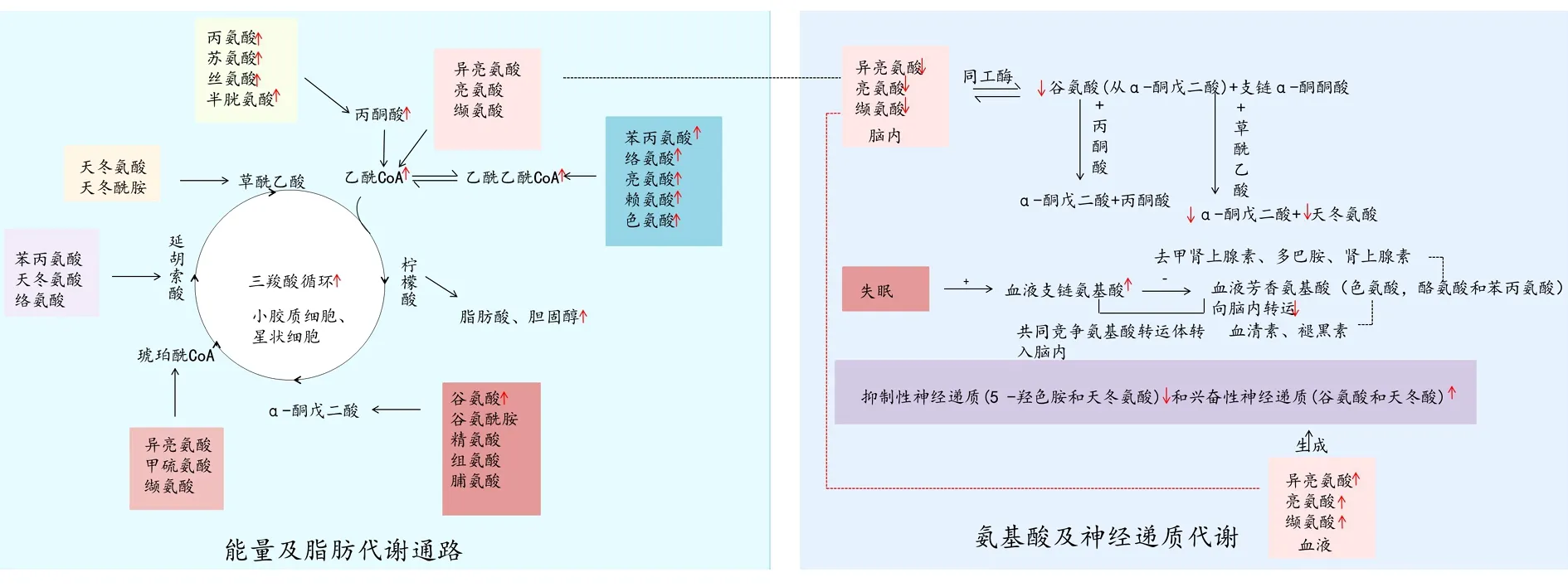
图2 代谢产物在失眠中的网络
3 代谢组学在失眠中的运用
3.1 失眠引起其差异物的改变,可能为失眠发病的潜在机制 失眠的发病机制主要涉及下丘脑-垂体-肾上腺轴、调节睡眠觉醒的神经递质紊乱等方面[49-50]。通过上述氨基酸代谢与神经递质的关系可以看出,代谢组学在阐述失眠的机制方面有一定的潜力,但是在揭示其机制方面可能还需要优化其实验方案,以求弄清失眠是因,代谢产物变化是果,还是代谢产物变化是因,失眠是果。现有代谢组学在失眠方面的运用只能提示失眠会对氨基酸代谢通路、神经递质代谢通路、糖脂代谢通路的代谢产物引起扰动,但具体能否揭示其机制,需要进一步验证。如当缺失这些差异性代谢物时,能否引起失眠是验证其发病机制的一个有效手段。失眠引起其差异性代谢产物的改变具体运用见表1。分析失眠患者及动物模型差异性代谢产物及其涉及通路发现,虽然失眠动物模型和失眠患者所涉及的通路基本相似,涵盖氨基酸代谢通路和能量代谢通路,但是失眠患者还涉及脂质代谢通路,其中存在差异的原因可能为样品选择不同所造成(失眠模型选择脑组织为样品,而失眠患者主要选择血清和血浆来进行检测),但也可能是失眠发生的一条代谢通路。该结果提示在失眠的代谢组学研究中需要考虑种属以及组织来源问题。而失眠患者之间比较,即使是来源相同的组织,其代谢产物也存在很大差异。此外,失眠患者代谢差异物的变化还与性别相关。由上可推知,失眠的代谢组学应该考虑性别之间的差异。而对于失眠患者代谢差异物的不同,在排除代谢组学测试处理结果的问题后,应该深层剖析挖掘其是否参与调控睡眠。
3.2 代谢组学在失眠中医证型方面的运用 整体观念、辨证论治是中医诊疗的核心,而代谢组学的时相性、动态性、整体性和系统性等特点与中医核心思想不谋而合[56]。非靶代谢组学注重人体的“态”,全面系统地反映现阶段疾病的状态、动态和态势。而靶向代谢组学则能实现打靶,找到病证的特异性标志物。非靶与靶向结合能够有助于证候模式的识别、有助于中医学与现代医学的结合,并且量化、统一中医的一些感官评价模式[57]。中医研究者将代谢组学运用到失眠的研究当中并取得了一些进展。失眠的中医证型大致可分为肝郁化火证、肝郁脾虚证、心肾不交、心脾两虚等。邓丹丹等[58]通过比较肝郁化火证、痰火内扰证、阴虚火旺证3种证型的失眠患者的血液,发现精氨酸、甘氨酸、Phytosphingosine-1-P是其重要差异性代谢物。其中,Phytosphingosine-1-P是区分失眠肝郁化火证、痰火内扰证、阴虚火旺证3种证型之间的典型代谢产物,这或许是能成为这3种失眠证型的鉴别点。杨钰涵等[59]通过腹腔注射对氯苯丙氨酸(P-chlorophenylalanine,PCPA)和多因素(四肢束缚、游泳、禁食、禁水、夹尾、明暗颠倒、电击足底、鼠笼倾斜45°潮湿垫料)交互作用复制心肾不交证失眠动物模型,通过血清代谢组学分析其代谢产物,发现多因素共同作用方法复制的心肾不交与磷酸戊糖代谢,丙氨酸、天冬氨酸和谷氨酸代谢,组氨酸代谢,牛磺酸和亚牛磺酸代谢相关,多因素交互作用的心肾不交模型的3-亚磺酰苯胺和组氨酸含量升高以及其他指标升高提示该种模型更符合临床失眠患者的特点。这或许提供更为可靠的心肾不交失眠证模型,为药物研究提供模型基础。见表2。

表2 针对中医证型的失眠代谢组学研究
3.3 代谢组学在中医药防治失眠研究方面的应用 代谢组学对于理解药效学、毒理物质基础、作用机制及剂量和疗程的确定具有重要的现实意义[63]。目前,对于失眠的代谢组学研究主要集中在药物的作用机制以及药效学研究,对于镇静催眠药物毒理物质基础以及机制、减毒问题、疗程问题未涉及。而失眠患者往往以慢性失眠居多,需要长期服药。因此需要在此方面展开研究。从表中看出,不同安神药物的代谢通路多与氨基酸代谢通路相关,但部分药物也有神经递质、能量代谢、脂质代谢相关,其原因可能与药物成分、作用靶点等方面相关。见表3。
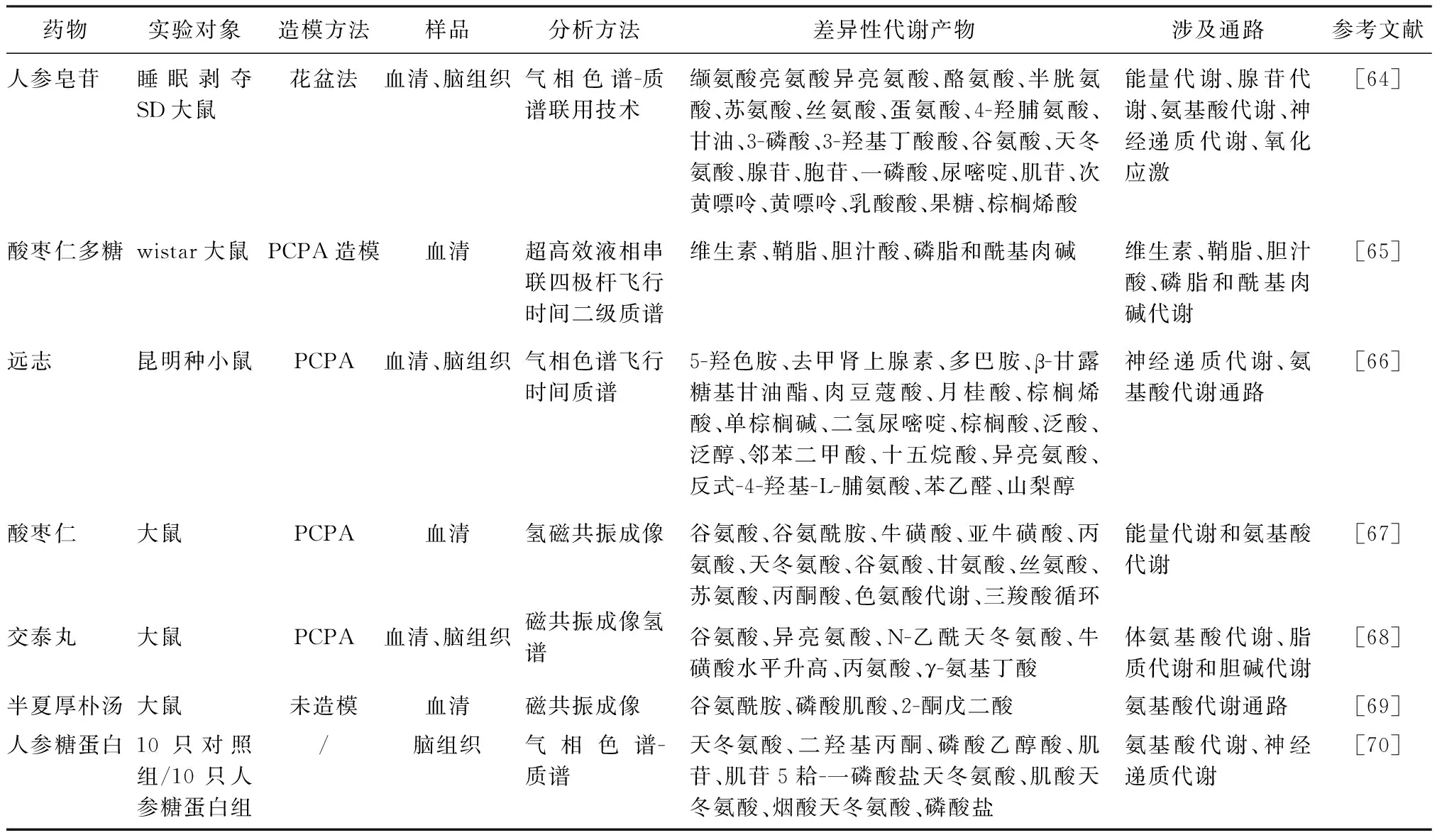
表3 中医药防治失眠的代谢组学研究
4 讨论
代谢组学作为一种研究工具,为动态观察人体内的生理病理过程提供了便捷的方法。然而分析前阶段的样品选择、收集、储存和制备等变量可能会影响最终结果。因此,在实验过程中首先要保证标本的可靠性,以获得高质量数据。此外,代谢组学需要复杂的数据统计技术,尤其是在小样本情况下[74]。数据的统计过度拟合可能会导致错误,因此需要多组学相互验证以求更加准确的结果[75]。
利益冲突声明:无。
