玉米大斑病菌丝氨酸蛋白酶基因StSp8 的克隆、原核表达及其表达模式分析
2023-11-11周启慧杨俊芳尹贵波刘玉卫巩校东贾振华谷守芹
周启慧,杨俊芳,尹贵波,刘玉卫,巩校东,贾振华,谷守芹
(1.河北农业大学 生命科学学院 / 华北作物改良与调控国家重点实验室 / 河北省农业微生物生物信息利用技术创新中心,河北 保定 071000;2.河北省科学院 生物研究所,河北 石家庄 050051)
玉米大斑病是一种严重威胁玉米产量的叶部真菌性病害。引起该病害的病原菌为玉米大斑病菌(Setosphaeria turcica)[1],该病菌通过感染玉米叶片使其形成局部病变和坏死,从而影响玉米的光合作用[2]。该病害主要发生在气温20 ~25 ℃且高湿度的条件下,其早期病斑呈水渍状,青灰色斑点;后期形成边缘暗褐色,中央黄褐色或灰褐色的梭形病斑[3-6]。当环境湿度高时,病斑表面则附着灰黑色的霉层[7]。严重时可加重茎腐病的危害,导致玉米倒伏,使玉米产量降低[8-11]。因此,深入研究玉米大斑病菌的致病机理,对该病害的防治和研发新型抗真菌药物具有深远意义。
真菌与宿主之间的相互作用可以通过多种分子机制来实现。其中,丝氨酸蛋白酶(Serine protease)是真菌分泌到宿主体内的重要毒性因子之一[12];丝氨酸蛋白酶超家族成员具有外肽酶、内肽酶、寡聚肽酶等活性的特点。其物种跨度大,广泛存在于病毒、细菌以及真核生物体内[13],且执行的生理功能也是多种多样的,例如与细胞的水解酶活性、细胞粘附力、芽管的形成能力相关[14],在细胞分化和病原入侵等过程中也发挥着重要的作用[15]。在真核生物中,蛋白酶执行各种生理功能时不是直接完成的,而是通过一系列的酶或蛋白质共同作用完成[16]。在此过程中,丝氨酸蛋白酶扮演着重要的角色,作为上游激活因子或下游执行因子行使功能,在执行生理功能时发挥关键作用[17]。有研究表明,烟曲霉(Aspergillus fumigatus)作为哮喘病患者患病的一个重要诱因,其主要过敏原很有可能是分泌量最高的丝氨酸蛋白酶[18]。在稻瘟病菌(Magnaporthe oryzae)中,丝氨酸蛋白酶在细胞内外分布较广,干扰丝氨酸蛋白酶基因后的稻瘟菌突变体气生菌丝较少,致病性降低,表明丝氨酸蛋白酶与稻瘟菌的致病性及生长发育相关[19]。
目前,丝氨酸蛋白酶在玉米大斑病菌中的作用尚未明确。本研究以野生型玉米大斑病菌cDNA 为模版,克隆丝氨酸蛋白酶StSp8基因,并对其进行生物信息学分析,构建原核表达载体,利用IPTG诱导重组蛋白[20-22],从而获得了StSp8 蛋白。分析病菌5 个重要发育时期(菌丝、分生孢子、芽管、附着胞和侵入钉)的qRT-PCR 数据,明确该基因的表达模式。本研究不仅为研究探索丝氨酸蛋白酶在玉米大斑病菌中的具体功能奠定基础,也为开发病害防治策略提供理论依据。
1 材料与方法
1.1 材料及试剂
玉米大斑病菌野生型菌株01-23、玉米感病品种‘B73’、原核表达载体pET28a,均由华北作物改良与调控国家重点实验室保存;大肠杆菌(Escherichia coli)感受态DH5α 和BL21(DE3)购于北京全式金生物技术有限公司;克隆载体pMD-19、小型质粒提取试剂盒购于OMEGA 公司;便携型植物RNA 快速提取试剂盒、RNA 反转录试剂盒购于TaKaRa 公司;引物及测序均由生工生物工程(上海)股份有限公司完成。
1.2 生物信息学分析
利用ProtParam(http://web.expasy.org/protparam)预测蛋白理化性质;利用WoLF PSORT(http://www.genscript.com/psort/wolf_psort.html)预测基因的亚细胞定位;利用GSDS 2.0 软件分析基因结构信息;利 用prabi(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_hnn.html) 和SWISSMODEL(https://swissmodel.expasy.org/interactive)预测蛋白的二级结构和三级结构。通过NCBI 查询StSp8 同源蛋白, 并用SMART 软件(http://www.embl-hei delberg.de)分析保守结构域;利用ClustalX 2.1 软件将StSp8 同源蛋白进行序列比对,利用MEGA7.0 软件的最大似然法(maximum likelihood estimation, MLE)构建系统进化树。
1.3 玉米大斑病菌RNA 提取及cDNA 合成
取在PDA 培养基中25 ℃黑暗培养10 ~15 d,获得生长状态良好的玉米大斑病菌菌株01-23,刮取气生菌丝后置于液氮中研磨,按照吕润玲[23]的实验步骤进行总RNA 提取和反转录;检测RNA 的分光光度值。将合格样品于-80 ℃保存备用。反转录产物经分离纯化后置于-20 ℃保存备用。
1.4 玉米大斑病菌丝氨酸蛋白酶基因StSp8 的克隆
将酿酒酵母StSp8基因编码的氨基酸序列进行本地BLAST,从而获取玉米大斑病菌StSp8基因氨基酸序列及蛋白ID 号,根据基因编号在JGI(http://genome,jgi.doe.gov)中查找到相应序列,采用引物设计软件Primer 5.0,设计基因扩增引物序列(StSp8-F:5'-ATGAG GTACACGCCTCATC-3'、StSp8-R:5'-TTAGTGGCTAGCGAGGCG-3')。送交生工生物工程(上海)股份有限公司合成引物。以反转录后的cDNA 为模板进行基因cDNA 序列的PCR 扩增,用琼脂糖凝胶电泳检测PCR 产物。将包含目的片段的琼脂糖凝胶进行回收,连接克隆载体pMD19 并转化至大肠杆菌DH5α 感受态细胞,挑取单菌落进行PCR 鉴定,并将阳性克隆送交生工生物工程(上海)股份有限公司测序。
1.5 玉米大斑病菌丝氨酸蛋白酶基因StSp8 原核表达载体的构建
将测序结果比对正确的菌液提取质粒,以含有目的基因的质粒为模板,酶切后连接至终载pET28a,转化至大肠杆菌DH5α 感受态细胞,构建重组质粒。挑取单菌落,进行菌液 PCR 验证和酶切验证。并将验证结果正确的重组质粒转化至大肠杆菌BL21(DE3)表达菌株,进行菌液PCR 验证。
1.6 玉米大斑病菌丝氨酸蛋白酶基因StSp8 的原核表达
挑取已鉴定的阳性克隆,置于5 mL 含有100 μg/mL 卡纳霉素抗性的LB 液体培养基中,在37℃、转速220 r/min 的条件下震荡培养,在600 nm 吸光度(A600)测定分光光度值,达到0.6 时,用1 mol/L 的IPTG 诱导6 h,收集菌体于4 ℃,12 000 r/min 离心10 min,弃上清,向沉淀中加入24 μL 的H2O 和6 μL 的上样buffer,100 ℃煮沸10 min,4 ℃ 12 000 r/min 离心10 min。取15 μL 蛋白样品上清液上样,10% SDS-PAGE 电泳检测。
1.7 玉米大斑病菌不同发育时期和侵染时期材料的收集
收集玉米大斑病菌5 个典型的发育时期的材料(菌丝、分生孢子、芽管、附着胞、侵入钉),选取在PDA 上25 ℃黑暗培养7 d 左右的野生型菌株,用去尖蓝枪头倾斜刮取菌丝体。选取PDA 上25 ℃黑暗培养15 d 左右的病菌,用棉签刮去其气生菌丝,将剩余基生菌丝继续培养3 d,加入8 mL 左右无菌水,收集分生孢子悬浮液,12 000 r/min 离心,获得分生孢子。在覆盖有玻璃纸的水琼脂培养基上加入分生孢子悬浮液,黑暗培养4 h 后收集芽管,10 h后收集附着胞,16 h 后收集侵入钉。将收集的分生孢子悬浮液均匀喷洒在3 叶期的玉米‘B73’叶片上,收集病菌侵染0、24 和72 h 的玉米叶片。以上试验样品需要设置3 次重复。
1.8 StSp8 基因的表达模式分析
利用 Primer Premier 3.0 软件设计StSp8基因的qRT-PCR 引物, 并送至生工生物工程( 上海) 股份有限公司合成。(RT-StSp8:5'-C T C G A C A G A G A C G AT C C A C A-3';RTStSp8-R:5'-TCAAAATGACCCGAGTAGCC-3')以Tubulin 作为内参基因,以5 个发育和3 个侵染时期的cDNA 为模板对该基因进行扩增。qRT-PCR反应体系:模板1 μL,10 μmol/L 上下游引物各0.2 μL,2×Perfect-Start Green qPCR SuperMix 5 μL,ddH2O 3.6 μL。qPCR 程序:94 ℃ 30 s;94 ℃ 5 s,60 ℃ 30 s,循环35 次。利用2-ΔΔCt方法计算基因相对表达量,利用Graphpad Prism 6.0.1 软件进行统计分析。
2 结果与分析
2.1 玉米大斑病菌StSp8 蛋白的理化性质分析及亚细胞定位
利用ExPASy Proteomics Server 的在线软件预测丝氨酸蛋白酶StSp8 的理化性质,通过分析发现,StSp8基因编码的蛋白包含533 个氨基酸,分子式为C2503H3928N696O808S15,总原子数为7 950,相对分子质量为57 179.80 kD 理论等电点(pI)5.94,表明该蛋白质为酸性蛋白质。StSp8 蛋白的不稳定系数为35.36,表明该蛋白为稳定蛋白。另外,StSp8 蛋白的平均亲水系数为-0.493,表明该蛋白是亲水性蛋白。利用WOLF PSORT 在线预测其亚细胞定位,推断其可能定位于细胞质中。
2.2 玉米大斑病菌StSp8 蛋白的结构及空间结构预测
利用GSDS 2.0 软件分析StSp8基因结构信息,发现该基因有2 个外显子和1 个内含子(图1A)。利用SMART 在线软件对StSp8 保守结构域进行分析,结果表明,该蛋白第1 ~15 位氨基酸形成信号肽结构域、第43 ~135 位氨基酸形成Inhibitor-I9结构域,第174 ~458 位氨基酸形成Peptidase-S8(图1B)。采用SOPMA 进行StSp8 的编码蛋白二级结构分析和结构域预测。结果表明,该蛋白具有3 种二级结构,即α 螺旋(αhelix, Hh)、无规则卷曲(random coil, Cc)和延伸链(extended strand,Ee)(图1C)。进一步对StSp8 编码蛋白进行三维结构建模,发现丝氨酸蛋白酶StSp8 的编码蛋白二级结构中α-螺旋(alpha helix)占36.02%、延伸链(extended strand)占13.13%、无规则卷曲(random coil)占50.84%。折叠后呈倒L 型,包含有1 个由7 股α-螺旋和β 折叠组成的平行结构,具有Asp/Ser/His 三元催化位点(图1D)。

图1 StSp8 基因结构、保守结构域及高级结构分析Fig.1 Conservative domain and advanced structure analysis of StSp8
2.3 StSp8 蛋白的系统进化分析
为进一步研究玉米大斑病菌与其他真菌间的进化关系,对该基因蛋白序列进行同源序列比对,基于巴恩斯链格孢(Alternaria burnsii)、酿酒酵母(Saccharomyces cerevisiae)、玉米小斑病菌(Bipolaris maydis)、小麦链格孢菌(Alternaria alternata)等真菌物种的氨基酸序列,利用MEGA 7.0 最大似然法进行系统发育树分析。分析结果表明,玉米大斑病菌StSp8 在第8 支,与番茄匍柄霉(Stemphylium lycopersici)的进化关系最近,与烟草弯孢菌叶斑病(Curvularia clavata)、玉米新月弯孢菌(Curvularia lunata)和酿酒酵母(S.cerevisiae)的关系较远(图2)。

图2 StSp8 系统进化分析Fig.2 Phylogenetic analysis of StSp8
2.4 StSp8 基因原核表达载体的构建及诱导表达
利用NanoDrop 分析仪进行RNA 纯度测定,RNA 的A260/A280在1.9 ~2.0 之间,表明提取的RNA 质量较好。以RNA 反转录的cDNA 为模板,StSp8-F 和StSp8-R 为引物,扩增出1 条1 600 bp左右的单一特异性条带(图3A)。

图3 StSp8 基因原核表达载体的构建Fig.3 Construction of the vector for prokaryotic expression of StSp8 gene
经回收纯化产物后经测序通过DNAMAN 软件比对与预期结果一致,表明已获得丝氨酸蛋白酶StSp8基因序列。
以pET28a 载体为骨架构建原核表达载体,将StSp8CDS 序列连接终载后菌液检测能扩增出1 条1 600 bp 左右的单一特异性条带(图3B),提取质粒后酶切验证能检测到1 条1 600 左右的目的条带以及载体条带(图3C)。表明目的基因成功插入原核表达载体。重组质粒转化大肠杆菌感受态BL21(DE3)后菌液PCR 能检测到1 条1 600 bp 左右的目的条带(图3D)。表明目的基因已转入BL21(DE3)表达菌株。SDS-PAGE 电泳结果可知,与未诱导重组菌相比,IPTG 诱导的重组菌在63 ~75 kD 之间出现目的条带(图4)。结果初步表明含有StSp8基因的重组质粒在大肠杆菌中已成功表达。

图4 StSp8 蛋白的SDS-PAGE 电泳分析Fig.4 Analysis of StSp8 fusion protein by SDS-PAGE
2.5 StSp8 基因在玉米大斑病菌生长发育及侵染过程中的表达模式分析
基因表达模式的分析可对基因功能研究起重要作用,为进一步探索StSp8的功能,利用qRT-PCR数据分析了该基因在菌丝、分生孢子、芽管、附着胞和侵入钉时期和该基因在侵染玉米0、24、72 h 的表达模式。结果发现,StSp8在上述5 个发育时期均有不同水平的表达。与菌丝时期相比,分生孢子、芽管、附着胞、侵入钉时期的StSp8基因表达量分别为菌丝时期的1.31、2.57、1.44、0.68 倍,StSp8在芽管时期表达量最高,在侵入钉时期最低(图5A),说明StSp8基因参与病菌生长发育的调控过程。在侵染玉米的过程中,StSp8的表达量在侵染24 h 时最高,为0 h 的3.45 倍;在72 h 时降低,为0 h 的2.78 倍(图5B),表明该基因在侵染中期发挥作用。
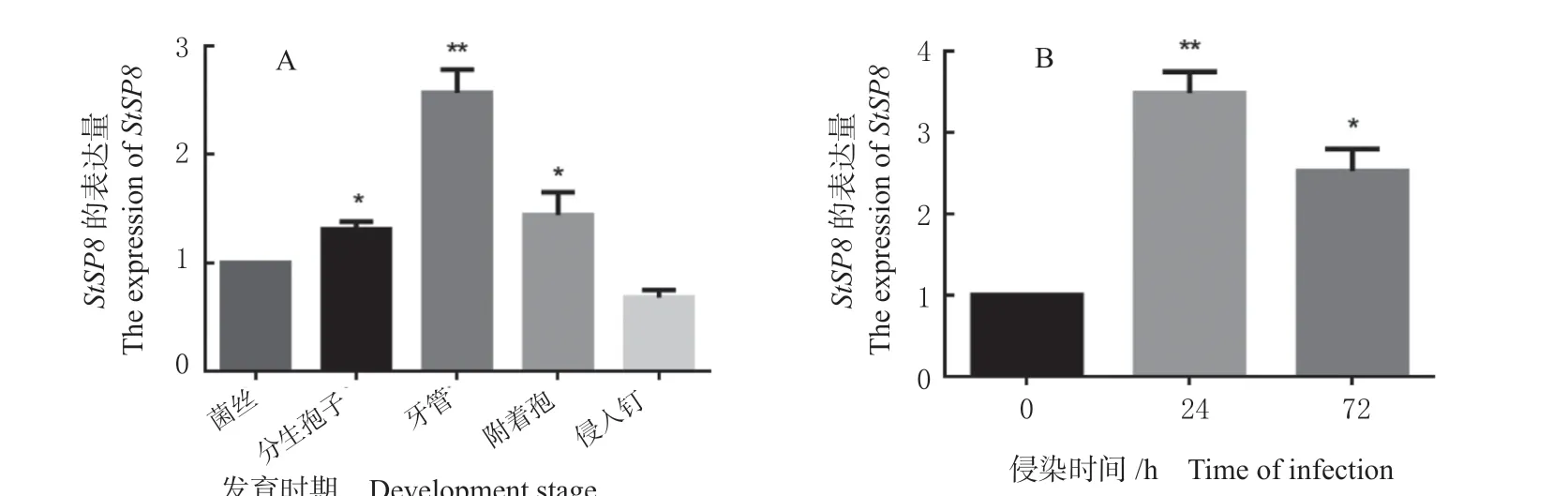
图5 玉米大斑病菌StSp8 的表达模式分析Fig.5 Analysis of the expression pattern of StSp8 in S.turcica
3 结论与讨论
研究表明,丝氨酸蛋白酶作为一种潜在的致病因子在玉米大斑病菌中的作用机理目前尚未明确。本研究克隆了StSp8基因,cDNA 序列全长为1 602 bp,编码533 个氨基酸,StSp8全基因含有2 个外显子和1 个内含子,推测该蛋白定位在细胞质中。在真菌植物病原菌中通过分泌组分析筛选出了与StSp8高度同源的基因,与寄主大范围坏死相关,是一种候选效应因子[14]。在分布于水稻细胞质中的丝氨酸蛋白酶OsPOP5 的研究中,将其导入大肠杆菌表达的pET32a 载体中,发现OsPOP5的表达可以增强大肠杆菌对脱水、高温和高盐度的耐受性,表明OsPOP5可能在应激条件下发挥保护作用[24]。本试验在克隆丝氨酸蛋白酶StSp8基因的基础上,对其结构进行分析,其编码蛋白包含信号肽结构域、Inhibitor-I9 结构域和Peptidase-S8 结构域,在原核表达体系中进行表达。初步验证含有丝氨酸蛋白酶基因StSp8的重组质粒在大肠杆菌中已成功表达约65 kD 的重组蛋白。纯化后的蛋白将用于测定丝氨酸蛋白酶StSP8 的酶活及病菌侵染玉米叶片后StSp8蛋白表达水平的检测。
在脉纹孢菌(Neurospora crassa)中,丝氨酸蛋白酶Pox1 对于细胞壁的形成和完整性是必需的,敲除pox1基因会导致细胞形态异常并增加对细胞壁损伤剂的敏感性[25]。SPMo1的缺失会减少稻瘟病菌的分生孢子、气生菌丝的形成和自噬体的积累[13]。通过qRT-PCR 数据发现,StSp8基因在病菌生长发育的各个时期都表达,但在芽管时期表达量最高,在侵染玉米的过程中表达量在侵染24 h 时最高,在72 h 时降低,由此推测,StSp8基因可能参与玉米大斑病菌的生长发育和致病过程,但需要进一步通过创制该基因的突变体进行验证。本研究为后期进一步研究丝氨酸蛋白酶StSp8 的生物化学和分子生物学功能奠定基础。
