毛果杨BBX 基因家族鉴定与生物信息学分析
2023-11-11齐小坤孟祥熹赵志明袁梦婷杨志慧武江昊王进茂
齐小坤,孟祥熹,赵志明,袁梦婷,杨志慧,武江昊,王进茂
(河北农业大学 林学院/河北省林木种质资源与森林保护重点实验室,河北 保定 071000)
BBXs(B-box zinc finger transcription factors)属于锌指结构转录因子家族,其N 端包含1 ~2 个B-box 结构域[1]。在拟南芥(Arabidopsis thaliana)中,BBX基因家族根据B-box 结构域以及C 端是否含有CCT 结构域被分为5 个亚族[2]。自1995 年首次在拟南芥中被发现以来,BBX基因的生物学功能被广泛研究[3]。大量研究表明,BBX基因在调控植物生长发育以及应对生物和非生物胁迫反应等多种生理生化过程中发挥着重要作用。例如,拟南芥中,AtBBX28和AtBBX29基因可以相互作用并共同控制开花时间[4]。此外,AtBBX30和AtBBX31作为光形态发生的抑制因子,在调节植物光形态发育中发挥着至关重要的作用[5]。在胁迫方面,拟南芥AtBBX18基因与植株的耐热性相关[6]。过表达苹果MdBBX10基因可以提高拟南芥的耐旱性和耐盐性[7]。
杨树是世界上重要的经济型树种,因其生长快,适应能力强,分布广泛,是林木基因组学研究的模式物种[8]。然而,杨树在种植过程中所经常遭受的干旱、土壤盐渍化、重金属离子和极端温度等非生物胁迫,成为制约其生长发育的重要因素[9]。因此,挖掘杨树响应非生物胁迫的目标基因,以及探究和了解杨树应答逆境胁迫的响应机制,对于杨树抗性育种和遗传改良具有重要意义。BBX基因的抗逆作用在多个物种中被证实,因此对BBX基因家族进行全基因组鉴定,了解PtBBX基因家族成员的的物理和化学特征、系统发育关系、基因结构、共线性关系和表达模式,对深入解析毛果杨BBX基因的功能和杨树的抗性改良奠定了基础。
1 材料与方法
1.1 毛果杨BBX 基因家族成员的鉴定及理化性质分析
毛果杨参考基因组下载于NCBI 数据库(https://www.ncbi.nlm.nih.gov/)。首先,通过HMMER 3.1 软件利用从Pfam 数据库(http://pfam.xfam.org/)中下载的BBX 蛋白相对应的隐马尔科夫模型(PFPF00643),从毛果杨基因组中搜索获得候选BBX 蛋白序列(P< 0.001)。同时,利用从拟南芥数据库(https://www.arabidopsis.org/)[10]下载的已确定的拟南芥BBX 蛋白序列作为种子序列BLASTP[11]检索毛果杨基因组数据中的BBX 蛋白序列(E-value < 1e-3)。合并两种方法所获得的候选序列,手动去除冗余序列后,将所有的BBX 蛋白序列提交到InterProScan(http://www.ebi.ac.uk/interpro/)[12]和CDD(https://www.ncbi.nlm.nih.gov/cdd/)[13]数据库中进行验证。最后,利用ExPASy(http://cn.expasy.org/tools)和WoLF PSORT(http: //www.genscript.com/wolf-psort.html)在线软件分别计算毛果杨BBX 蛋白序列的长度、等电点和分子量,以及预测BBX 蛋白的亚细胞位置。
1.2 毛果杨BBX 基因家族的系统发育分析和分类
使用MEGA 6.0 软件中的Clustal W 工具对鉴定出的毛果杨BBX蛋白序列和下载的拟南芥BBX蛋白序列进行序列比对,参数默认[14]。然后基于多序列比对的结果,采用邻近法(Neighbor-Joining)构建系统发育树。最后根据系统发育树的拓扑结构对BBX家族基因进行分类。
1.3 毛果杨BBX 基因家族成员的基因结构和保守基序分析
根据毛果杨基因组数据的注释信息,使用TBtools 软件绘制PtBBXs基因家族成员的结构图。使用MEME 在线软件(http://meme-suite.org/tools/meme)分析PtBBXs 蛋白序列的Motif,参数设计如下:Motif 的最大数量为10,最大Motif 宽度为100,最小Motif 宽度为6[15]。
1.4 毛果杨BBX 家族基因启动子区域顺式作用元件分析
从毛果杨基因组中提取BBX家族基因起始密码子上游1 500 bp 序列作为PtBBXs基因的启动子序列, 利用PlantCARE 在线网站(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)[16]对顺式作用元件进行分析。
1.5 毛果杨BBX 家族基因的染色体定位及加倍事件分析
为了更好的了解PtBBXs基因家族成员间的加倍事件,使用MCScanX(Multiple Collinearity Scan toolkit)来鉴定基因组内的共线性[17]。与此同时,使用TBtools 软件中的Dual Systeny Plotter 程序分析并展示毛果杨与拟南芥间直系同源BBX基因的共线性关系[18]。
1.6 毛果杨BBX 家族基因的表达模式分析
从高通量基因表达数据库(Gene Expression Omnibus,GEO; https://www.ncbi.nlm.nih.gov/geo/)中下载杨树不同组织中基因的表达数据集(Accession Number: GSE13990)[19],分析毛果杨BBX家族基因在不同组织中的表达情况。同时,利用课题组前期通过高通量测序获得的杨树在茉莉酸(JA)、水杨酸(SA)、盐碱、干旱、高温和低温胁迫下的转录组数据,分析毛果杨BBX家族基因在非生物胁迫下的表达模式。利用TBtools 软件对PtBBXs基因的表达数据取以2 为底的对数(标准化处理)后,绘制成热图[18]。
2 结果与分析
2.1 毛果杨BBX 基因家族成员的鉴定与分析
通过生物信息学分析,最终在毛果杨基因组中筛选获得28 个BBX基因家族成员,并按照其在染色体上的位置顺序依次命名为PtBBX1-PtBBX28。基因的理化性质分析结果表明,除PtBBX27和PtBBX28基因未锚定到参试基因组数据的染色体外,其余PtBBXs基因不均匀分布于15 条染色体上。PtBBXs基因的编码序列长度差异较大,介于555 bp(PtBBX10)~ 1 545 bp(PtBBX1)间变化,编码的氨基酸残基数量介于184 ~514 个,CDS 序列和蛋白质序列平均长度分别为962 bp 和320 aa,蛋白质分子量大小介于20.5 ~56.5 kD 之间,平均分子量为35.3 kD,理论等电点介于4.36(PtBBX21)~7.05(PtBBX10)之间,平均等电点为5.69,其中7 个(96.43%)蛋白质的pI < 7,表明PtBBXs 蛋白质多数呈酸性(表1)。亚细胞定位预测结果显示,所有的PtBBXs成员均位于细胞核中。
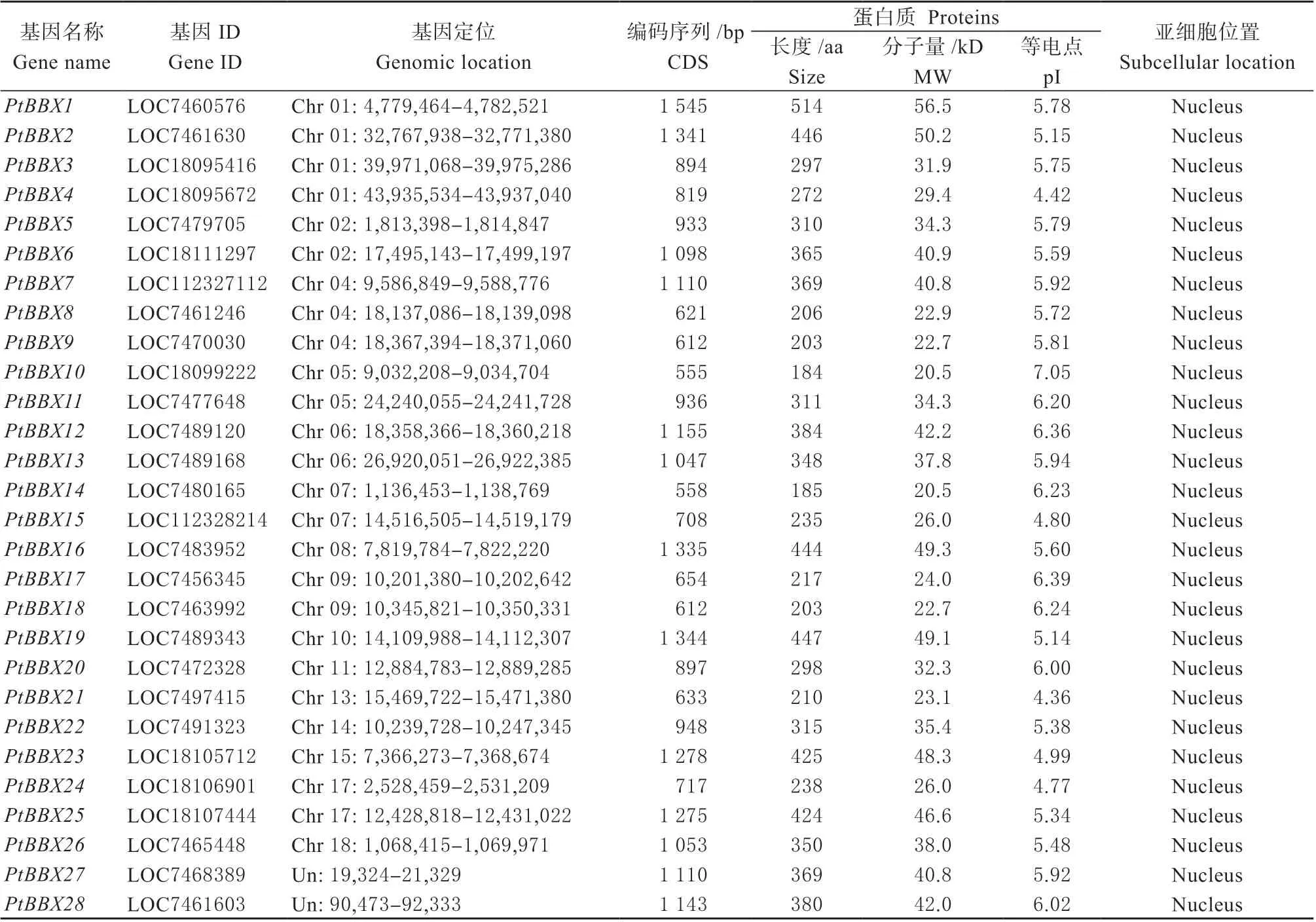
表1 毛果杨BBX 基因家族成员的序列特征Table 1 Sequence characteristics of the BBX gene family members in Populus trichocarpa
2.2 毛果杨BBX 基因家族的系统发育分析和分类
为了解BBX家族基因成员在毛果杨与拟南芥之间的进化关系,使用MEGA 6.0 软件,构建了毛果杨和拟南芥BBX 蛋白序列的系统发育树(图1)。
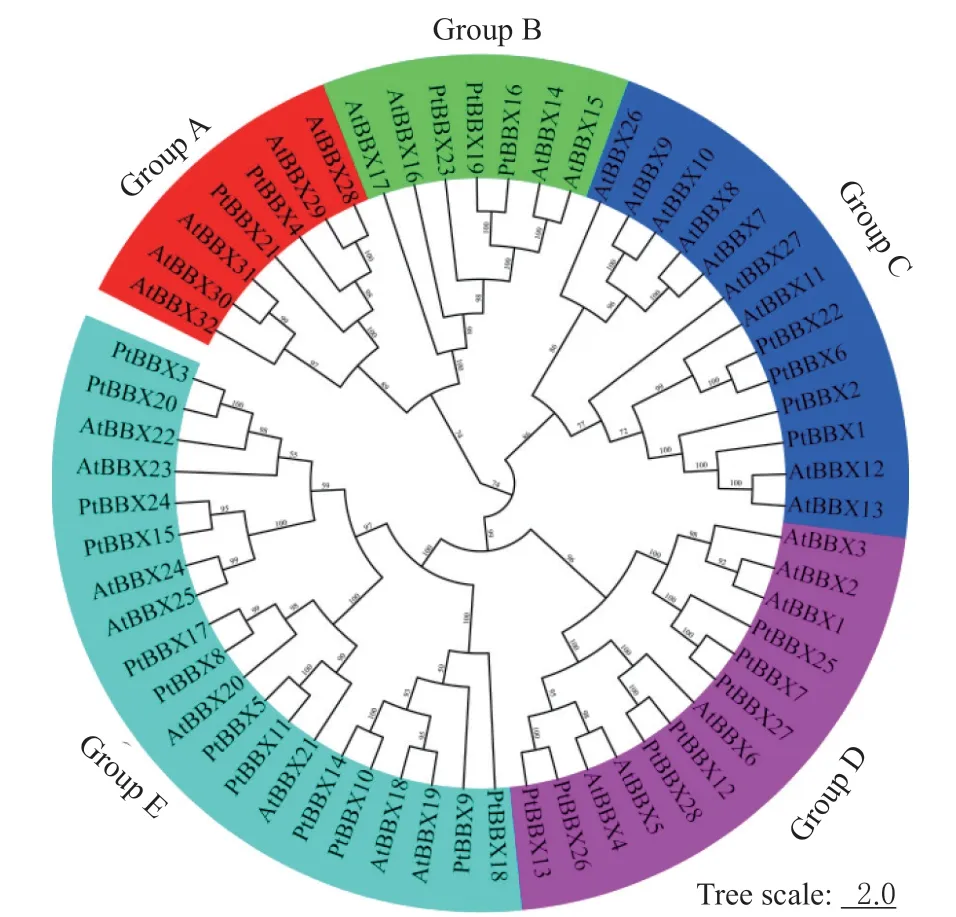
图1 毛果杨和拟南芥BBX 基因的系统发育分析Fig.1 Phylogenetic analysis of BBX genes in P.trichocarpa and Arabidopsis thaliana
基于拓扑结构,将所有BBX 蛋白序列分为5 组,每个分组中都包含了毛果杨和拟南芥的BBX成员。Group E 中成员最多,包含12 个毛果杨和8 个拟南芥BBX基因。Group A 与Group B 中的家族成员都最少,为7 个,而Group C 和D 都包含13 个BBX基因家族成员。
2.3 毛果杨BBX 基因家族成员的基因结构和保守基序分析
为了明确PtBBX基因家族结构的演变,对PtBBX家族成员的外显子和内含子进行了分析。由图2 可知,PtBBXs家族基因成员都不包含5’-UTR和3’-UTR,它们的内含子数量从1 到5 个不等,其中Group A、B 和D 中的基因所包含的内含子数量最少(均只有1 个)。总体看来,相同分组中PtBBX成员的外显子—内含子结构相似,且内含子数量差异较小,而不同分组之间外显子分布特点和内含子数量的差异较大。保守基序(Motif)也具有类似的规律,即同一分组中的PtBBX 蛋白具有相似类型和数量Motifs(图2)。
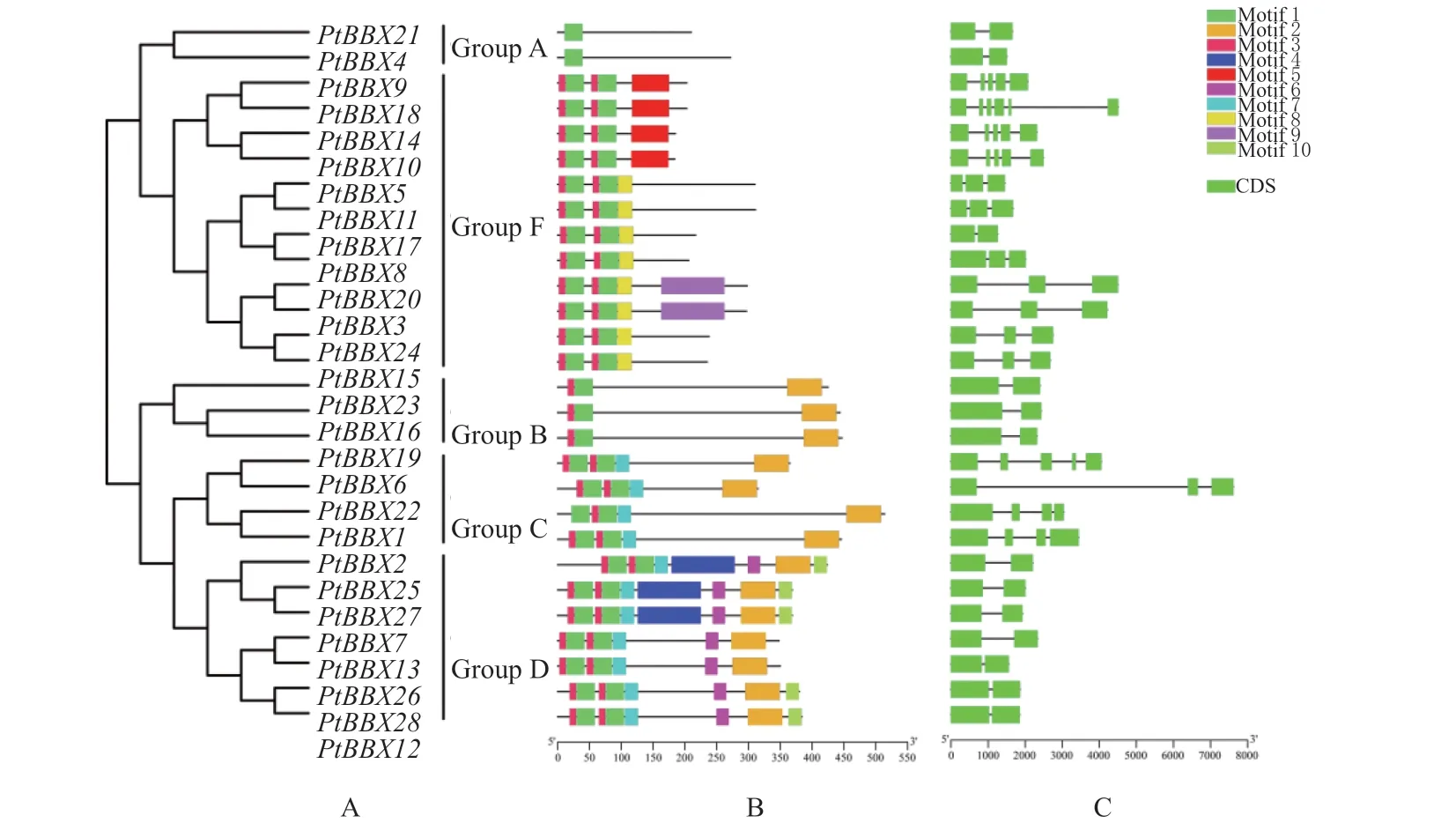
图2 PtBBX 基因家族成员间的进化关系(A)保守基序(B)和基因结构(C)分析Fig.2 Evolutionary relationships (A), conserved motifs (B) and gene structures (C) between the PtBBXs members
2.4 毛果杨BBX 家族基因启动子序列分析
对毛果杨28 个BBX基因家族成员的1 500 bp启动子序列进行分析,结果表明除了光响应元件外,每个PtBBX家族基因的启动子序列中都包含大量与非生物胁迫相关的顺式作用元件,如脱落酸(Abscisic acid,ABA)、乙烯(Ethylene)、水杨酸(Salicylic acid,SA)和茉莉酸(Jasmonic acid,JA)等信号响应元件以及干旱、低温响应胁迫调控元件。此外,调控胚乳生长,细胞周期和昼夜节律等顺式作用元件也存在毛果杨BBX家族基因的启动子序列中。综上说明,PtBBX家族基因在逆境胁迫响应和生长发育过程中可能发挥着重要作用(图3)。
2.5 毛果杨BBX 家族基因的染色体定位及加倍事件分析
根据毛果杨基因组的注释文件,将PtBBXs基因在染色体上的分布可视化。由图4 可知,除PtBBX27和PtBBX28基因没有定位到染色体上,其余25 个PtBBXs基因不均匀地分布在毛果杨的15 条染色体上。其中1 号染色体上最多,有4 个PtBBXs基因,而8、10、11、13、14、15 和18 号染色体都分别仅含有1 个PtBBX基因。在PtBBXs家族基因中,有21 个PtBBXs基因之间具有共线性,存在20对由片段复制形成的基因对,说明在毛果杨基因组的进化过程中,全基因组加倍事件是PtBBXs家族基因数量扩增的主要方式(图5)。此外,PtBBXs基因家族成员在毛果杨与拟南芥基因组之间也具有较多的共线性关系(图6)。
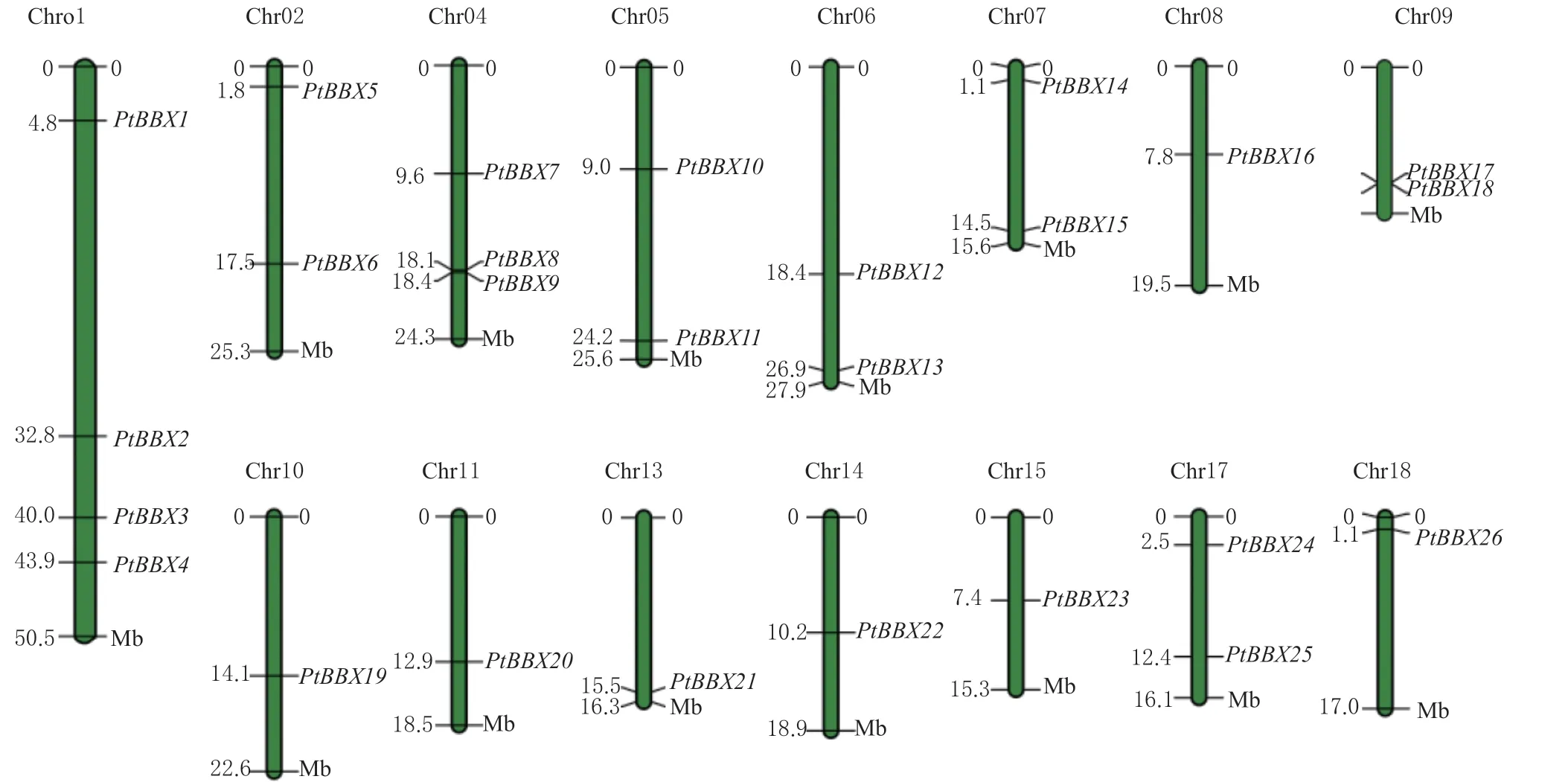
图4 毛果杨BBX 基因家族各成员的染色体定位图Fig.4 Distribution of BBX genes in chromosomes of the P.trichocarpa

图5 毛果杨BBX 基因家族成员的共线性分析Fig.5 Co-linearity analysis of the BBX family genes in P.trichocarpa

图6 毛果杨与拟南芥之间BBX 基因家族成员的同源性分析Fig.6 Homology analysis of BBX genes between P.trichocarpa and A.thaliana
2.6 毛果杨BBX 家族基因的组织表达模式分析
整体上,毛果杨BBX基因家族成员在幼嫩叶片和成熟叶片中都具有较高的表达水平(图7)。
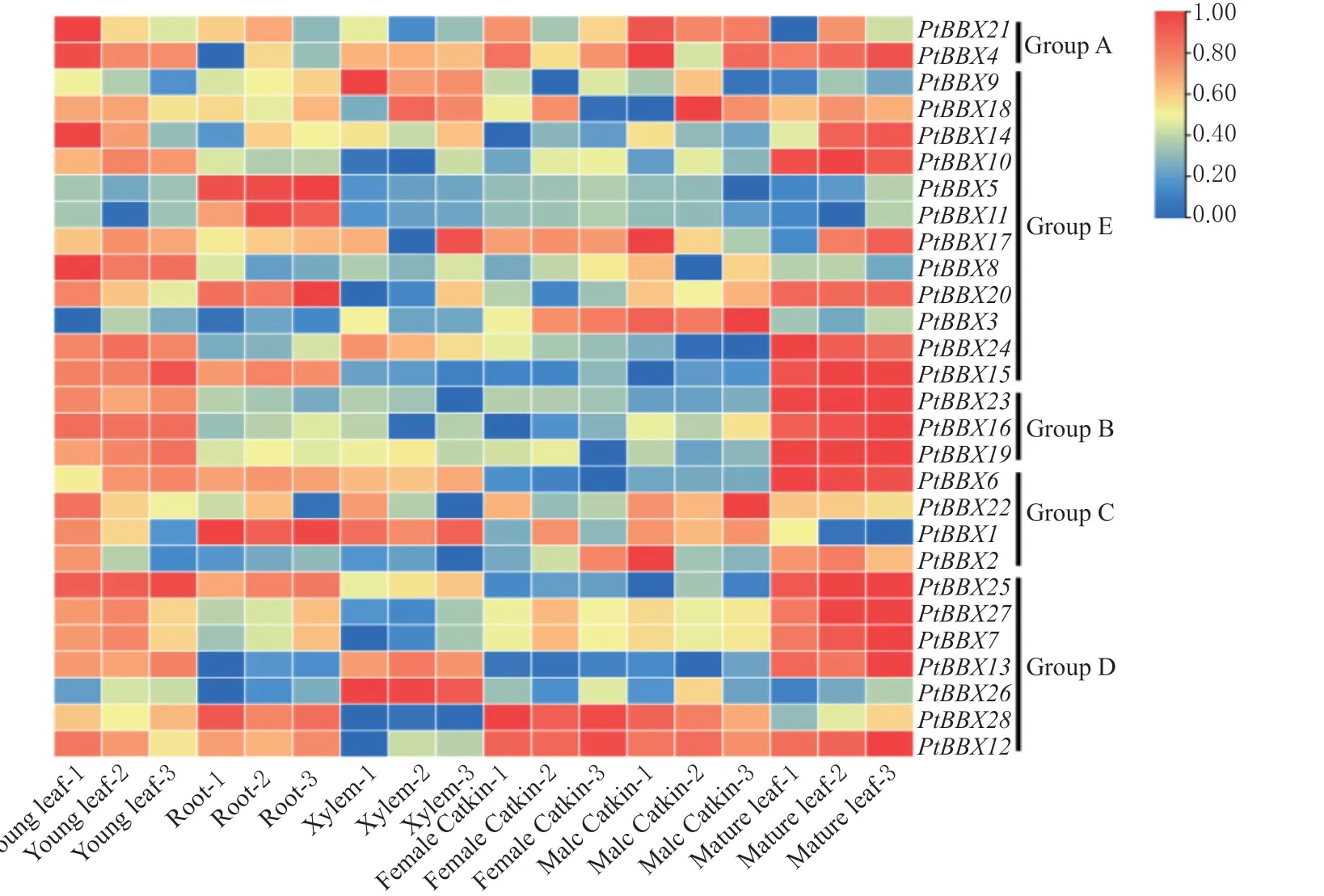
图7 毛果杨BBX 基因家族成员在不同组织中的表达模式分析Fig.7 The expression patterns of BBX genes in different tissues of P.trichocarpa
此外,PtBBXs基因表达具有组织特异性。例如,PtBBX5和PtBBX11基因在根中具有较高的表达水平,推测它们与根的生长发育有关;而PtBBX12和PtBBX28基因在雄性花序和雌性花序中都高表达,说明它们调控花絮的生长发育过程中可能具有重要作用。然而,同一分组中,不同PtBBXs基因具有不同的表达模式,说明在进化过程中,它们的功能可能出现不同程度的分化。
2.7 毛果杨BBX 家族基因在非生物胁迫下的表达分析
在非生物胁迫下,不同组别(Group)的毛果杨BBX 家族基因的响应模式存在差异。例如,在茉莉酸(JA)和水杨酸(SA)胁迫12 和24 h 后,Group A (PtBBX21、PtBBX4)和Group D (PtBBX26、PtBBX12)具有较高的表达水平,而其他分组中的大部分PtBBXs基因都只响应短时间内的激素胁迫。同样,Group A (PtBBX21、PtBBX4),Group D (PtBBX13、PtBBX25),Group E (PtBBX15、PtBBX24) 响应低温 胁 迫;Group B(PtBBX16、PtBBX19) 和Group C(PtBBX1、PtBBX2)基因同时响应盐和干旱胁迫;除Group C,其他分组中的PtBBXs基因都在高温胁迫下具有较高的表达水平(图8)。综上所述,毛果杨BBX家族响应了多种非生物胁迫,并可能参与了植物的抗逆过程。
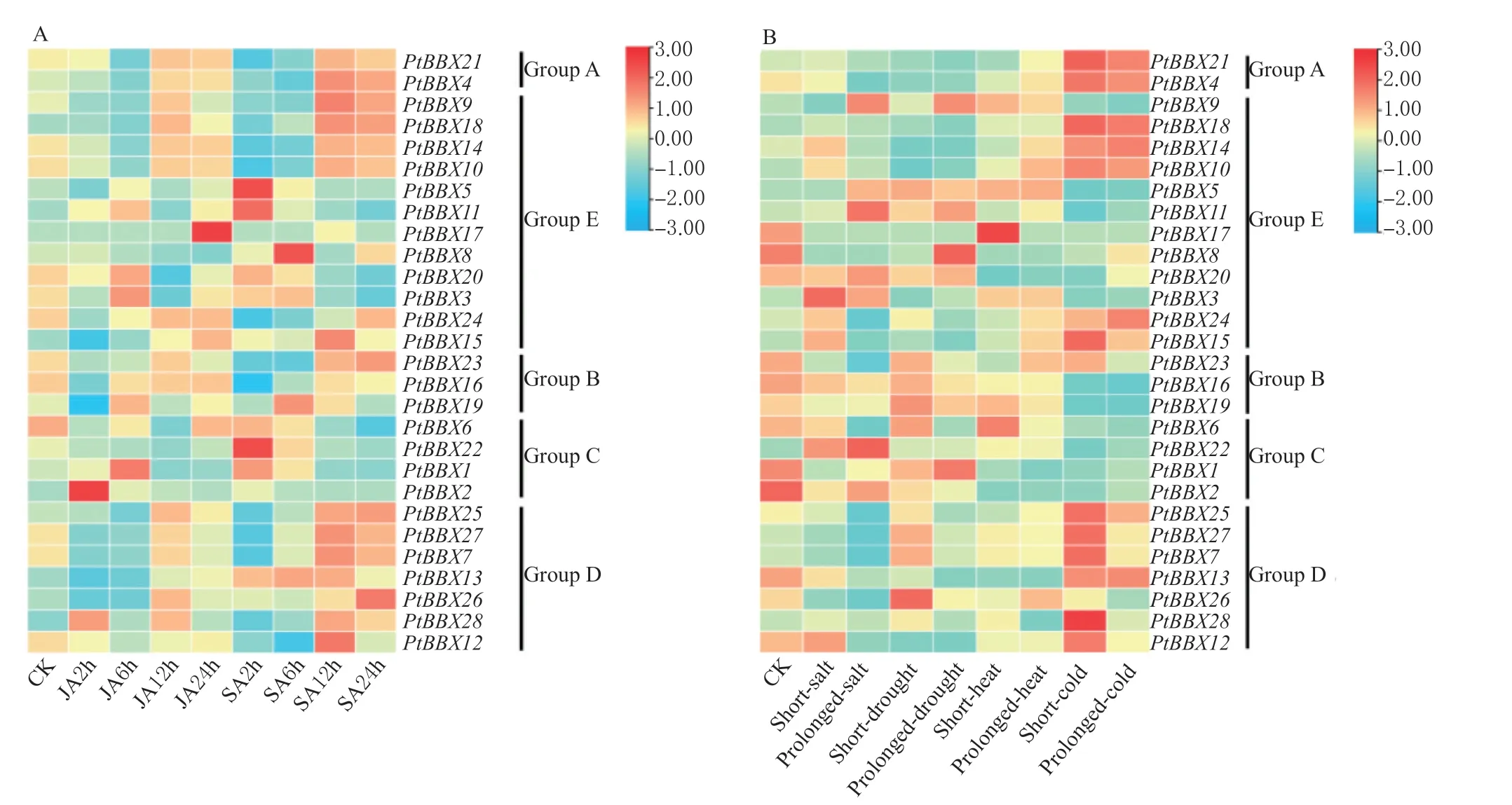
图8 毛果杨BBX 家族基因在非生物胁迫下的表达谱Fig.8 Expression profiles of BBX genes in P.trichocarpa under abiotic stress
3 讨论与结论
BBX基因在调控植物生长发育和响应非生物胁迫方面发挥着重要作用。目前,BBX基因家族成员已在多个物种中被鉴定,例如拟南芥(32 个)[2]、小麦(87 个)[20]和香蕉(38 个)[21],其数量在种间具有差异性,这可能与物种基因组的大小以及进化过程中的古多倍化事件有关[22]。
本研究在毛果杨基因组中鉴定出28 个PtBBX基因,它们在编码序列长度,分子量大小以及等电点等方面存在明显差异。例如,PtBBX家族基因编码的氨基酸数量介于184 ~514 个之间;蛋白质分子量大小介于20.5 ~56.5 kD 之间,说明毛果杨BBX基因家族成员之间具有多样性,这也与香蕉[21]和马铃薯[23]等物种中BBX基因家族成员的理化特性相似,表明BBX家族成员的基因结构特点在不同物种间较为保守。
在拟南芥中,BBX基因家族根据B-box 结构域以及C 端是否含有CCT 结构域被分为5 个亚族[2]。同样,毛果杨BBX家族基因成员也被分为5 组,这也与大多数植物中所描述的BBX基因家族成员的分类一致[2,24-25],再一次说明BBX家族成员的基因结构在进化过程中具有较强的保守性。相同分组中PtBBXs基因具有相似的外显子-内含子结构以及相同类型的Motif 类型。不同分组之间的BBX家族基因成员都包含1 ~2 个Motif 1,其对应于B-box 结构域,而Motif 2 则对应于CCT 结构域。有些Motif特异性存在某一分组中,如Motif 6 和Motif 9 等,说明不同亚族间的PtBBX基因在功能和进化上具有一定的差异。
基因加倍事件对于基因进化至关重要的,有利于家族基因数量的扩增[26]。在毛果杨基因组中,从定位到染色体上的26 个BBX基因中发现有21 个基因之间存在共线性关系,形成了20 对由片段复制形成的基因对,说明片段加倍事件是毛果杨BBX基因家族形成的主要原因,这与大豆[27]、小麦[19]和玉米[28]中的研究结果一致,表明不同物种中BBX基因家族具有相同的形成机制。毛果杨与拟南芥基因组之间的共线性分析表明,毛果杨PtBBX基因家族成员与拟南芥之间存在34 对直系同源基因对,推测它们可能具有相同的生物学功能。
BBX基因的功能多样性已在不同物种中得到研究,包括在植物光形态发生、生长、发育、代谢以及对生物或非生物胁迫的反应中的作用[29]。例如拟南芥AtBBX21、AtBBX22和AtBBX25基因都参与了光形态建成[30]。苹果中MdBBX37基因通过光信号传导负调控花青素的积累[31]。SlBBX17基因是正调控西红柿的耐热性[32]。首先,毛果杨BBX家族基因的表达具有组织特异性。例如,PtBBX5和PtBBX11基因仅根部的具有较高的表达水平,它们可能在根的生长发育过程中具有重要的调控作用;而PtBBX28和PtBBX12在除韧皮部的其他组织和器官中都高水平表达,说明不同PtBBXs基因的功能在进化过程中出现了不同程度的分化。此外,毛果杨BBX基因家族成员的功能也具有多样性。在JA、SA、盐碱、干旱、高温和低温胁迫下,毛果杨BBX基因家族成员都具有不同程度的响应模式。综上,毛果杨BBX家族基因在植株生长和响应非生物胁迫中广泛参与,充分说明了它们在调控植株营养生长以及抵御多种非生物胁迫过程中的重要性。此结果为进一步解析毛果杨BBX 家族基因的功能和杨树的抗性改良奠定了基础。
