整合DNA修复能力与核苷酸剪切修复标志物评估头颈鳞癌发病风险的初步研究
2023-11-11张晓彤
张 令,敬 怡,刘 琪,张晓彤,韩 鹏
(1.西安交通大学第一附属医院耳鼻咽喉头颈外科,陕西 西安 710061;2.西安交通大学第二附属医院耳鼻咽喉头颈外科,陕西 西安 710004;3.山阳县人民医院耳鼻喉科,陕西 山阳 726400)
在世界上最常见的恶性肿瘤中,头颈部癌症(Head and neck cancer,HNC)位于第6位,约 90% 的HNC在病理上均属于鳞状细胞癌(Squamous cell carcinoma,SCC),其主要的发生部位分布于口腔、口咽、下咽及喉部[1-4]。因此我们用头颈部鳞状细胞癌(Head and neck squamous cell carcinoma,HNSCC)将上述恶性肿瘤统一归类,简称为头颈鳞癌[5-6]。HNSCC的5年生存率相对较低,总体预后相对较差,致死率相对较高,给患者生命健康带来极大危害[7-8]。HNSCC根据发病因素不同主要分为两类:一类是由于长期吸烟及饮酒所致;另一类是因感染了人类乳头状病毒(Human papillomavirus,HPV)而引起[9-10]。世界卫生组织的研究表明,在西方发达国家,HNSCC中口咽癌主要病因为HPV感染;然而在我国约80%的口咽癌是由长期吸烟及饮酒所致,仅20%口咽癌是由HPV感染引起,并且多数 HPV阳性的口咽癌患者常伴有吸烟史[11-14]。既往研究表明,DNA修复能力(DNA repair capacity,DRC)降低、核苷酸剪切修复(Nucleotide excision repair,NER)基因mRNA表达水平降低分别与HNSCC的易感性增加有关,但单一水平的标志物对预测HNSCC发病风险的作用较为局限性,且该方法预测的准确度和精确度相对较低[15-18]。值得注意的是目前尚无将DRC和NER标志物相结合的来评估HNSCC的发病风险的研究。因此,本研究将基于82例HNSCC和81例健康对照,通过整合DRC水平和NER通路标志物来预测HNSCC的发病风险。
1 对象与方法
1.1 研究对象 本研究选取2015-2021年间就诊于西安交通大学第一附属医院的82例HNSCC患者和81例无癌对照者进行分析。为了避免种族间人种的差异,本研究仅选取中国汉族人群作为研究对象,在抽取研究对象外周血前询问其个人信息、病史及相关的流行病学资料,主要内容包括对年龄、性别、生活习惯(吸烟、饮酒等)及家族史。本研究检测项目通过西安交通大学第一附属医院伦理委员会审批通过,所有入选研究对象检测前均告知相关风险及签署知情同意书。病例组的选择标准为:新诊断为HNSCC,18岁以上,未患过其他肿瘤,被病理诊断为口腔、咽部(除外鼻咽部)及喉部的SCC,未接受过任何治疗。对照组的选择标准为:18岁以上,与病例组年龄和性别相匹配,未患过任何癌症的个体。为了避免研究对象的重复,我们仅选取每个患者的一个朋友或非血缘关系的亲属参与研究。排除标准:年龄未满18岁;不愿提供相应的血液标本;中途退出研究;接受过任何化疗或放疗的研究对象。
1.2 研究方法
1.2.1 Trizol法从血液中提取RNA:首先,从患者的血液标本中提取淋巴细胞,并将已处理的各组淋巴细胞弃培养液,用温度为4 ℃的PBS清洗细胞培养板,重复3次;每孔加入Trizol试剂1 ml,将细胞培养板置于冰上约15 min裂解后,反复吹打,裂解细胞,将裂解液置入1.5 ml EP 管中;将200 μl 的三氯甲烷加入每个小管,封闭好小管,剧烈震荡55~65 s,并在室温下放置10~15 min,充分裂解;在4 ℃、转速12000 r/min下,将裂解液离心14~16 min,离心后样品分层,RNA分布于上层水相内,吸取上层;取上清液至清洁的DEPC处理过的EP管,将异丙醇0.6 ml加入管中,上下轻柔颠倒约3~5次混匀,在-20 ℃冰箱内放置约2~3 h;4 ℃、12000 r/min,离心10~15 min,弃上清液,可见沉于管底的RNA;取1 ml 75% 乙醇加入沉淀中,沉淀物温和吹起即可;4 ℃、10000 r/min,离心10~15 min,尽量弃除上清液;将EP管倒置于滤纸上4~6 min,不要彻底干燥;加入10 μl DEPC水溶解RNA样品,备用;对OD值进行测定,得到RNA的浓度,按照试剂盒说明要求将RNA转成cDNA,并置于-80 ℃冰箱中。
1.2.2 NER基因的PCR实验[17]: PCR反应体系如下:每个扩增反应在5 μl含有5 ng互补DNA、0.25 μl引物和2.5 μl Master混合物的最终体系中进行。PCR反应在384孔光学平板中进行,终体积为5 μl反应混合物。热循环条件如下:95 ℃、5 min,然后在95 ℃变性15 s,40 ℃循环,60 ℃退火、延伸1 min。以18 s作为内参,Ct值为PCR实验中每个反应内的信号到达设定的域值时所经历的循环数。通过ΔCt计算8个NER基因相对于18 s的表达水平。ΔCt值是目标基因的Ct值减去其18 s的Ct值,即ΔCt=Ct(NER基因)-Ct(18 s)。ΔCt值越小,靶基因mRNA的相对表达水平越高。所有NER基因 mRNA及18 s rRNA的引物由美国 Applied Biosystems公司提供并保留引物序列信息。
1.2.3 宿主细胞再活化实验(HCR):通过梯度离心法从患者外周血中分离出T淋巴细胞,并将其储存在低温冰箱中,记录储存时间;纯化的pCMV-CAT质粒经BPDE(由西安交通大学第一附属医院科研平台提供)处理后,再次纯化后储存于冰箱中。DRC的活性
被定义为转染BPDE处理质粒细胞的CAT活性除以转染未被处理质粒细胞的CAT活性[15]。
1.3 统计学方法 使用SAS统计学软件进行分析。用卡方检验分析病例组与对照组之间的年龄、性别、吸烟和饮酒状况的差异;采用Wilcoxon秩和检验比较病例组与对照组之间的DRC水平和NER mRNA表达水平(连续变量)的差异;通过Logistic回归将DRC和NER mRNA表达水平进行了相关性分析;通过ROC曲线计算曲线下面积(AUC),对DRC和NER mRNA相对表达水平对HNSCC发病风险的诊断价值进行评价,并通过Logistic回归构建四个水平进行比较,分别为基础水平、NER基因水平、DRC水平及整合水平;基础水平仅包括年龄、性别、吸烟状态及饮酒状态;NER基因水平包括NER基因的mRNA相对表达水平,再加上基础水平中的变量;DRC水平包括DRC和基础水平中的变量;整合水平包括DRC、NER基因的mRNA相对表达水平以及基础水平中的变量。P<0.05 为差异有统计学意义。
2 结 果
2.1 两组一般资料比较 见表1。病例组与对照组性别及年龄比较差异无统计学意义(均P>0.05),病例组吸烟占比高于对照组(P<0.05),两组饮酒人群比例比较差异无统计学意义(P>0.05)。

表1 两组一般资料比较
2.2 病例组与对照组DRC水平及NER基因mRNA表达水平的差异及相关性 见表2~5。病例组的DRC(连续变量)平均水平显著低于对照组[(9.84±2.32 ) %与(10.35±2.42)%;Z=-3.241,P=0.013]。细胞的储存时间(CST),病例组时间长于对照组[(10.21±8.43)个月与(8.26±5.11)个月;Z=-8.120,P<0.001]。在9个NER基因中,病例组的XPA的表达水平均显著低于对照组(Z=-2.316,P=0.022)。不同部位肿瘤的DRC、XPA水平比较差异无统计学意义;XPA mRNA的表达水平与DRC水平具有相关性(r=-0.096,P=0.031)。

表2 两组DRC及CST水平比较

表3 两组NER mRNA表达水平比较

表4 不同部位肿瘤的DRC、XPA表达水平比较
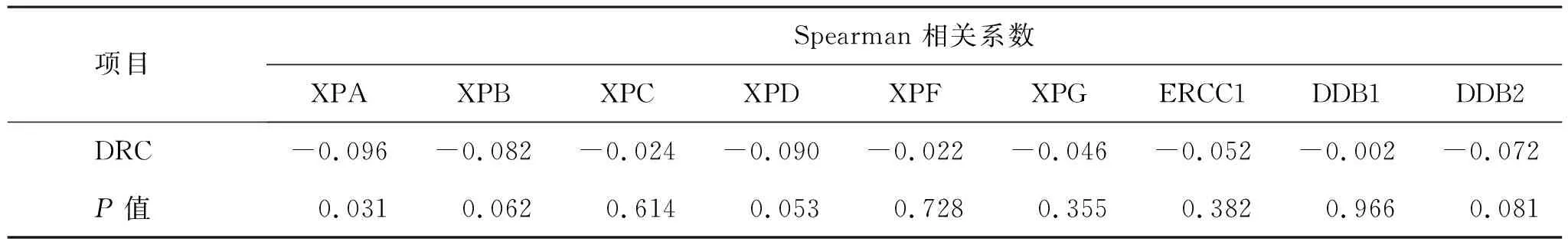
表5 NER基因 mRNA表达水平与DRC水平的相关性
2.3 通过整合DRC和NER mRNA表达预测HNSCC发病风险 通过ROC曲线计算AUC面积,构建四个水平对DRC和NER mRNA相对表达对HNSCC发病风险预测的可靠性进行评价。相比于不包含DRC的基础水平,DRC水平中ROC曲线中AUC面积显著增加(P=0.043)。用整合水平来评估DRC与NER mRNA这两种生物标志物对HNSCC发病风险预测的诊断价值,与单一的DRC水平相比,整合了DRC与XPA表达水平的ROC曲线中AUC显著增加(P=0.032);此外,与单一的NER基因水平(XPA)相比,整合两种标志物的水平ROC曲线中AUC也得到了改善(P=0.037)。
3 讨 论
既往研究发现HNSCC患者的DRC或NER mRNA水平明显低于健康对照组,这表明在中国人群中两者水平的降低可以分别作为一个独立的生物标志物来预测HNSCC的易感性[15-18]。由于单一的生物标志物在预测HNSCC易感性上具有局限性,因此我们将NER基因mRNA表达水平也加入到ROC曲线中作为整合水平来预测HNSCC的发病风险。结果显示相比于只含有单一NER表型的水平,整合水平对于HNSCC的易感性的预测效能更高。
DNA修复在多种生物过程中发挥着重要作用,DNA修复通路的功能障碍会导致不同类型癌症的发生[19]。此外,许多吸烟相关癌症的分子流行病学研究都包括DNA修复通路的遗传易感性,其中单核苷酸多态性(SNPs)和基因突变已被广泛研究[20]。然而,既往文献关于此的流行病学研究结果一直不确定。表型的生物标志物,比如DRC,可以检测由同一途径中不同基因的少数遗传变异决定的功能差异。事实上,已经有研究者提议将DRC作为包括HNSCC在内的几种癌症的易感性生物标志物[15,21]。
在非西班牙裔的白种人的研究中,DRC低水平的患者患HNSCC的风险是DRC高水平患者的1.91倍[15]。DRC表型可能体现了参与DNA修复通路的各种酶的一般活性,这表明,在相关分析中,特定DRC水平的评估比使用单个SNP或一个基因中的一组SNP具有一些优势[15]。然而,在本研究中,HPV状态未进行检测,这可能对DRC有一定影响。此外,在一个种族群体中发现的生物标志物在另一个种族群体中可能没有相同的用处;因此,这种关联需要在另一个种族组中进行验证。在本研究中,我们证实了在中国人群中DRC降低与HNSCC易感性增加具有相关性。
既往研究表明,在包括DRC水平中,ROC曲线下AUC显著改善[15]。更重要的是,我们在DRC水平中加入了NER基因表达作为一个新的整合水平,与仅包含DRC或NER基因表达的水平相比,包含DRC水平和NER基因表达水平能够显著提高ROC曲线下AUC。进一步表明,结合NER通路的DRC以及mRNA表达水平可以显著提高NER表型HNSCC风险预测的效能。
目前的流行病学研究是第一个整合DRC及NER表型来分析两者与HNSCC发表风险之间的相关性研究。虽然单个NER表型(即mRNA表达)的分析很容易进行,但该数据在预测HNSCC的风险时可能存在不可靠因素,因为PCR检测的结果可能随着不同的细胞阶段而波动。因此,为了提高预测的准确性,有必要整合另一个相关表型来预测HNSCC的发病风险。ROC曲线的AUC分析表明,在中国人群中,整合DRC水平和NER基因mRNA表达可以显著提高预测HNSCC发病风险的效能。
此外,本研究存在一些局限性。首先,在病例与对照研究中,尽管我们在招募病例和对照时应用了严格的频数匹配策略,以控制潜在的混杂变量,但是遗传选择偏倚仍然无法避免。第二,目前的研究没有包括任何遗传易感性的信息,虽然DNA修复基因的突变和SNP也可能影响个体的DRC,但DNA修复表型的测量在很大程度上已经反映了所有可能的遗传变异的以及其全部功能。第三,尽管我们在目前的研究中排除了HPV阳性受试者及其可能带来的影响,但是在HPV阳性受试者中是否会有相同的结果尚未知,因此在未来我们的研究结果应该在更多HPV阳性病例的研究中进行验证。
