沉默miR-6771-3p通过靶向AXIN2/Wnt信号通路调控异位子宫内膜间质细胞增殖和迁移实验研究
2023-11-11孙利娟黄香平张多多张小雪陆晓媛
孙利娟,黄香平,张多多,张小雪,陆晓媛
(1.徐州医科大学研究生学院,江苏 徐州 221004;2.徐州医科大学附属医院妇科,江苏 徐州 221004;3.华中科技大学附属同济医院妇科,湖北 武汉 430030)
子宫内膜异位症是一种激素依赖性妇科疾病,表现为原子宫内膜细胞增殖并迁移到子宫腔以外的区域,多好发于育龄期妇女[1-2]。已有研究[3]表明,子宫内膜异位症患者罹患其他疾病如风湿病、卵巢癌、哮喘、不孕症等的概率更高,危害女性健康。然而,子宫内膜异位症的确切机制尚未明确。目前研究[4]显示,子宫内膜细胞的高增殖性和迁移性在子宫内膜异位症的发病过程中起重要作用。微小RNA(miRNA)是一种经典的非编码RNA,参与自身免疫性疾病、内分泌疾病和呼吸系统疾病等多种疾病的发生和发展[5]。既往研究[6]证实,miRNA能够激活或抑制多种信号通路,负责调控细胞的迁移、凋亡、增殖、上皮-间充质转化等生物学行为。miRNA的异常表达与子宫内膜细胞的增殖和迁移之间存在相关性,恢复miRNA表达对改善子宫内膜异位症患者的预后可能具有重要作用[7-9]。miR-6771-3p是一个长度为21个核苷酸的miRNA,其基因定位于人染色体16q12.1,是影响卵巢癌化疗耐药性的决定性因素[10]。然而,miR-6771-3p在子宫内膜异位症中的作用机制尚不清楚。本研究探讨了miR-6771-3p在子宫内膜异位组织中的表达,分析其对异位子宫内膜细胞恶性生物学行为的作用和分子机制,以期miR-6771-3p靶向治疗子宫内膜异位症提供实验依据。
1 材料与方法
1.1 临床标本 收集2020年6月至2022年9月在徐州医科大学附属医院行“卵巢囊肿剥除术”,取得在位子宫内膜组织和异位组织34例,均经两名以上病理科专家诊断为子宫内膜异位症。患者年龄19~41岁,所有患者月经规律,没有其他生殖器官疾病,至少在5个月内没有经过激素类药物治疗。本研究通过本院伦理委员会批准,所有患者均签署知情同意书。
1.2 主要试剂 DMEM培养基和Trizol试剂购自美国Gibco公司。反转录试剂盒和实时聚合酶链式反应(RT-qPCR)试剂盒购自大连宝生物工程有限公司。胎牛血清、Lipofectamine 3000和引物购自美国Invitrogen公司。miR-6771-3p mimic和miR-NC mimic购自上海吉凯生物科技有限公司。靶向沉默miR-6771-3p的短发夹RNA载体和对照载体购自美国Corning公司。四噻唑蓝(MTT)试剂盒和RIPA裂解液购自美国Sigma公司。双荧光素酶报告基因试剂盒、轴抑制蛋白2(AXIN2)野生型载体(AXIN2-WT)和AXIN2突变型载体(AXIN2-MUT)购自上海碧云天生物技术有限公司。一抗AXIN2、α-Tubulin、β-catenin、c-Myc、p-GSK3、Cyclin D1和山羊抗鼠二抗均购自美国BD公司。
1.3 细胞原代培养和转染 将术中得到的新鲜异位子宫内膜组织采用磷酸盐缓冲液冲洗4次,在细胞间内剪碎组织,通过胶原酶消化20 min,取上清与含10%胎牛血清的DMEM培养基混合终止消化,离心去上清,接种到新的培养瓶中,37 ℃、5% CO2的培养箱中培养,12 h后细胞换液。当异位子宫内膜间质细胞处于对数生长期,将细胞分为空载体组和沉默组,空载体组转染对照载体,沉默组转染靶向沉默miR-6771-3p的短发夹RNA载体,使用Lipofectamine 3000试剂进行转染,将状态良好的异位子宫内膜间质细胞用于后续实验。
1.4 RT-qPCR检测miR-6771-3p和AXIN2 mRNA表达 加入1 ml 预冷Trizol处理组织和细胞,逆转录为互补核糖核酸。miR-6771-3p上游引物为 5’-CTGCGGGTAGACAGGGGTTTG-3’,下游引物为5’-GACATTCACCACTGCCGTCTC-3’;GAPDH上游引物为 5’-TGCACCACCAACTGCTTAGC-3’,下游引物为5’-GGCATGGACTGTGGTCATGAG-3’;AXIN2上游引物为 5’-AGCCAAAGCGATCTACAAAAGG-3’,下游引物为5’-AAGTCAAAAACATCTGGTAGGCA-3’。RT-qPCR反应条件:96 ℃预变性3 min;96 ℃变性45 s;63 ℃ 36 s,71 ℃ 36 s,32个循环。以2-ΔΔCt方法计算miR-6771-3p和AXIN2 mRNA表达,以GAPDH和U6分别为内参。
1.5 MTT检测异位子宫内膜间质细胞的增殖 将转染后的异位子宫内膜间质细胞以6×103个/孔接种于96孔板,连续5 d在同一时间点,加入40 μl MTT试剂,在37 ℃、5% CO2培养箱反应5 h。去上清,加入160 μl二甲基亚砜,均匀振荡20 min。在多功能酶标仪上测定每一个孔在450 nm波长的吸光度(OD)值。
1.6 细胞划痕愈合实验检测异位子宫内膜间质细胞的迁移 将转染后的异位子宫内膜间质细胞接种于12孔板,保证单层细胞铺满,去上清,采用预冷的磷酸盐缓冲液冲洗板底表面4次。采用200 μl枪头尖端在板底表面垂直划痕,采用预冷的磷酸盐缓冲液冲洗板底表面4次。加入不含胎牛血清的DMEM培养基,在37 ℃、5% CO2培养箱孵育。分别在0 h与24 h采用倒置显微镜照相,分别测量两个时间点的划痕间距,比较各组细胞的迁移率。
1.7 生物信息学技术和双荧光素酶实验验证靶向关系 采用miR Sponge软件预测miR-6771-3p具有结合位点的靶基因mRNA。收集生长到对数期异位子宫内膜间质细胞,在24孔板孵育24 h。分别将2 μl AXIN2野生型载体(AXIN2-WT)或AXIN2突变型载体(AXIN2-MUT)与miR-6771-3p mimic或miR-NC mimic共转染异位子宫内膜间质细胞。在37 ℃、5% CO2培养箱孵育46 h,采用双荧光素酶报告基因试剂盒裂解异位子宫内膜间质细胞并分析荧光素酶的相对活性。
1.8 Western blot检测细胞中AXIN2蛋白和Wnt信号通路蛋白的表达 加入160 μl RIPA裂解液处理转染后的异位子宫内膜间质细胞,40 min后离心得到上清,经8%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离,在4 ℃聚转至聚偏氟乙烯膜。在9%脱脂牛奶中进行封闭50 min。将膜与一抗AXIN2(1∶3000稀释)、α-Tubulin(1∶4000稀释)、Cyclin D1(1∶3000稀释)、β-catenin(1∶2000稀释)、c-Myc(1∶2000稀释)、p-GSK3(1∶1000稀释)在5 ℃孵育过夜。与对应山羊抗鼠二抗在37 ℃孵育125 min,选择α-Tubulin为内参,在凝胶成像系统中显影。
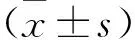
2 结 果
2.1 子宫在位内膜组织和异位内膜组织中miR-6771-3p表达比较 RT-qPCR检测显示,子宫在位内膜组织和异位内膜组织中miR-6771-3p表达分别为(1.15±0.13)和(4.02±0.24),子宫异位内膜组织中miR-6771-3p的表达高于子宫在位内膜组织(P<0.01)。
2.2 短发夹RNA转染对miR-6771-3p表达水平的影响 RT-qPCR检测显示,沉默组和空载体组异位子宫内膜间质细胞中miR-6771-3p分别为(0.97±0.39)和(4.51±1.64),沉默组明显低于空载体组(P<0.01)。
2.3 沉默组和空载体组异位子宫内膜间质细胞增殖情况比较 通过MTT法分析显示(图1),在第2、3、4、5天,沉默miR-6771-3p的沉默组异位子宫内膜间质细胞活力低于空载体组(均P<0.05)。
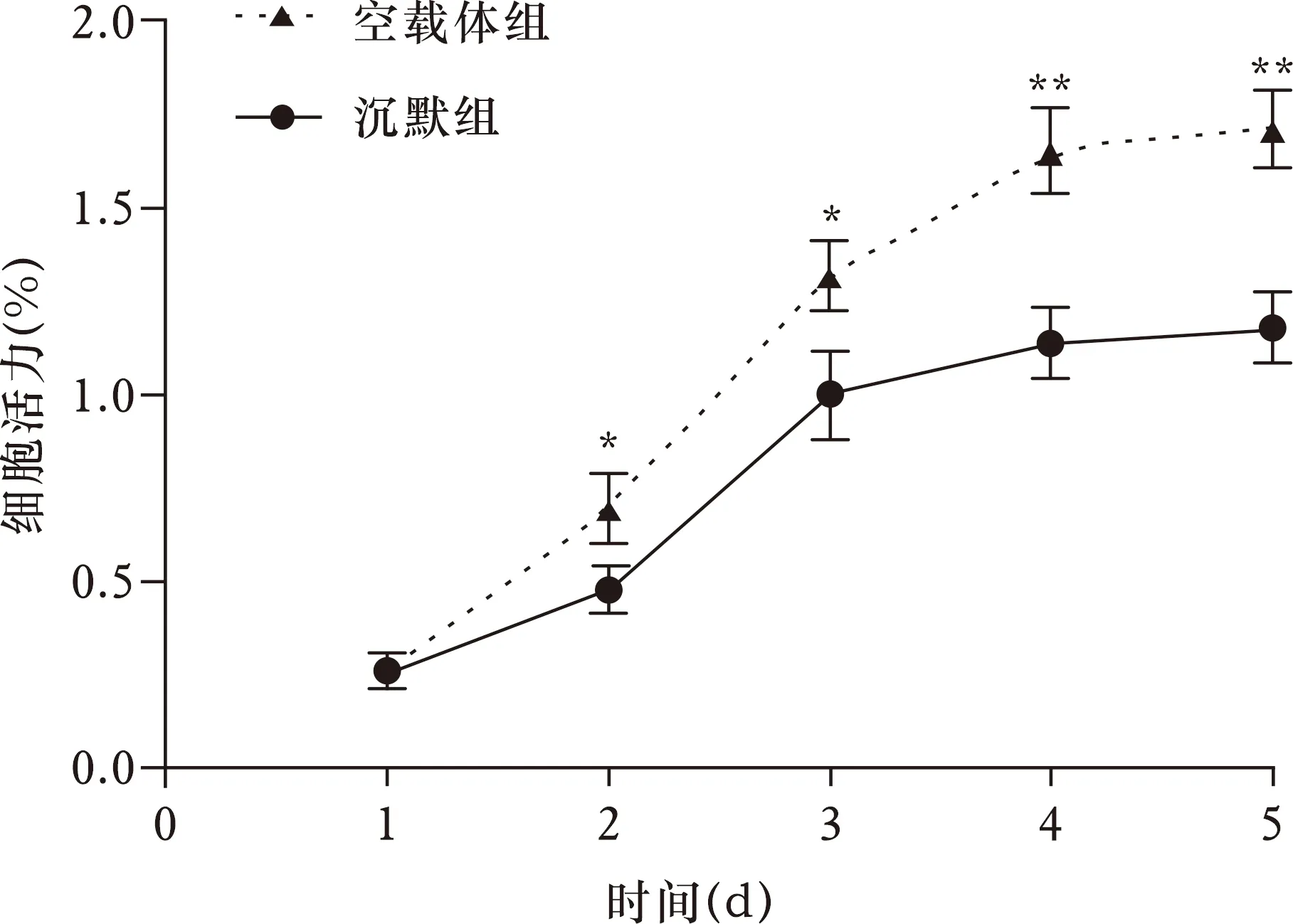
注:与空载体组相比,*P<0.05,**P<0.01图1 沉默组和空载体组异位子宫内膜间质细胞增殖情况比较
2.4 沉默组和空载体组异位子宫内膜间质细胞迁移情况比较 通过细胞划痕愈合实验分析显示,沉默组和空载体组异位子宫内膜间质细胞迁移率分别为(16.36±4.38)%和(55.38±7.12)%,沉默组异位子宫内膜间质细胞迁移率明显低于空载体组(P<0.01)。
2.5 生物信息学软件预测miR-6771-3p的靶基因 采用miR Sponge软件预测显示(图2),miR-6771-3p与AXIN2 mRNA具有结合位点,AXIN2野生型载体位点(GGGUUU)突变为AXIN2突变型载体(CCCAAA)。

图2 miR-6771-3p与AXIN2 mRNA的结合位点
2.6 miR-6771-3p与AXIN2 mRNA的相互关系 双荧光素酶报告基因实验发现(图3),与AXIN2-WT+miR-NC mimic共转染相比,AXIN2-WT+miR-6771-3p mimic明显降低了异位子宫内膜间质细胞的荧光素酶相对活性(P<0.01)。

注:与miR-NC比较,**P<0.01图3 miR-6771-3p与AXIN2 mRNA的相互关系
2.7 沉默miR-6771-3p对异位子宫内膜间质细胞中AXIN2 mRNA表达的影响 RT-qPCR检测显示,沉默组和空载体组异位子宫内膜间质细胞中AXIN2 mRNA表达分别为(7.87±1.26)和(1.01±0.42),沉默组AXIN2 mRNA表达显著高于空载体组(P<0.01)。
2.8 沉默miR-6771-3p对AXIN2蛋白和Wnt信号通路蛋白表达的影响 Western blot检测显示(图4),与空载体组相比,沉默miR-6771-3p后AXIN2蛋白表达显著增加(P<0.01),细胞Wnt信号通路蛋白β-catenin、c-Myc、p-GSK3、Cyclin D1表达明显降低(均P<0.01)。
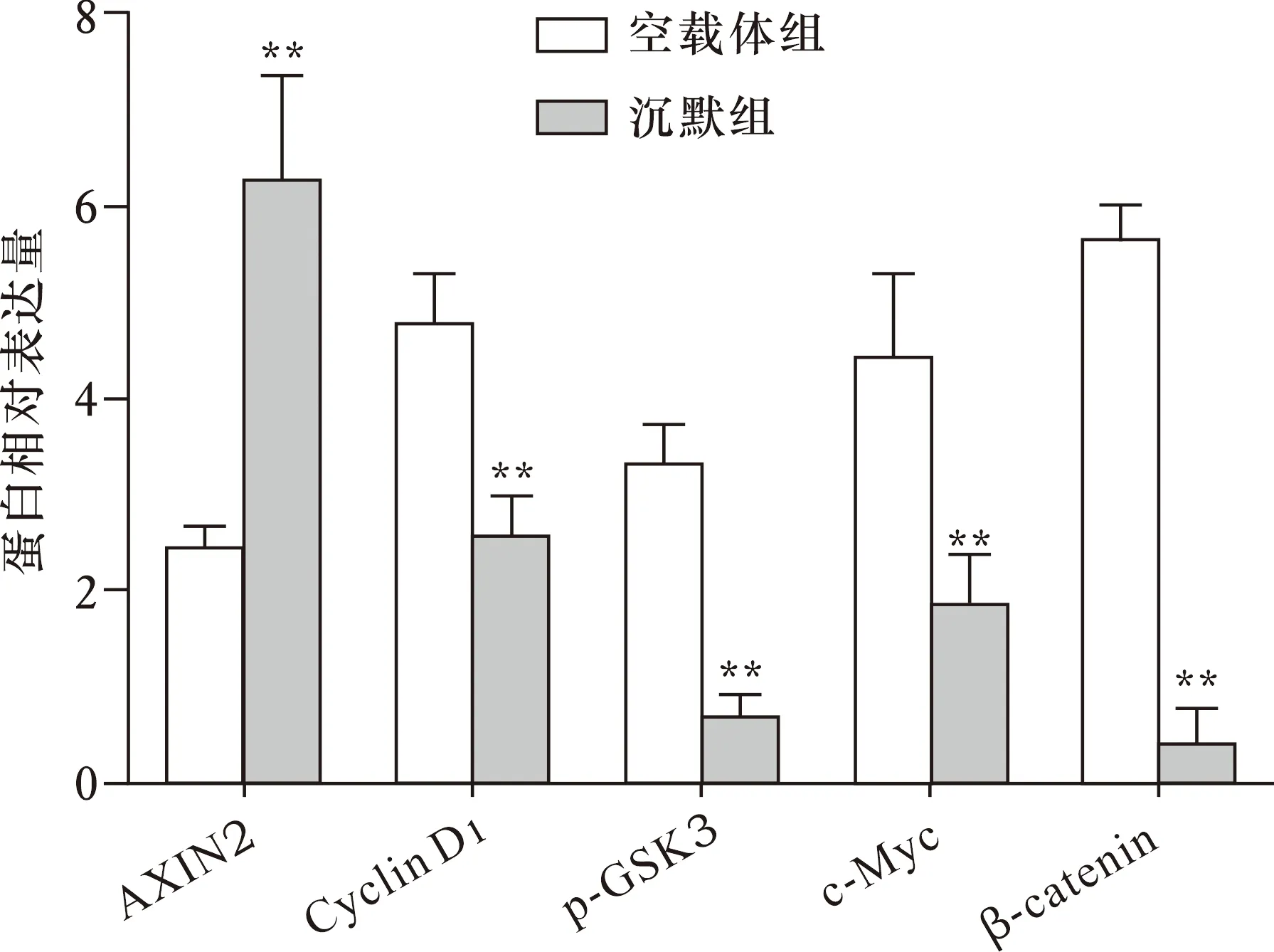
注:与空载体组比较,**P<0.01图4 沉默miR-6771-3p对AXIN2蛋白和Wnt信号通路蛋白表达的影响
3 讨 论
子宫内膜异位症是常见的妇科疾病之一,一般采用手术和激素治疗,患者复发的风险很高[11-13]。因此,寻找潜在的分子治疗靶点可能有助于改善子宫内膜异位症的预后。最近研究[14-16]表明,miRNA参与子宫内膜细胞的增殖和迁移过程,可以作为子宫内膜异位症的诊断标志物和治疗靶点。例如,在位子宫内膜组织中miR-126表达高于异位子宫内膜组织,miR-126可通过有效抑制异位子宫内膜间质细胞迁移和侵袭,减缓子宫内膜异位症的发展[17]。又如,miR-141-5p在异位子宫内膜组织中的表达水平显著低于在位子宫内膜组织,其通过抑制异位子宫内膜间质细胞的上皮-间充质转化和增殖,降低子宫内膜异位症的病灶大小[18]。既往研究[10]发现,miR-6771-3p在卵巢癌组织和细胞系中低表达,参与调控卵巢癌细胞对5-氟尿嘧啶的耐药性。然而,miR-6771-3p在子宫内膜异位症中的作用和生物学机制尚未被报道研究。
本研究通过RT-qPCR检测发现,在34例子宫异位内膜组织中miR-6771-3p表达明显高于在位内膜组织,这表明miR-6771-3p可能是子宫内膜异位症的促进因子。为进一步确定其在子宫内膜异位症中的功能,本研究通过体外细胞实验发现,沉默miR-6771-3p可明显抑制异位子宫内膜间质细胞的增殖和迁移,这说明靶向沉默miR-6771-3p对子宫内膜异位症的发病可能具有改善功能。miRNA主要通过靶向结合靶基因3’非翻译区,特异性降低靶基因的表达,调控细胞的生物学行为[19-21]。本研究通过靶基因预测技术和双荧光素酶报告基因分析证实,miR-6771-3p靶向结合AXIN2 mRNA。AXIN2蛋白是经典分子通路Wnt信号通路的关键调控因子,其在细胞的分化、发育、迁移和增殖等生物学行为中发挥重要作用[22]。研究[23]表明,AXIN2蛋白能够有效抑制细胞的生长和转移,淋巴结转移的肿瘤组织中AXIN2蛋白表达明显小于无淋巴结转移。AXIN2蛋白通过磷酸化β-catenin蛋白,加速其被泛蛋白酶降解,有效抑制β-catenin蛋白的表达,从而干扰Wnt信号通路的转导[24]。因此,AXIN2蛋白能够通过干扰Wnt信号通路,抑制子宫内膜异位症的发生。在本研究中,沉默miR-6771-3p表达,降低了异位子宫内膜间质细胞中AXIN2基因水平,阻滞Wnt信号通路转导。
综上所述,miR-6771-3p在子宫异位内膜组织中高表达,沉默miR-6771-3p可以靶向上调AXIN2基因表达并且降低Wnt信号通路活性,抑制异位子宫内膜间质细胞的增殖和迁移。miR-6771-3p可能是子宫内膜异位症治疗的分子标志物和潜在治疗靶点。
