羟氯喹通过Toll样受体4/核因子-κB信号通路对系统性红斑狼疮小鼠肺损伤的影响
2023-11-11付永涛王莉平郭金明张红霞
付永涛,王莉平,郭金明,张 娜,张红霞,许 冰
(1.邯郸市中心医院,河北 邯郸 056001;2.石家庄市第四医院,河北 石家庄 050035;3.邯郸市邯钢医院,河北 邯郸 056001)
系统性红斑狼疮(Systemic lupus erythematosus,SLE)临床表现以红斑皮疹为主并易累及肺、肾、心等器官组织,多发于育龄期女性。据统计,50%~70%的SLE患者伴随不同程度的肺损伤,可引发肺感染、间质性肺疾病、肺栓塞、肺动脉高压、肺萎缩综合征等肺部并发症,是导致SLE患者死亡的主要因素[1]。SLE发病机制非常复杂,其中炎性反应在SLE发生发展过程中发挥着重要作用,研究证实,肺部炎症是SLE肺损伤进行性加重的重要病理通路[2]。Toll样受体4(Toll-like receptor 4,TLR4)/核因子-κB(Nuclear factor-κB,NF-κB)信号通路在炎性反应调控机制中扮演着重要角色[3]。有文献报道通过抑制TLR4/NF-κB信号通路能够减轻SLE小鼠炎性反应[4]。羟氯喹(Hydroxychloroquine,HCQ)是一种4-氨基喹啉衍生物,具有调节免疫、抗炎等药理学作用,目前主要用于类风湿关节炎以及毒性较小药物疗效不佳的自身免疫性疾病的治疗。近年来研究发现HCQ对SLE所致动脉粥样硬化、肾损伤等并发症具有明显的保护作用,其作用机制与抑制炎性反应有关[5-6]。此外,HCQ可通过抑制TLR4/NF-κB信号通路减轻创伤性脑损伤小鼠神经炎症[7]。但HCQ是否对SLE肺损伤具有保护作用尚未见文献报道。本研究旨在探讨HCQ对SLE模型小鼠肺损伤的影响,并基于TLR4/NF-κB信号通路探索其潜在机制。
1 材料与方法
1.1 实验动物 32只雌性MRL/lpr狼疮小鼠(自发型SLE小鼠模型)和8只雌性C57BL/6小鼠购自斯贝福(北京)生物技术有限公司[SCXK(京)2019-0010],7~8周龄,19~22 g。在室温23~25 ℃、湿度45%~65%、12 h光暗交替的清洁环境下饲养。
1.2 试剂与仪器 HCQ片(上海上药中西制药公司,国药准字H19990263,批号2022A04016);TAK242(TLR4抑制剂,美国CST公司);LPS(TLR4激动剂,美国Sigma公司);抗核抗体(ANA)、抗双链DNA(ds-DNA)ELISA法检测试剂盒(北京华英生物技术研究所);干扰素-γ(IFN-γ)、肿瘤坏死因子-α(TNF-α)、IL-1β、IL-6 ELISA法检测试剂盒和RIPA裂解液、ECL显色液(北京索莱宝生物科技公司);HE、Masson染色试剂盒和总RNA提取试剂盒、BCA蛋白浓度检测试剂盒(北京博奥森生物技术公司);RT-qPCR逆转录试剂盒、扩增试剂盒(日本Takara公司);IgG二抗(武汉三鹰生物技术有限公司);TLR4、NF-κB p65、IκBα、β-actin抗体(英国Abcam公司)。PUR2型肺功能仪(法国EMKA公司);MK-3型酶标仪(芬兰雷勃集团);RM2245型石蜡切片机(德国Leica公司);220R型高速冷冻离心机(德国Hettich公司);ETC811型PCR仪(北京东胜创新公司);552BR型电泳仪、Turbo System型电转仪(美国Bio-Rad公司)。
1.3 实验方法
1.3.1 分组与给药:8只雌性C57BL/6小鼠设为正常对照组。32只雌性MRL/lpr狼疮小鼠按照随机数字表法随机分为模型组、HCQ组、HCQ+TAK242组和HCQ+LPS组,每组8只。HCQ组灌胃(IG)给予80 mg/kg HCQ(根据人与小鼠剂量换算公式计算所得),HCQ+TAK242组IG给予80 mg/kg HCQ和腹腔注射(IP)给予0.3 mg/kg TAK242[8];HCQ+LPS组IG给予80 mg/kg HCQ和IP给予2.5 mg/kg LPS[8];正常对照组和模型组IG给予0.9%氯化钠溶液,各组均1次/d给药连续治疗5周。
1.3.2 肺功能指标检测:末次给药2 h后,IP 0.3%戊巴比妥钠(40 mg/kg)麻醉小鼠,连接肺功能检测仪,待小鼠呼吸平稳以后,测定肺功能指标,包括气道阻力(Raw)、动态肺顺应性(Cdyn)和第0.1秒用力呼气容积(FEV0.1)。
1.3.3 ELISA法检测肺泡灌洗液中炎症因子表达水平:应用注射器将1 ml磷酸盐缓冲液缓慢注入小鼠肺组织,30 s后回抽并收集液体,重复灌洗3次,遵照ELISA法试剂盒操作说明检测肺泡灌洗液中炎症因子IFN-γ、TNF-α、IL-1β、IL-6表达水平。
1.3.4 ELISA法检测血清免疫学指标水平:摘眼球取血并分离血清,遵照ELISA法试剂盒操作说明检测血清免疫学指标ANA、ds-DNA表达水平。
1.3.5 HE、Masson染色法观察肺组织病理学改变和纤维化状况:颈椎脱臼处死小鼠后,开胸取肺脏,0.9%氯化钠溶液冲洗干净后,左肺组织置于-20 ℃保存备检,将右肺组织置于10%中性甲醛溶液中固定72 h,然后依次行梯度乙醇溶液脱水、浸石蜡包埋、5 μm切片、展片和烤片处理,经梯度乙醇溶液脱蜡水化后分别行HE染色和Masson染色。①通过观察HE染色切片考察肺组织病理学改变,参照刘云涛等[9]报道的方法进行肺组织病理评分:肺组织未见病理学形态结构改变,记0分;肺组织肺泡壁增厚、炎性细胞浸润、肺泡间隔增厚、毛细血管扩张等病变的面积占视野面积的比例<25%、25%~50%、50%~75%、>75%分别记1、2、3、4分。②通过观察Masson染色切片考察肺组织纤维化状况,蓝色为胶原纤维着色。胶原容积分数(CVF)=(蓝色着色面积/总面积)×100%。
1.3.6 RT-qPCR法检测肺组织TLR4、NF-κB p65、IκBα mRNA表达:取部分左肺组织,Trizol法提取总RNA,按试剂盒操作说明依次进行RNA逆转录和PCR扩增(95 ℃预变性5 min,95 ℃ 15 s、60 ℃ 30 s进行45个循环)。β-actin作为内参,以2-ΔΔCt公式计算TLR4、NF-κB p65、IκBα mRNA相对表达量。PCR引物由生工生物工程(上海)公司设计与合成,引物序列见表1。

表1 引物序列
1.3.7 Western blot法检测肺组织TLR4、NF-κB p65、IκBα蛋白表达:在冰上,取适量左肺组织通过RIPA裂解后提取总蛋白,经蛋白浓度测定和高温变性处理后,30 μg总蛋白量上样,依次进行10% SDS-PAGE凝胶电泳分离、转膜、封闭处理,4 ℃孵育一抗稀释液TLR4(1∶1000)、NF-κB p65(1∶1000)、IκBα(1∶1000)、内参β-actin(1∶2000)过夜,TBST溶液洗膜3×5 min后室温孵育二抗稀释液(1∶2000)1.5 h,TBST溶液洗膜3×5 min后加ECL显影,与内参条带灰度值的比值作为目标蛋白相对表达量。
2 结 果
2.1 HCQ对SLE小鼠肺功能的影响 见表2。与正常对照组相比,模型组小鼠肺功能指标Raw明显升高,Cdyn和FEV0.1明显降低(均P<0.05)。与模型组相比,HCQ组Raw明显降低,Cdyn和FEV0.1明显升高(均P<0.05)。与HCQ组相比,HCQ+TAK242组Raw明显降低,Cdyn和FEV0.1明显升高(均P<0.05),HCQ+LPS组Raw明显升高、Cdyn和FEV0.1明显降低(均P<0.05)。

表2 HCQ对SLE小鼠肺功能的影响
2.2 HCQ对SLE小鼠肺泡灌洗液中炎症因子表达水平的影响 见表3。与正常对照组相比,模型组小鼠肺泡灌洗液中IFN-γ、TNF-α、IL-1β、IL-6水平明显升高(均P<0.05)。与模型组相比,HCQ组IFN-γ、TNF-α、IL-1β、IL-6水平明显降低(均P<0.05)。与HCQ组相比,HCQ+TAK242组IFN-γ、TNF-α、IL-1β、IL-6水平明显降低(均P<0.05),HCQ+LPS组IFN-γ、TNF-α、IL-1β、IL-6水平明显升高(均P<0.05)。
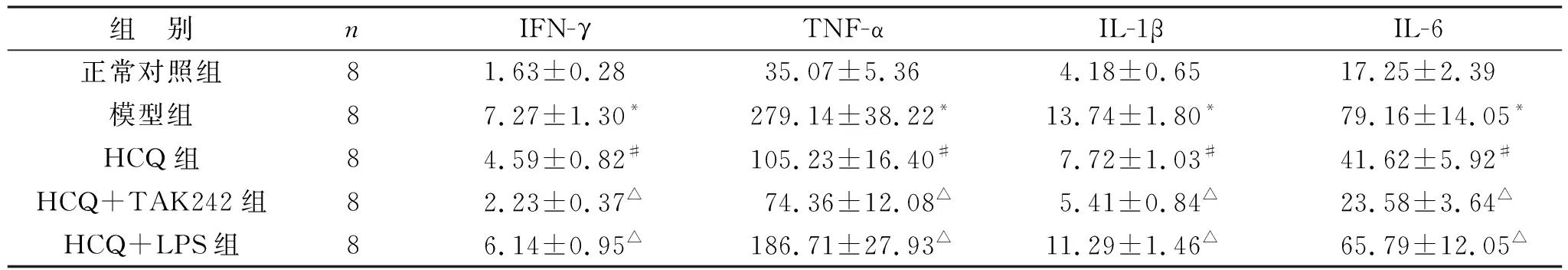
表3 HCQ对SLE小鼠肺泡灌洗液中炎症因子表达水平的影响(pg/ml)
2.3 HCQ对SLE小鼠血清中免疫学指标的影响 见表4。与正常对照组相比,模型组小鼠血清中ANA、ds-DNA水平明显升高(均P<0.05)。与模型组相比,HCQ组ANA、ds-DNA水平明显降低(均P<0.05)。与HCQ组相比,HCQ+TAK242组ANA、ds-DNA水平明显降低(均P<0.05),HCQ+LPS组ANA、ds-DNA水平明显升高(均P<0.05)。

表4 HCQ对SLE小鼠血清中免疫学指标的影响(pg/ml)
2.4 HCQ对SLE小鼠肺组织病理学改变的影响 见图1、2。正常对照组肺组织形态结构未见异常。模型组小鼠肺组织呈现肺泡壁增厚、肺泡腔缩小、泡腔可见渗出物、肺泡间隔和肺间质增厚、弥漫性炎性细胞浸润等病理学改变。与模型组比较,HCQ组肺组织病理学改变均明显改善。与HCQ组比较,HCQ+TAK242组肺组织病理学改变明显改善,HCQ+LPS组病理学改变明显加重。与正常对照组相比,模型组肺组织病理评分明显升高(P<0.05);与模型组相比,HCQ组肺组织病理评分明显降低(P<0.05);与HCQ组比较,HCQ+TAK242组肺组织病理评分明显降低(P<0.05),HCQ+LPS组肺组织病理评分明显升高(P<0.05)。
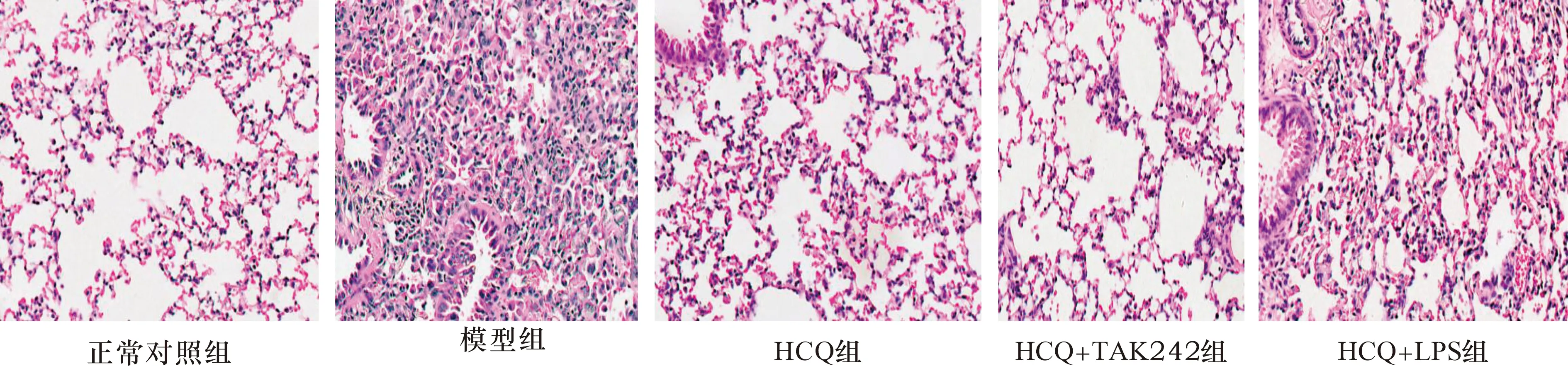
图1 HCQ对SLE小鼠肺组织病理学改变的影响(HE染色,×200)
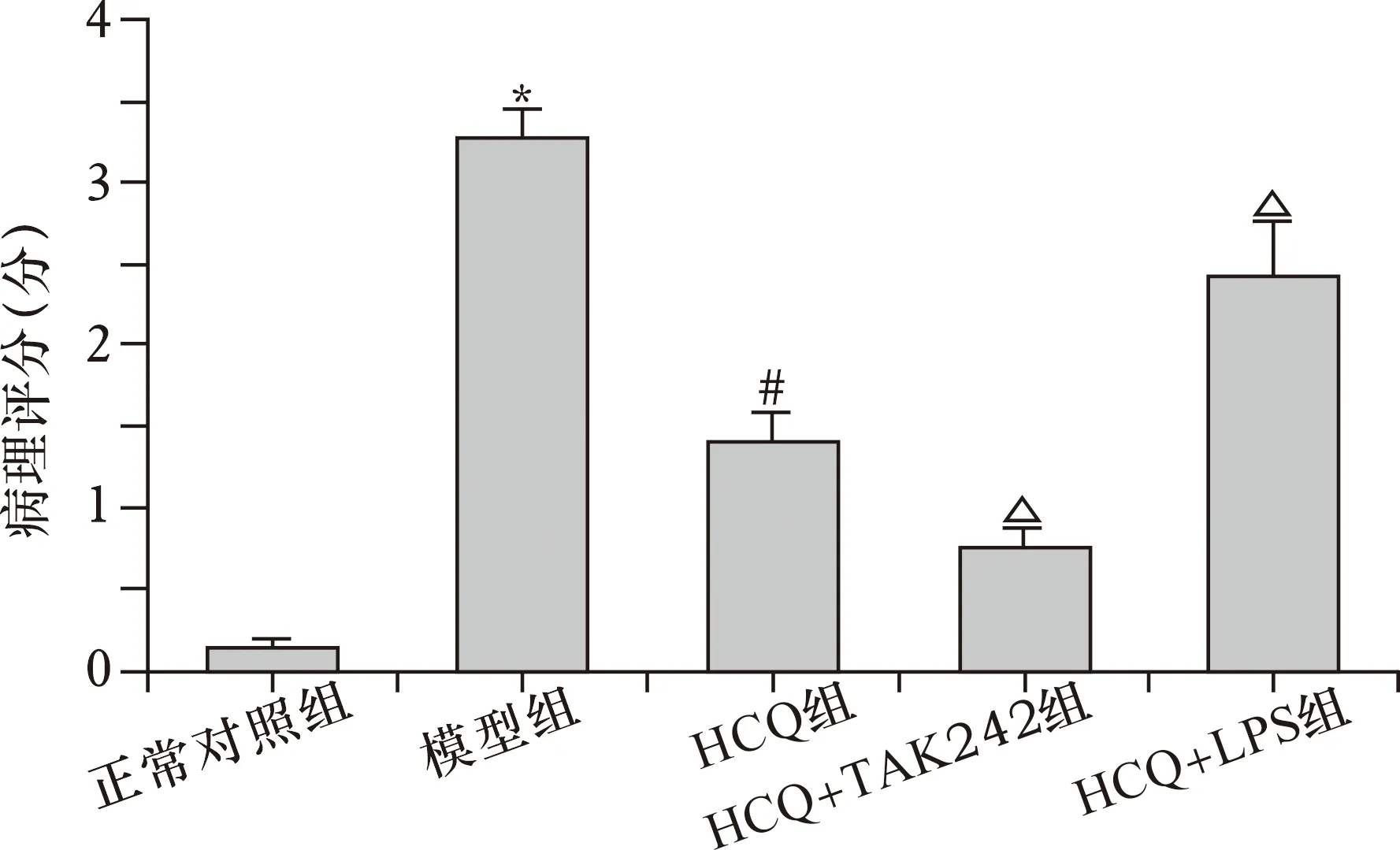
注:与正常对照组比较,*P<0.05;与模型组比较,#P<0.05;与HCQ组比较,△P<0.05图2 HCQ对SLE小鼠肺组织病理评分的影响(n=8)
2.5 HCQ对SLE小鼠肺组织纤维化的影响 见图3、4。正常对照组肺组织仅肺泡间隔区域呈现少量胶原纤维。与正常对照组相比,模型组肺泡间隔和肺间质区胶原纤维明显增多。与模型组比较,HCQ组肺泡间隔和肺间质区胶原纤维明显减少。与模型组相比,HCQ组肺泡间隔和肺间质区胶原纤维明显减少。与HCQ组相比,HCQ+TAK242组肺泡间隔和肺间质区胶原纤维明显减少,HCQ+LPS组肺泡间隔和肺间质区胶原纤维明显增多。模型组小鼠肺组织CVF较正常对照组明显升高(P<0.05)。与模型组相比,HCQ组CVF明显降低(P<0.05)。与HCQ组相比,HCQ+TAK242组CVF明显降低(P<0.05),HCQ+LPS组CVF明显升高(P<0.05)。

图3 HCQ对SLE小鼠肺组织纤维化的影响(Masson染色,×200)
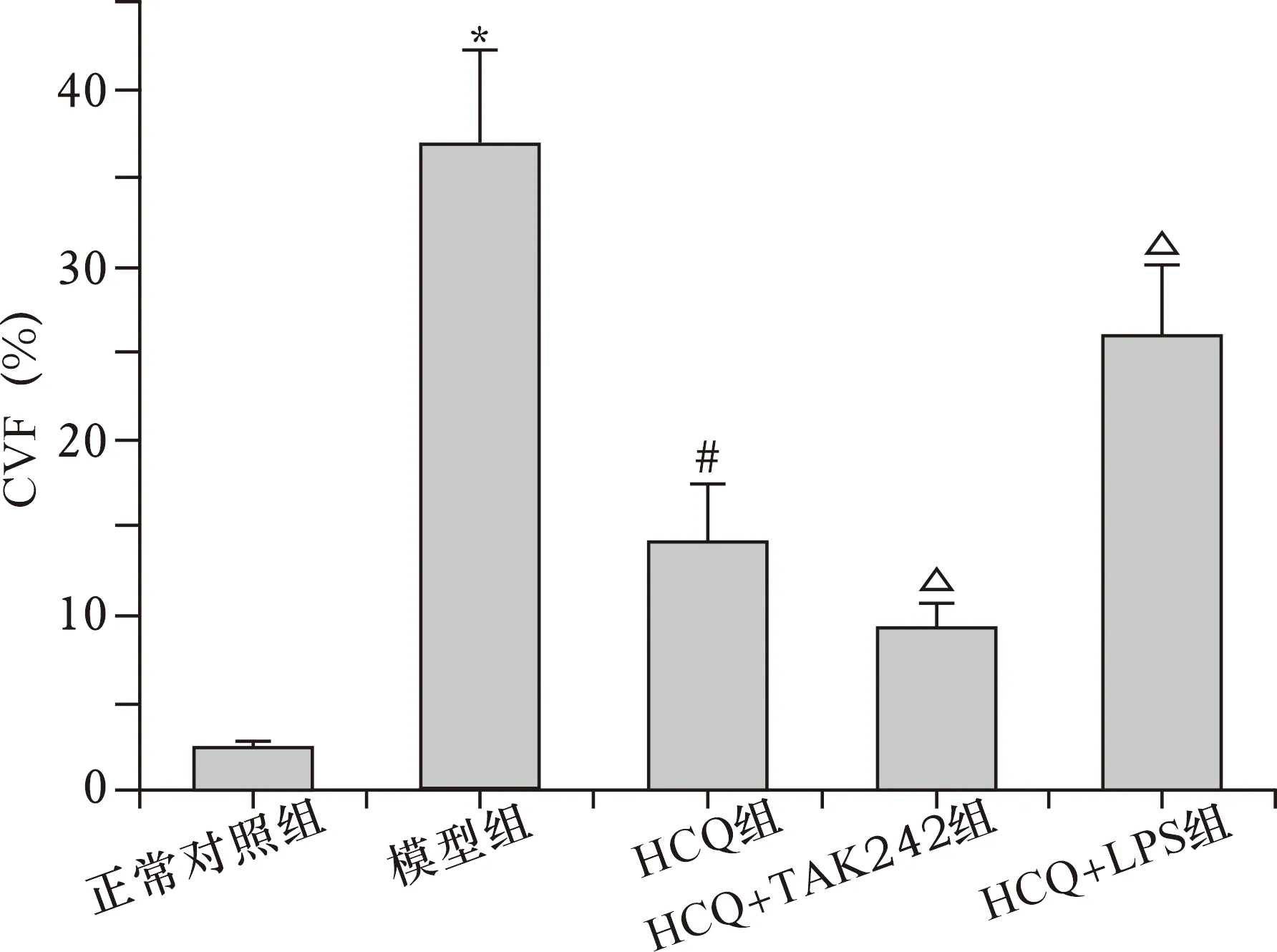
注:与正常对照组比较,*P<0.05;与模型组比较,#P<0.05;与HCQ组比较,△P<0.05图4 HCQ对SLE小鼠肺组织CVF的影响(n=8)
2.6 HCQ对SLE小鼠肺组织TLR4、NF-κB p65、IκBα mRNA表达的影响 见图5。与正常对照组相比,模型组TLR4、NF-κB p65、IκBα mRNA表达明显上调(均P<0.05)。与模型组相比,HCQ组TLR4、NF-κB p65、IκBα mRNA表达明显下调(均P<0.05)。与HCQ组相比,HCQ+TAK242组TLR4、NF-κB p65、IκBα mRNA表达明显下调(均P<0.05),HCQ+LPS组TLR4、NF-κB p65、IκBα mRNA表达明显上调(均P<0.05)。

注:与正常对照组比较,*P<0.05;与模型组比较,#P<0.05;与HCQ组比较,△P<0.05图5 HCQ对SLE小鼠肺组织TLR4、NF-κB p65、IκBα mRNA表达的影响(n=8)
2.7 HCQ对SLE小鼠肺组织TLR4、NF-κB p65、IκBα蛋白表达的影响 见图6。与正常对照组相比,模型组TLR4、NF-κB p65、IκBα蛋白表达明显上调(均P<0.05)。与模型组相比,HCQ组TLR4、NF-κB p65、IκBα蛋白表达明显下调(均P<0.05)。与HCQ组相比,HCQ+TAK242组TLR4、NF-κB p65、IκBα蛋白表达明显下调(均P<0.05),HCQ+LPS组TLR4、NF-κB p65、IκBα蛋白表达明显上调(均P<0.05)。

注:与正常对照组比较,*P<0.05;与模型组比较,#P<0.05;与HCQ组比较,△P<0.05图6 HCQ对SLE小鼠肺组织TLR4、NF-κB p65、IκBα蛋白表达的影响
3 讨 论
目前,SLE动物模型主要有自发型和人工诱导型两大类。自发型SLE动物模型(如:MRL/lps小鼠、BXSB小鼠和NZB×NZW F1小鼠)具有遗传稳定性好、发病机制及病情进展与人类相似等优点,是目前探索SLE病理机制及新药研究最常用的动物模型,其中雌性MRL/lps小鼠模型最为经典[10]。本研究选择雌性MRL/lps小鼠作为受试SLE动物模型,结果显示,经HCQ治疗5周能够明显改善SLE小鼠肺功能(降低Raw并提高Cdyn、FEV0.1),减轻肺组织病理学改变和纤维化状况,降低病理评分和CVF,该结果与谢长好等[11]和谈欣怡等[12]研究结果相似。表明HCQ对SLE小鼠肺损伤具有保护作用,对SLE小鼠肺功能具有改善作用。
SLE病理机制复杂,与环境、遗传、免疫、激素等多因素相关,有文献[13]报道T细胞和B淋巴细胞异常活化导致免疫功能紊乱及免疫复合物沉淀,进而引发IFN-γ、TNF-α、IL-1β、IL-6等炎症细胞因子大量分泌是SLE及其并发症进行性加重的重要机制。免疫学指标血清ANA、ds-DNA水平与SLE活动度密切相关,是公认的SLE临床诊断指标[14]。IFN-γ在SLE发病机制中发挥着中枢介质的作用,抑制IFN-γ可作为自身免疫性疾病治疗靶点[15]。炎症因子TNF-α、IL-1β、IL-6能够刺激巨噬细胞等进一步释放炎症因子并促进炎性细胞浸润,从而加重炎症损伤[16]。本研究结果显示,经HCQ治疗能够明显降低SLE小鼠血清ANA、ds-DNA水平和肺泡灌洗液中IFN-γ、TNF-α、IL-1β、IL-6水平,提示HCQ可改善SLE小鼠免疫功能并降低肺组织炎性反应,这可能是HCQ减轻SLE小鼠肺损伤并改善其肺功能的重要机制。
Toll样受体(TLRs)是一类跨膜识别受体,Jiang等[17]报道TLRs 中的TLR4亚型介导单核细胞活化后释放大量TNF-α、IL-1β等炎症因子释放,在SLE发生发展过程中发挥着重要作用。TLR4下游靶蛋白NF-κB是一种由p65和p50两种亚基组成的异源二聚体,生理状态下NF-κB定位于细胞质以无活性的“NF-κB-IκBα”聚合体形式存在,TLR4可诱导“NF-κB-IκBα”聚合体解离和游离态NF-κB核转位,入核后NF-κB p65亚基可促进IFN-γ、TNF-α、IL-1β、IL-6等炎症因子转录与表达,进而诱导炎性反应[18-19]。本研究发现,经HCQ治疗能够明显降低SLE小鼠肺组织TLR4、NF-κB p65、IκBα mRNA和蛋白表达量,提示HCQ降低SLE小鼠肺组织炎性反应可能与抑制TLR4/NF-κB信号通路有关。该结果与Tumurkhuu等[20]研究结果相似。为了验证上述推论,本实验设置了HCQ+TAK242(TLR4抑制剂)组和HCQ+LPS(TLR4激动剂)组,结果显示,TAK242可明显增强HCQ对SLE小鼠肺组织病变、肺功能、免疫功能、炎性反应指标以及TLR4/NF-κB信号通路的调控作用,而LPS则能够明显逆转HCQ对SLE小鼠各指标的调控作用,从而进一步证实了HCQ减轻SLE小鼠肺损伤的作用与抑制TLR4/NF-κB信号通路有关。
综上所述,HCQ可减轻SLE小鼠肺损伤,改善其肺功能,其机制可能与抑制TLR4/NF-κB信号通路,减轻炎性反应有关。本研究结果为HCQ作为SLE肺损伤治疗药物提供了理论依据,但其作用机制尚需进一步研究。
