药物相关性青光眼的研究进展
2023-11-10邓娅青江海波
邓娅青, 江海波
中南大学湘雅医院眼科中心,湖南长沙 410008
青光眼是临床中最常见的不可逆性致盲性眼病,以进行性视神经病变为特征,最终导致视野缺损甚至失明。眼压升高是青光眼最主要的危险因素,在青光眼发展过程中起重要作用,眼压高低主要由眼内房水的生成、房水的外流以及上巩膜静脉压共同决定[1]。青光眼根据发病的缓急程度分为急性和慢性青光眼;根据前房角的开放和关闭分为开角型和闭角型青光眼;根据病因是否明确分为原发性和继发性青光眼。其中继发性青光眼是由于某些眼病或全身疾病,干扰或破坏了正常的房水循环,使房水流出受阻而引起眼压增高,其病因比较明确。药物相关性青光眼属于继发性青光眼中的一种类型,由于局部或全身应用某些药物所致,可表现为开角型青光眼(open angle glaucoma,OAG)和闭角型青光眼(angle closure glaucoma,ACG),临床中发现的药物相关性OAG以慢性居多,而药物相关性ACG绝大多数是急性闭角型青光眼(acute angle closure glaucoma,AACG)[2]。
1 发病原因
药物相关性青光眼具有明确的病因,至少有1/3的AACG病例与使用处方药或非处方药有关,如肾上腺素能药物、胆碱能药物、抗胆碱药物、磺胺类药物、抗生素类药物、精神类药物、抗组胺类药物、抗凝药物等,给药途径包括局部给药(如滴眼剂、滴鼻剂以及雾化吸入剂等)和全身给药(表1)[3-4]。

表1 诱发AACG的药物种类及相关药物给药途径
药物相关性OAG最常见的病因是使用激素类抗炎药[5]。研究报道,因长期使用皮质类固醇升高的眼压,称为皮质类固醇诱导的高眼压(steroid-induced ocular hypertension,SIOH),如果未及时干预,SIOH持续存在,最终导致皮质类固醇性青光眼(steroid-induced glaucoma,SIG)[6]。其他已报道的可引起眼压升高药物有抗血管内皮生长因子(vascular endothelial growth factor,VEGF)[7]和紫杉醇[8]。
2 临床特点
药物相关性AACG临床特点与原发性AACG相似,包括头痛、腹痛、恶心、呕吐、视力模糊、严重眼痛和虹视等症状,以及眼压明显升高、前房变浅或消失、瞳孔中度扩大、瞳孔对光反射迟钝、角膜水肿、结膜充血和(或)睫状充血等体征[9]。仅根据症状和体征难以鉴别药物相关性AACG与原发性AACG,二者之间鉴别的关键点是有无相关药物服用史,但眼部体征可作为AACG和其他系统疾病的重要鉴别点。此外临床中观察到的药物相关性AACG通常是双眼同时发病,而原发性AACG双眼先后发病较常见[10]。
SIG的发病率因皮质类固醇的类型、剂量、给药频率、给药时间、给药途径而异[6]。皮质类固醇眼球局部给药诱发SIOH或SIG的概率要早于、高于全身给药[11]。SIG的临床特征与原发性开角型青光眼(primary open angle glaucoma,POAG)并无明显区别,但可能眼压水平明显很高,可在短时间内导致显著的视野损害[5],因此,在临床中SIG与POAG的鉴别诊断存在一定困难。皮质类固醇的全身或局部使用都可能导致SIG[5]。皮质类固醇的眼球局部给药途径包括滴眼、球结膜下注射、tenon囊下注射、前房注射、玻璃体腔注射、脉络膜上腔注射、球周注射以及球后注射等[12]。
玻璃体腔注射抗VEGF药物引起短暂性眼压升高较为常见,研究发现,66%~100%的患者在注射后立即出现眼压峰值,注射后15~30 min恢复到<30 mmHg,在注射后30~60 min恢复到接近基线水平[13]。
3 危险因素
药物相关性AACG的危险因素有:解剖因素、闭角型青光眼病史或家族史、远视、亚裔、女性,高龄、长期服用相关药物等[4,14],其中解剖高危因素包括浅前房、短眼轴、高褶虹膜、晶状体变厚、晶状体前移等[9]。临床中应用超声生物显微镜、前节光学相干断层扫描和眼部B超等检查可及时有效发现解剖高危因素[9],因此在使用可诱发AACG的药物之前对患者进行相关的眼科检查,对存在解剖高危因素的患者应慎用相关药物并全程监测。
SIG的主要危险因素包括皮质类固醇高反应者(使用皮质类固醇后一般眼压升高>10 mmHg且伴有临床表现[5])、POAG病史、年龄;其他危险因素有结缔组织疾病、高度近视、I型糖尿病和房角后退性青光眼等,但一般与性别和种族无关[15]。个体对皮质类固醇的反应性不同可能与皮质类固醇受体GRa和GRb表达差异有关。正常人中大约有4%~6%属于“皮质类固醇高反应者”,而这一比例在POAG患者中高达90%[5]。大部分情况下老年人和儿童在使用皮质类固醇后比年轻人更容易诱发SIG[16]。POAG病史也是玻璃体腔注射抗VEGF药后眼压升高的一个危险因素[17]。
4 发病机制
AACG的产生是由于各种机制导致短时间内房角部分甚至全部关闭,房水从小梁网外流途径受阻,最终导致眼压升高,引起视网膜神经纤维层和视神经不可逆损伤。药物相关性AACG使房角关闭的机制可分为瞳孔阻滞主型和晶状体-虹膜隔前移主型2类[9],详见图1。
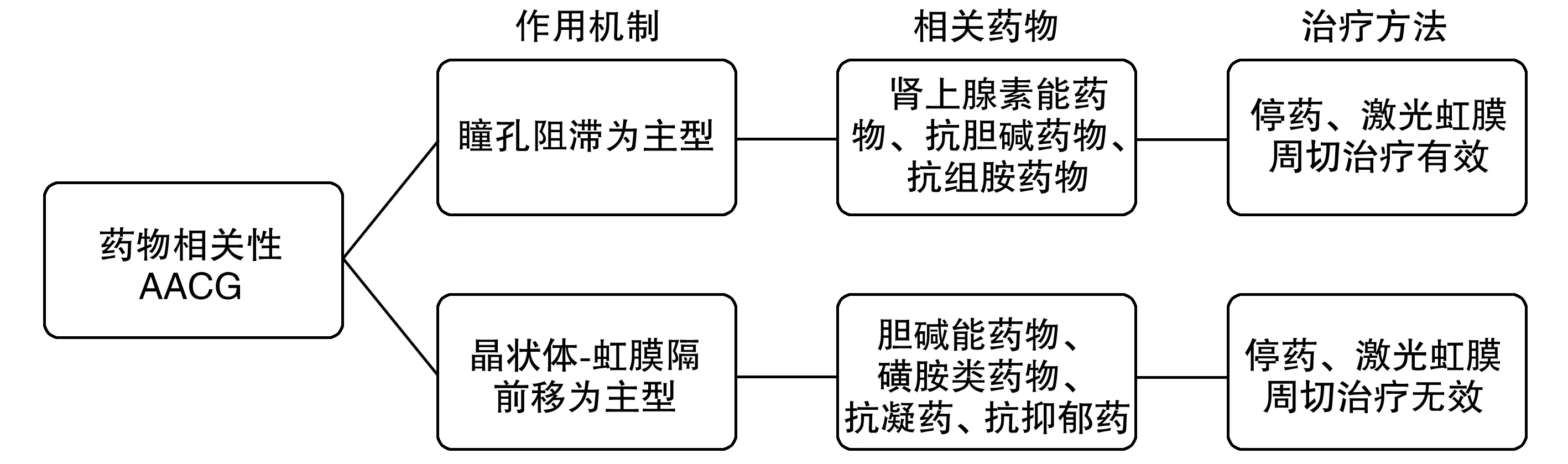
图1 药物相关性AACG主要作用机制、相关药物以及治疗方法
瞳孔阻滞为主型表现为瞳孔散大使虹膜更加靠近晶状体,房水无法进入前房而聚集在后房,前后房的房水平衡被打破,后房压力变高,周边虹膜堵塞小梁网,最终导致房角关闭。通过瞳孔阻滞机制诱发AACG的药物有肾上腺素能药物、抗胆碱能药物、抗组胺药物。肾上腺素能药物根据作用受体的不同亚型,分为α受体肾上腺素能药物和β受体肾上腺素能药物,α受体肾上腺素能药物可以散大瞳孔,β2受体肾上腺素能药物除了散大瞳孔外,还可以使房水生成变多。抗胆碱能药物除了可以散大瞳孔外,还可以使睫状肌麻痹。抗组胺药物由于具有一定的胆碱能作用,也可以产生散瞳作用。晶状体-虹膜隔前移为主型表现为睫状肌收缩、水肿、前旋,从而导致晶状体悬韧带松弛、晶状体变凸、房角关闭。胆碱能药物会引起睫状肌收缩,使晶状体-虹膜隔向前移位[16]。磺胺类药物可使睫状体脱离和睫状体水肿、前旋,使晶状体-虹膜隔向前移位,磺胺类药物诱发AACG的机制不包括瞳孔阻滞。抗凝药物会导致出血性脉络膜和视网膜脱离使晶状体-虹膜隔向前移位。抗抑郁药可通过虹膜括约肌松弛导致瞳孔散大、脉络膜积液导致晶状体-虹膜隔前移、房水分泌增加等多种机制诱发AACG[14]。
SIG发病机制的关键环节是皮质类固醇使房水从小梁网外流阻力增加导致眼压升高[18]。小梁网是房水外流的重要通道,小梁网细胞外基质的健康活跃状态是小梁网发挥正常功能的基础,皮质类固醇使小梁网细胞和小梁网细胞外基质发生改变,小梁网重塑,结构和功能发生异常[19]。皮质类固醇通过与细胞中的皮质类固醇受体结合调控基因表达,在分子水平上诱导小梁网细胞外基质沉积增加。皮质类固醇稳定溶酶体膜,抑制溶酶体酶的释放,使其对糖胺聚糖的降解减少,小梁网组织中糖胺聚糖沉积增加。皮质类固醇通过增加黏多糖的水结合能力和降低小梁网的吞噬活性,导致小梁网胶原链的肿胀,最终导致细胞碎片的堆积、流出通道的堵塞。
抗VEGF药物引起持续性眼压升高的机制尚不明确,可能是多因素的,与抗VEGF药物以及注射液中的其他成分对小梁网具有毒性作用、引起小梁网炎症反应、机械性阻塞小梁网以及反复注射引起小梁网损伤等有关[20]。多稀紫杉醇与紫杉醇诱发OAG的机制目前尚不清楚。
5 治疗预后
药物相关性AACG预防大于治疗。有高危因素的患者尽量避免使用可诱发AACG的药物。无论是何种机制诱发的药物相关性AACG,明确诊断后首先应该停止使用相关药物。对于瞳孔阻滞为主型的AACG,应该以缓解瞳孔阻滞和降低眼压为治疗目标,钇铝石榴子石晶体(yttrium aluminum garnet crystal,YAG)激光虹膜周切术可使后房房水通过激光孔进入前房,缓解瞳孔阻滞。降眼压治疗可全身使用乙酰唑胺、甘露醇和局部使用缩瞳剂、房水生成抑制剂等。对于晶状体-虹膜隔前移为主型的AACG不宜使用YAG激光虹膜周切术、缩瞳剂[14],而全身使用糖皮质激素、甘露醇和局部使用糖皮质激素滴眼液、房水生成抑制剂、睫状肌麻痹剂等有效。睫状肌麻痹剂可以松弛睫状肌,将晶状体-虹膜隔向后拉,打开房角,使房水引流增加。
临床医生在使用皮质类固醇时应该询问患者是否有POAG病史或者POAG家族遗传史,对于存在危险因素或需要长期大剂量使用皮质类固醇的患者应当告知相关并发症并及时密切监测眼压。眼压监测的频率取决于皮质类固醇的给药途径,对于行玻璃体腔内注射皮质类固醇的患者,要密切观测注射后患者的眼压变化[21]。皮质类固醇诱导的SIG在及时停药后尤其是使用时间在1年以内通常是可逆的。用非甾体类抗炎药替代皮质类固醇或者降低皮质类固醇的剂量可降低SIG发生的风险。对于使用皮质类固醇后出现的持续性SIOH,应该使用降眼压药物,对于药物控制不佳的高眼压,需要手术来降低眼压,微创青光眼手术可有效控制SIOH。具体手术方式包括激光小梁成形术、小梁切除术、小梁切开术、青光眼引流阀植入术、Schlemm管成形术等。
抗VEGF药物延长注射间隔、预防性使用降眼压药物、前房穿刺术可能会对预后有帮助,目前仍需进一步研究来证明[22]。
药物相关性青光眼具有明确的病因,预防意义大于治疗。可引起青光眼的药物种类繁多,临床医师都应警惕药物相关性青光眼的发生。当患者由于病情需要长期使用某种可引起青光眼的药物时,医师在患者用药前应提前告知相关风险,用药后密切关注患者反应,必要时让患者眼科门诊定期复查。
