基于组织连续切片后三维重建技术的研究进展
2023-11-10高芸王中群李丽华
高芸, 王中群, 李丽华
江苏大学附属医院 1.病理科, 2.心内科,江苏镇江 212001
医学影像学技术是人体组织结构重建的主要手段。利用微型CT对血管组织进行重建,但受限于仪器分辨率不足等因素,血管壁钙化斑块和细胞外基质的精细结构难以呈现[1]。依赖计算机优化算法能精准呈现影像技术,但由于所需运算量大,运算时间过长,反而限制了实际的临床应用[2]。随着计算机辅助人体组织连续切片(serial sections,SS)后三维重建技术的高速发展,不仅能精确展示人体组织复杂结构,并且可以多维度查看[3];通过与测量软件的结合应用,对重建的目标组织进行不同参数的测量,还可便于分析其空间结构[4]。本文综述基于计算机辅助组织连续切片后三维重建的研究进展,对其过程方法和应用进行了总结,旨在为其应用于临床提供理论基础。
1 三维重建前的组织切片准备
1.1 组织包埋
1.1.1 石蜡包埋法 组织标本在10%多聚甲醛溶液中固定24 h[5]。待标本固定完全后,依据需求切取合适部位,分成厚度约3 mm,面积约2 cm×1.5 cm的连续小块,区分近心端和远心端,按顺序标号,保证取材过程中切面的平整。所取标本组织放入包埋盒经脱水处理完毕后取出,按所标顺序将切面贴于装有液态石蜡的金属包埋盒底模并轻压组织防止出现气泡,待组织冷却凝固后进行切片。石蜡包埋法所做切片具有能够完整展现组织形态的优势,但因处理过程较长,石蜡浸入组织导致细胞形态发生改变,组织体积缩小,对后期进行特殊染色和完整结构重建的效果产生一定的影响[6]。
1.1.2 冷冻切片法 常规冷冻技术是将所取新鲜组织切取合适大小并用冷冻切片包埋剂完全包裹后,直接置于冷冻切片机中等待冷冻凝固后切片,亦可采用液氮直接冷冻标本。孙红星等[7]将液氮冷冻包埋技术分为液氮浸入法(快速冷冻)、液氮漂浮法(较慢冷冻)和直接-80 ℃法。对于骨骼肌适合采用液氮浸入法处理,而心肌和平滑肌则适合采用液氮漂浮法处理。用冷冻包埋方法所做的切片能更好地保持组织细胞抗原的活性,但对操作技术要求较高,处理方法受组织组成成分的影响较大[8];脂肪较多的组织,冷冻的时间有所增加;而较致密的组织冷冻时间则不宜过长[9]。冷冻切片虽不会对组织的体积和细胞的形状造成影响,但对于组织内微小结构的展示上有一定的缺陷[10]。
1.1.3 琼脂石蜡双包埋法 琼脂石蜡双包埋法是将所需组织切成合适的大小后,用配比好的琼脂液将其完全包裹后,再采用常规石蜡包埋法进行处理。宾业健等[11]对小鼠血管采用琼脂石蜡双包埋法处理,在切片中可以观察到完整的血管内膜,且管腔圆润不皱缩。Dahele等[12]将肺非小细胞肺癌的标本采用琼脂石蜡双包埋处理后连续切片重建了三维模型,发现此方法可以保证肺组织在切片时不会发生塌陷。琼脂石蜡双包埋法既保证了组织能够在切片上完整展现,又避免了组织因为脱水而产生的变形问题;但操作结果受琼脂含量影响较大,不同的组织处理时所需琼脂含量有所差异,过稀会产生组织脱水后变形,过于浓稠会导致组织脱水不完全发生垮塌等问题。
1.2 组织连续切片和切片染色
完整组织的连续切片是后续三维重建的基础,切片时需厚度一致,组织平整,连贯等距[4],避免摊片温度不合适导致组织不能完全摊开或散开过大,以及因为刀片缺损产生不必要的刀痕。
在切片厚度的选择上,常规石蜡切片的厚度一般为3~5 μm。吉佳乐等[13]对不同石蜡切片厚度进行相同的免疫标记,经对比,6、8 μm厚度的切片比2 μm厚度切片的非特异性染色多,且组织结构存在脱落的现象;而切片厚度为4 μm时,组织结构相对完整,背景干净更利于细胞计数。冷冻切片的厚度可稍大,一般为8~10 μm;当组织较致密时,切片厚度5 μm即可;对于脂肪含量较多的组织,可大于10 μm,以保证组织结构的完整[9]。对于较小、较干的组织,为防止脱片,宜选用胶片来保证切片完整[10]。
完整组织的三维重建要求染色清晰易区分,常规HE染色可满足基本的三维重建需求。除此之外,某些组织或结构可采用特殊的染色方法使其更清晰易识别;例如用CD31抗体染色显示斑块表面的内皮剥脱程度[14];α-action抗体染色可以显示动脉粥样硬化斑块富含平滑肌细胞[14];通过EVG染色对弹力纤维进行染色[15];通过茜素红S钙染色法或冯·科萨染色法,可以对组织中的钙化成分进行染色识别等[1]。
2 计算机辅助下的图片配准和重建
2.1 图片配准
图片配准是组织结构三维重建前的重要步骤。如果要使所构建的三维模型准确,需找到精准且高效的定位点,以保证相邻组织切片吻合连贯。配准采用的定位一般分为硬定位和软定位两种方法。
2.1.1 硬定位 指采用各种机械方法在组织连续的切片上标记参考点,通过连续的参考点对齐来达到定位效果。硬定位方法又分为内定位法和外定位法两种。内定位法是根据组织的解剖结构特点,在切片图像中寻找特定的定位结构进行定位,存在因生物组织结构形态复杂,导致定位误差较大的缺点。外定位法是在目标组织上作标记进行定位,通常利用细针、激光或微电极穿孔,再通过基孔的对齐来实现切片的对位[16]。
2.1.2 软定位 指依据生物组织的连续性和完整性,通过一定的配准算法和计算机软件的辅助实现两幅连续切片图像间的对齐[15]。
由于软定位法繁琐、耗时长,目前主要采用硬定位方法,基于定位误差考虑,又以外定位法最为常用。不同于以往直接用细针或是激光穿孔等常规手段,现一般将女性头发贴附于所取组织,一起用冷冻切片包埋剂包埋后冷冻切片,或将头发粘在针灸针末端,在周围脂肪组织内穿3~4根女性发丝,作为后期三维重建的定位标识[17]。高鸽等[18]认为,头发会在组织切片上留下明显刀痕,导致图片的完整性受到破坏,同时在染色的过程中容易发生脱片等现象;对此可采用在伊红染液中浸泡了24 h的苞米穗代替头发,以解决脱片和图片破坏的问题。
2.2 三维重建
染色完成的切片借助光学显微镜的观察适当描出组织边界,以便于后续采用高清扫描仪将完整切片图片导入计算机内[19]。将扫描完成的图片导入Adobe Photoshop软件内,以第1张切片图片为基准,通过预先设置的定位点,将其余图片依次导入、配准,调节图片透明度为50%~60%。连续切片配准完成后,导入三维重建软件进行三维重建[16]。
3 应用和展望
目前,国内外很多学者已将组织连续切片三维重建技术运用在实践中。现有研究在HE染色下进行组织三维重建的基础上,开始结合免疫组化、免疫荧光等技术,进一步完善和优化组织三维重建技术,探索和拓展其在临床诊断与疾病治疗等方面的应用。
基于组织连续切片的三维重建技术,由于其准确性和易于观测等特点,在组织的结构性研究上有着显著的优势。熊波等[17]发现,高血压犬肾动脉近端的肾交感神经数量较非高血压犬显著增多;Enderle等[20]结果表明,肿瘤芽主要与病变的主要肿块有关,并阐明了肿瘤间的异质性;Kuwajima等[21]研究不仅揭示了突触结构之间的连接,还检测到多泡小体分布的变化以及刺突等高度复杂的神经纤维成分的结构变化。三维重建技术不仅仅局限于组织病理学,王博等[22]针对细胞进行了连续切片后的三维重建,可以更全面、客观地展示细胞内的超微结构。
通过结合免疫组化、免疫荧光等技术,基于组织连续切片的三维重建技术在肿瘤组织的研究应用方面更为广泛和深入。钱立宇等[23]通过对乳腺癌的前哨淋巴结(sentinel lymph node,SLN)进行连续切片后三维重建,发现可以增加SLN微转移的检出率;Yagi等[24]发现,肿瘤细胞通过肺泡中的空气传播并且对附着的血管具有选择性。在Fujisawa等[25]的研究中,通过实验对比提出了组织连续切片的适宜厚度,同时也针对不同免疫组化标记对配准的影响提出了相关建议,例如Ki67对细胞核的免疫标记不适宜作为配准的参照,并在一系列对比实验的基础上对乳腺肿瘤的血管、被癌细胞包裹的脑血管以及混合性纤维瘤的主要血管分别进行了免疫标记后的三维重建;Wang等[26]证明了全层组织连续切片后三维重建是研究肿瘤的侵袭模式和对切缘评估的最理想方式。Ueda等[27]发现,组织三维重建技术更有助于了解肿瘤表面的微结构和微血管。
基于组织连续切片的三维重建技术可广泛应用于各类组织中[4-5,28-33]。相较于传统医学影像学技术,基于组织连续切片的三维重建技术在揭示血管结构、探究血管病变机理等方面可以提供更准确与精细的结果(表1)。
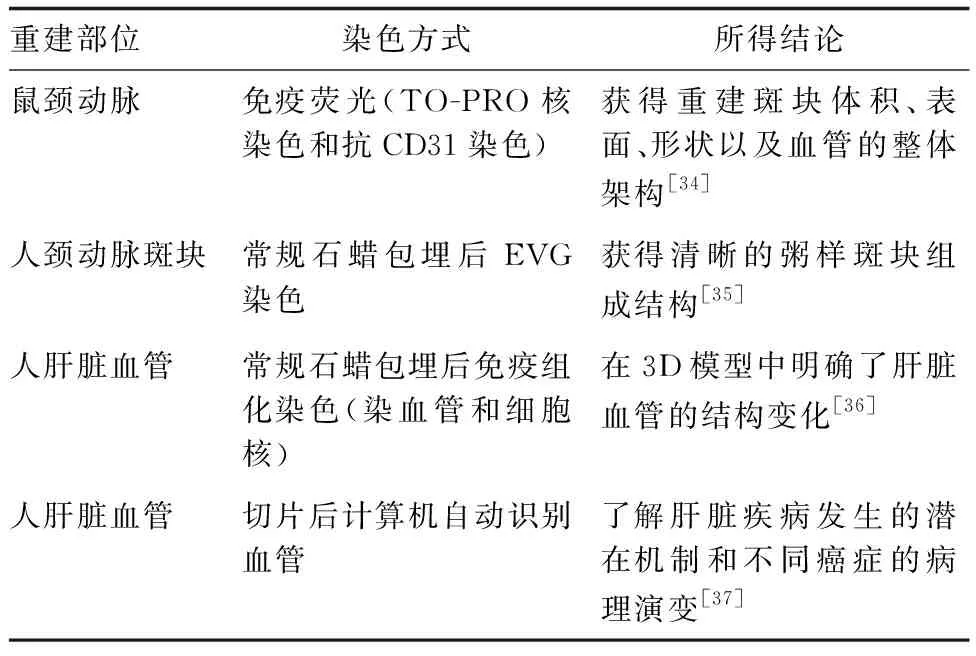
表1 部分血管三维重建技术的应用
4 结 语
基于组织连续切片的三维重建技术所得到的组织结构,可以清晰、准确、完整地呈现各部位细节结构。尽管该技术存在操作复杂、大量重复性工作等弊端,但并不影响其为病理组织复杂的结构提供了真实还原的解剖结构基础,因此,基于组织连续切片后三维重建技术成为医务工作者及相关研究人员理解病理组织的强有力的工具,也为基础科学和临床科学的学生提供了一种高效的学习工具。组织三维重建技术的发展与进步为未来3D生物打印技术的实用化提供了最重要的理论基础,为人类保障健康,延续生命带来新的希望。
