阿司匹林PEAR1、GP1BA基因表型与血栓弹力图吻合度研究
2023-11-10钟德胜刘永健王灿茂梁伟丹杨青锦李楚云
钟德胜 刘永健 王灿茂 梁伟丹 杨青锦 李楚云
1 惠州市中心人民医院 广东惠州 516001;2 南方科技大学医院 广东深圳 518000; 3 广东医科大学药学院 广东东莞 523000
脑卒中是危害国民健康的重大疾病之一,具有高发病率、高致残率、高死亡率及高复发率的特点[1]。脑卒中主要分为缺血性脑卒中(脑梗死)和出血性脑卒中(脑出血),其中缺血性脑卒中约占70%[2]。根据2017年发表的Ness-China中国脑卒中流行病学调查研究,我国卒中发病率为345.1/10万人年,死亡率为159.2/10万人年,患病率为1 596.0/10万人年[3];全球疾病负担数据显示:2016年我国缺血性脑卒中发病率为276.75/10万[4]。2018年,中国居民脑血管病死亡率为149/10万(死亡人数约157万),较1990年上升41%[5],分别为城市居民的第3位死因和农村居民的第2位死因。卒中出院人数及人均医药费用同样呈持续增长趋势,2017年我国缺血性卒中和出血性卒中患者人均住院费用分别为9 607元和18 525元,与2007年相比分别增长了60%和118%[6-7]。因此,目前国内卒中防治的形势仍非常严峻,合理、有效地防治卒中显得尤为重要。
国内外指南[8-11]均推荐急性缺血性卒中(acute ischemic stroke,AIS)使用抗板药物治疗,常用的三种抗血小板治疗药物是阿司匹林、氯吡格雷和双嘧达莫,目前也有研究[12-14]和指南[11,15]提及替格瑞洛,该药已被美国食品药品监督管理局(food and drug administration,FDA)批准用于缺血性卒中的治疗,但在国内暂时属于超说明书用药。
阿司匹林已经使用了100多年,是临床应用的第一个抗板药,常用于脑梗死的治疗[16]。然而在我国复发性卒中及心脑血管疾病研究中,阿司匹林抵抗率、半抵抗率和敏感率分别为20.4%、4.4%和75.2%[17]。随着药物基因检测技术的发展,越来越多的研究集中于探讨遗传因素与阿司匹林反应的相关性[18]。目前很多医疗机构已经开展阿司匹林相关基因检测,在《基于药物基因组学的抗血小板药物个体化药学服务指引》中,推荐阿司匹林相关基因检测位点为GP1BA和PEAR1[19]。
血栓弹力图(thromboela-stogram,TEG)通过测定血凝块的黏度及弹性变化曲线,判断血凝情况并分析成因,提供有关血小板功能和聚集的信息,以及血小板功能影响药物作用的信息,是常用的血小板功能检测方法[20-22]。花生四烯酸(AA)途径诱导的血小板抑制率(AA抑制率,AA%)是血栓弹力图的重要参数,与阿司匹林的血小板抑制活性密切相关[23]。
本文通过回顾性研究,评估惠州地区阿司匹林GP1BA、PEAR1基因多态性分布特征,进一步探讨基因表型与血栓弹力图结果的吻合度,为脑梗死患者的抗血小板治疗提供个体化给药的理论依据。
1 资料与方法
1.1 临床资料
研究采用回顾性研究法。选取我院神经内科2022年1月—2022年12月期间,临床诊断为缺血性卒中的住院患者。纳入标准:汉族,籍贯为广东省惠州市,急性卒中治疗Org10172试验(trial of org10172 in acute stroke treatment,TOAST)分型为大动脉粥样硬化型,使用阿司匹林抗血小板治疗,进行阿司匹林GP1BA、PEAR1基因表型检测。排除标准:①未行阿司匹林GP1BA、PEAR1基因表型检测;②非动脉粥样硬化型脑卒中,如:TOAST分型中的心源性栓塞、其他原因型脑梗死和不明原因型脑梗死;③排除以下神经系统疾病:脑出血、脑血管畸形、肿瘤、非椎-基底动脉梗死引起眩晕以及非脑血管疾病;④对阿司匹林过敏;⑤有活动性出血和出血倾向的具抗血小板治疗禁忌症的;⑥严重肝肾功能损害的(丙氨酸氨基转移酶≥3倍正常值、血肌酐≥177 μmol/L)。本研究共纳入612例患者;平均年龄(64.04±12.21)岁,其中男性386例,平均年龄(62.41±11.94)岁,女性226例,平均年龄(66.84±12.18)岁。其中112例患者在治疗过程中使用血栓弹力图进行检查。
1.2 检测方法
1.2.1 阿司匹林PEAR1、GP1BA基因分型检测
采用Fascan 48S多通道荧光定量分析仪,地高辛染色液作为荧光染色原位杂交试剂,标本类型为含乙二胺四乙酸(EDTA)抗凝的静脉血,对阿司匹林用药相关基因检测,检查项目代码为482C>T、782G>A。
1.2.2 TEG检测
至少连续服用药物(阿司匹林100 mg qd)2天后[24-25],根据血栓弹力图分析仪(TEG®5000分析仪系统,HAEMONETICS公司)检测AA%。效果良好:AA%超过75%;有效:50%~74%;无效:<50%。
1.3 统计学方法
2 结果
2.1 阿司匹林基因分型检出情况
通过对612例缺血性脑卒中患者的阿司匹林PEAR1、GP1BA基因多态化检测结果进行回顾性分析。由图1可发现,GP1BA基因CC型基因频率高达91.99%,据相关研究显示,CC型相对于TT型,阿司匹林抵抗风险显著增加;PEAR1基因中,AA:GA:GG=2 ∶5 ∶3。

图1 阿司匹林GP1BA、PEAR1基因分型检出情况(%)
2.2 性别与阿司匹林基因表型的关系
基于药物基因组学的抗血小板药物个体化药学服务指引的推荐,根据阿司匹林GP1BA、PEAR1基因多态性检测结果将表型分为低应答、中间应答、高应答,具体见下表:
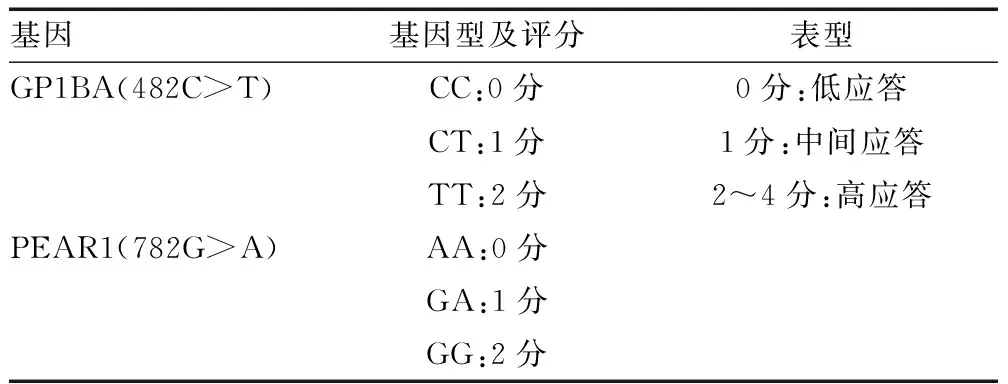
表1 GP1BA、PEAR1 基因型检测结果表型
由于纳入的患者中男女数目不同,为了探讨性别是否对阿司匹林基因表型有影响,通过2检验对三组基因表型与性别进行相关性分析,见表2。结果显示男性在高、中间、低应答组的占比分别为:62.87%、60.34%和68.33%,女性在高、中间、低应答组的占比分别为:37.13%、39.66%和31.67%,统计显示不同性别对阿司匹林基因表型无影响(P=0.314)。在612例患者中,阿司匹林高应答占比仅为33.01%,近七成的患者存在应答下降(中间/低应答)的情况,特别需要注意的是低应答的患者占比也达到了19.61%,见图2。

表2 性别与阿司匹林GP1BA、PEAR1基因表型的关系 [n(%)]
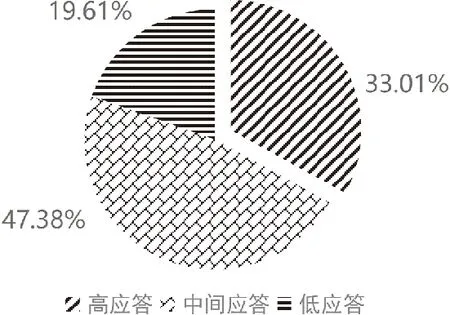
图2 阿司匹林基因表型占比情况(%)
2.3 TEG检测结果与阿司匹林基因表型吻合度分析
612例患者中有112例患者在至少连续使用阿司匹林2天后行TEG检测,根据TEG检测结果仅13.39%的患者使用阿司匹林无效,效果良好的患者占比高达71.43%,具体结果如表3所示。根据阿司匹林PEAR1、GP1BA基因检测结果,112例行TEG检测的患者中仅33.93%的患者对阿司匹林高应答,中间应答及低应答占比66.07%,具体见图3。

表3 血小板抑制率(AA%)分布情况

图3 TEG检测患者阿司匹林PEAR1、GP1BA基因表型占比(%)
由表3、图3可以发现,TEG检测结果与基因表型结果吻合度较差,换言之,基因表型结果不能很好地反映患者对阿司匹林实际的抗血小板效果。
为了进一步分析基因表型和TEG检测结果的关系,我们对不同基因表型发生阿司匹林抵抗(AR)风险(即AA%<50%)是否存在差异做亚组分析,设阿司匹林高应答型为A组,中间应答型为B组,低应答型为C组。
比较三组阿司匹林抵抗发生率X2=6.70,P=0.035,差异具有显著性(P<0.05);两两比较,A组与B组X2=2.71,aP=0.10,差异没有显著性(aP>0.05);B组与C组X2=2.26,bP=0.13,差异没有显著性(bP>0.05);A组与C组X2=5.34,cP=0.021,C组的阿司匹林抵抗发生率较低,差异具有显著性(cP<0.05);从AA抑制率我们亦可发现,阿司匹林低应答组的AA抑制率高于中应答组及高应答组,有显著性差异(P<0.001);两两比较,A组 VS B组,差异具有显著性(P=0.003);B组 VS C组,差异具有显著性(P=0.003);A组 VS C组,差异具有显著性(P<0.001),具体见表4。上述结果表明,阿司匹林PEAR1、GP1BA基因表型与TEG检测结果吻合性差,且呈相反趋势。

表4 不同阿司匹林基因表型AR发生率 (n/%)
3 讨论
阿司匹林主要通过抑制环氧合酶阻碍前列腺素的合成,从而影响血栓素发挥抗血小板聚集作用,能够有效降低卒中复发风险,是缺血性卒中二级预防的首选药物。然而在我国复发性卒中及心脑血管疾病研究中,阿司匹林抵抗率、半抵抗率和敏感率分别为20.4%、4.4%和75.2%[17]。随着药物基因检测技术的发展,越来越多的研究集中探讨遗传因素与阿司匹林反应的相关性[18]。药物相关基因的分子检测是实施个体化药物治疗的前提,目前与阿司匹林药效或不良反应相关的基因有GP1BA、CYP2C19、HLA-DPB1、PTGS1、LTC4S等,在基于药物基因组学的抗血小板药物个体化药学服务指引中,推荐阿司匹林相关基因检测位点有 GP1BA和PEAR1[19]。GP1BA的证据级别为2B,Matsubara Y等[26]报道GP1BA基因多态性与患者对阿司匹林敏感性有关,CC型相比于TT型,阿司匹林抵抗风险显著增加;但马丹丹[16]的研究表明,GP1BA基因多态性与阿司匹林抵抗无相关性。
此外,在中国人群中,石秀锦等[27]报道PEAR1的基因多态性与血小板的聚集相关;申利娜等[28]研究发现PEAR1基因纯合突变增加缺血性脑卒中复发的风险;Nie等[29]报道在中国急性冠脉综合征(ACS)患者中,PEAR1等位基因的携带者缺血事件风险增加,因此PEAR1基因多态性将会导致阿司匹林抗血小板治疗效果出现显著的个体化差异。不同种族、不同地区、使用不同的血小板功能检测方法导致报道的阿司匹林抵抗的发生率波动范围较大。
本文通过回顾分析发现惠州地区阿司匹林GP1BA基因CC型基因频率非常高,达91.99%,与既往研究[30]仅5.6%的基因频率存在明显差异;而在PEAR1基因中,AA ∶GA ∶GG=2 ∶ 5 ∶3,基因频率与性别无明显相关性,与既往文献报道一致。由表2、图2可知,惠州地区人群中阿司匹林发生抵抗的风险较高,高应答占比仅为33.01%,近七成的患者存在应答下降的情况,这与既往的研究数据(阿司匹林抵抗率、半抵抗率和敏感率分别为 20.4%、4.4%和 75.2%)存在明显的差异[17]。对112例既行阿司匹林PEAR1、GP1BA基因检测,又行TEG检测的患者进行亚组分析,仅13.39%的患者使用阿司匹林无效,效果良好的患者占比高达71.43%(见表3),这与基因表型结果(仅33.93%高应答)严重不吻合,也就是说阿司匹林PEAR1、GP1BA基因表型并不能反映其实际的抗血小板活性。为了进一步分析基因表型和TEG检测结果的关系,我们对不同基因表型发生阿司匹林抵抗(AR)风险是否存在差异做亚组分析发现,AR发生率从高到低依次为高应答组、中应答组、低应答组,从AA抑制率平均值亦可发现高应答组的抑制率最低,其次是中应答组,最高的是低应答组,具有显著性差异(P<0.001)。
综上所述,阿司匹林PEAR1、GP1BA基因检测可能不适用于惠州地区患者,因其并不能充分反映阿司匹林的抗血小板活性,需寻求更为相关的基因进行检测,以指导阿司匹林个体化治疗。本研究具有一定的局限性,例如TEG检测结果受众多因素影响,再者缺乏脑梗死患者预后数据。
