等离子体技术资源化转化CO2研究进展
2023-11-09焦志杰赵文霞郭萧蒙周泽昊
焦志杰,赵文霞,郭萧蒙,周泽昊
(河北科技大学环境科学与工程学院,河北石家庄 050018)
CO2过度排放导致的气候问题引起全球关注。据国际能源署的统计数据,2019年全球CO2排放量增至30×106t,达到了历史最高水平[1]。碳捕集与封存(CCS)被认为是减少CO2排放的重要手段[2],然而该技术不涉及碳的利用,缺乏经济效益,因此增加了碳利用环节的碳捕集、利用与封存(CCUS)在国际上受到普遍认同。然而,每年被捕获并用于合成燃料的CO2只有3×103t,仅占CO2排放量的0.1%[1],CO2资源化利用成为亟待解决的全球性问题。其中,将CO2转化为高附加值化学品(HCHO,CH3OH等)或燃/原料(如CO,CH4)是资源化利用的一个重要途径。


图1 等离子体反应器转化CO2的效果对比图[4,13-26]Fig.1 Comparison diagram of CO2 conversion effect in plasma reactor[4,13-26]
本文基于广泛的国内外文献调研,针对单一等离子体转化CO2研究,重点介绍该技术的主要工艺参数和性能评价指标,以及活性物种和背景气体对CO2转化效果的影响方面的研究成果,围绕DBD等离子体协同催化转化CO2的研究,重点综述等离子体与催化材料两者之间的协同作用机理及行为,最后针对等离子体协同催化转化CO2研究目前面临的问题与挑战,对今后的重点研究方向进行展望。
1 单一等离子体转化CO2研究
1.1 等离子体转化CO2的主要工艺参数和性能评价指标
等离子体转化CO2的主要工艺参数有放电功率(P)、进料流量(q)、放电电压(U)、放电频率(f)等,间隙宽度(dg)、介质层厚度(dT)、放电长度(L)等结构参数也会影响CO2转化效果。U和q由示波器和流量计直接测得,而P则需要通过Q-U利萨茹图(见图2)计算得到。此外,比能量密度(SEI)被认为是影响CO2转化性能的重要参数,SEI定义如式(1)所示[30]。
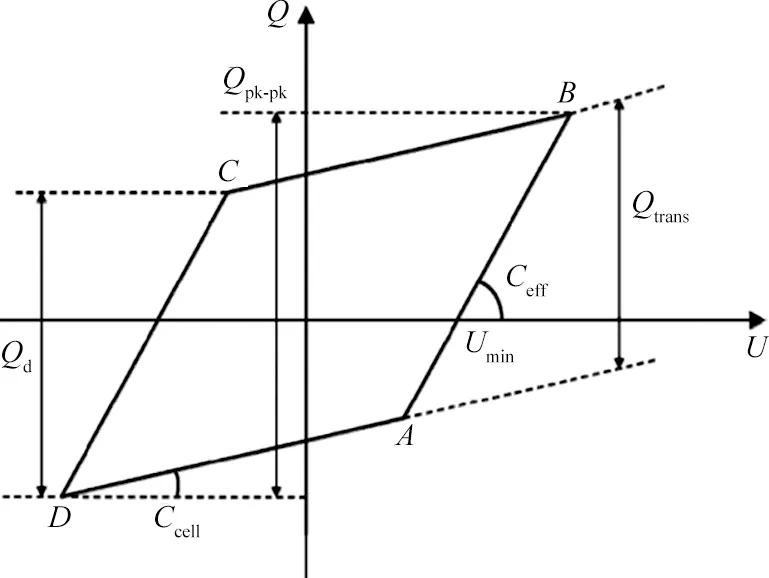
图2 典型DBD等离子体利萨茹图[31]Fig.2 Typical DBD plasma Lissajou diagram[31]
(1)
式中:P和q的单位分别为kW和L/s。往往P,q和SEI是最需要考虑的3个参数。
等离子体转化CO2的性能评价指标包括CO2转化率(η)和能量效率(E),计算方法见式(2)—式(4)[30,32-33],式中:M为CO2摩尔流率,mmol/s,焓变不确定时,E用式(3)计算,焓变确定时,E用式(4)计算,例如确定反应器中发生了反应(见式(F1))[34],则式(4)的ΔH=283 kJ/mol。
(2)
(3)
(4)
(F1)
进料流量不同,气体在反应器内的停留时间也不同,从而影响CO2的转化。如图3所示,在一定电压下,CO2转化率随流量增加先增加再降低,而能量效率则随流量增加而增加,最后趋于稳定[35]。多项研究表明,进料流量过高,气体停留时间短,会导致CO2转化不充分;进料流量过低,气体停留时间长,容易造成CO与O再次复合为CO2[14,16,36]。当功率一定时,进料流量与转化率的乘积几乎不变,说明CO2的分解量与导电电荷量成正比例关系,增加放电功率使导电电荷增加,从而增加了转化率;CO2流量改变,而导电电荷数量不变,CO2的转化率没有明显变化[37]。综上,不同操作条件所对应的最佳流量也应不同。

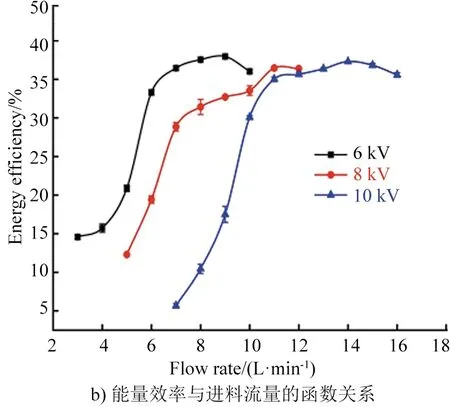
图3 CO2转化率、能量效率与进料流量的函数关系[35]Fig.3 Functional relationship between CO2 conversion rate, energy efficiency and feed flow rate[35]
固定进料流量、改变放电功率和固定功率、改变进料流量2种方法均可产生不同的SEI。图4显示用上述2种方法将SEI从24 kJ/L增加到120 kJ/L时,CO2转化率分别提高了28.7%和77.8%,由此表明改变进料流量控制SEI对CO2转化率的影响比改变放电功率更明显。CO2转化率不会一直随SEI的增加而增加,图5显示,SEI>3.5 kJ/L时,CO2转化率会随SEI的增加而降低。在不同SEI条件下的放电行为对CO2转化效果的影响机制还不明确,仍需进一步研究。
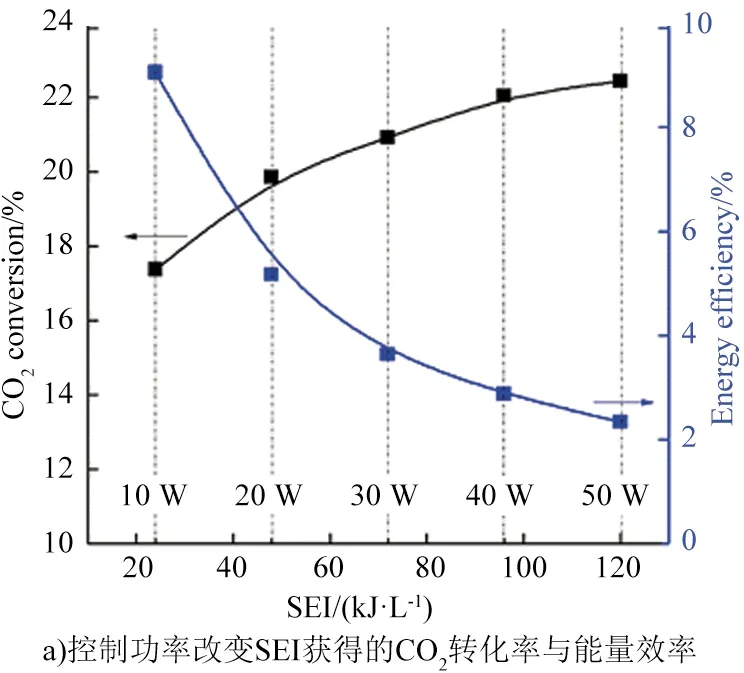

图4 控制功率、CO2流量改变SEI获得的CO2转化率与能量效率[14]Fig.4 Control power and CO2 flow to change the CO2 conversion rate and energy efficiency obtained by SEI[14]

图5 CO2转化率和能量效率与CO2流量和SEI的关系[16]Fig.5 Relationship between CO2 conversion rate and energy efficiency with CO2 and SEI[16]
回归模型(式(5)、式(6))结合实验数据比较了DBD反应器的各个工艺参数的改变对评价指标的重要性[14],结果如式(7)和式(8)所示,对CO2转化率的重要性遵循q~P>dg>L>dT>f,对能量效率的重要性遵循P>q>dg>dT>L>f。
η=K1[f]a1[P]b1[q]c1[l]d1[dg]e1[dT]f1,
(5)
E=K2[f]a2[P]b2[q]c2[l]d2[dg]e2[dT]f2,
(6)
η=34.340 1×[f]-0.044 8[P]0.163 4[q]-0.383 9[L]-0.252 7[dg]-0.699 9[dT]-0.359 3,
(7)
E=6.487 6×[f]-0.041 5[P]0.836 7[q]0.615 8[L]0.253 1[dg]-0.700 4[dT]-0.360 5。
(8)
基于之前的研究,CO2转化率与能量效率无法同时达到最大值。于是MEI等[22]建立了回归模型(见式(9))描述了CO2转化率和能效与放电功率、气体流量、放电长度3个参数之间的响应关系,Y1(CO2转化率响应值)和Y2(能量效率响应值)计算结果如式(10)和式(11)所示,并引入全局期望参数D和Y1的期望值d1,Y2的期望值d2(见式(12))来评价不同工艺参数时等离子体转化CO2的性能,在该研究中,工艺性能的最高评价为D=0.816,对应的放电功率为15.8 W,气体流量41.9 mL/min,放电长度15 cm,CO2转化率14.3%,能量效率0.285 mmol/kJ。
(9)
Y1=-8.846+1.584X1-0.125X2+0.092X3+1.575×10-3X1X2-2.078×10-3X1X3+
(10)
Y2=-0.207+0.017X1-2.758×10-3X2+2.156×10-3X3+5.556×10-6X1X2-1.431×
(11)
(12)
1.2 活性物质对等离子体转化CO2反应的影响
等离子体转化CO2反应体系中的活性物种的种类与数量决定了CO2的反应途径,进而影响CO2的转化率和能量效率。CO2气体转化为等离子体的过程中一般存在5种基本粒子:电子、光子、中性粒子、激发态CO2分子、离子[38]。中性粒子、激发态CO2分子和离子的主要组成见表1。

表1 CO2等离子体中包含的主要粒子[38]Tab.1 Main particles contained in CO2 plasma[38]
电子一部分来自金属阳极表面的电子逸出,另一部分来自于电子与其他粒子的碰撞解离。根据汤逊放电理论,气体的汤逊系数α越大越容易电离产生新的电子。电子是等离子体中最原始的活性物质,其他活性物质的产生需要的能量来自于高能电子和其他粒子的碰撞。电子的能量分布直接影响化学反应路径,进而影响了其他活性物质的数量和CO2的转化率。FRIDMAN等[39]指出电子能量为1~2 eV时,约97%的电子能量被用于CO2的振动激发(见式(F2)),电子能量达到2~3 eV时,仅12%的电子能量转移到CO2的振动激发态,79%的电子能量用于CO2的电子激发(见式(F3))。电子的能量分布受约化电场强度的影响(见图6 a)),约化电场强度增强,高能电子比例也会增加。图6 b)为不同强度的约化电场激发态CO2种类的变化,说明电子的能量会改变化学反应的路径[40]。

图6 不同约化电场的电子分布函数与活性粒子浓度[40-41]Fig.6 Electron distribution functions and active particle concentrations of different reduced electric fields[40-41]
e-+CO2→e-+CO2(v),
(F2)
e-+CO2→e-+CO2(*)。
(F3)
等离子体过程中CO2的激发分为振动激发(见式(F2))和电子激发(见式(F3)),2种过程均由电子与CO2分子的碰撞引起。在热等离子体中(气体温度>3 000 K),电子碰撞产生的内能足以达到CO2的热解阈值,而在非热等离子体体系中,1~2 eV的电子与CO2碰撞容易产生大量低振动能级CO2激发态[42]。根据振动方向的不同,CO2(v)可以分为3种模式[43]:1)C原子静止,2个O原子同时向C原子靠近或远离(见图7 a));2)C原子和一个O原子静止,另一个O原子向C原子靠近或远离(见图7 b));3)2个O原子相对静止,C原子在垂直方向上移动(见图7 c))。综上所述,CO2(v)为C—O键变形的CO2,根据激发获得能量的不同又可分为CO2(v1)(010),CO2(v2)(100,020),CO2(v3)(001),CO2(v4)(n00,0n0)[38]。

图7 CO2的3种振动模式[43]Fig.7 Three vibration modes of CO2[43]
当2~3 eV的电子与CO2分子碰撞时,电子动能大于CO2的激发能,导致电子跃迁到能量更高的能级,因此该过程产生的是CO2(*)而不是CO2(v)(见式(F3))。CO2(v)和CO2(*)可以引起一系列后续反应(见式(F4)—式(F9)[38])。振动激发引起的CO2分解称为CO2的碰撞解离(式(F2)+式(F7)),电子激发引起的CO2分解称为CO2的电离(式(F3)+式(F9))[44]。研究表明,CO2的碰撞离解是在等离子体中最有效的CO2转化途径,理论上可超过60%的能量效率。因此,在电场强度不变的情况下如果能提高低能量电子的比例,产生更多CO2(v),就能得到更高的能量效率。
e-+CO2(vi)→e-+CO2(vi+1),
(F4)
(F5)
e-+CO2(vi)→e-+CO2(*),
(F6)
e-+CO2(v)→e-+CO+O,
(F7)
e-+CO2(v)→e-+CO+O-,
(F8)
e-+CO2(*)→e-+CO+O。
(F9)
除CO2分子外,其他的离子和中性粒子由电子与CO2粒子的碰撞产生(见式(F5),式(F7)—式(F9)),这些离子和中性粒子又可以作为活性物质引起其他化学反应(见式(F10)—式(F12)[45-47]),其中既有使CO2进一步分解的反应,也有粒子复合重新形成CO2的反应。在反应器中引入其他物质抑制CO2的复合将有利于CO2的转化性能。
e-+O→2e-+O+,
(F10)
(F11)
O-+CO→e-+CO2。
(F12)
1.3 背景气体对等离子体CO2转化效果的影响
纯CO2气体在特定强度的约化电场中有固定的击穿电压值,受到气体组分种类、比例的影响,CO2和其他气体组成的混合气体在电场中的击穿现象不同。DBD反应器处理纯CO2气体得到了18%的CO2转化率,而处理N2∶CO2=9∶1的混合气体时,CO2转化率提升到了35.8%[48]。零级化学动力学模型[49]模拟微波等离子体中N2/CO2混合气体的化学反应过程的结果表明,低浓度N2(小于50%)稀释不利于CO2的转化,高浓度(高于50%)N2稀释后才能提升CO2的转化率,这与滑动弧等离子体[50]处理N2/CO2混合气体试验观察到的结果一致。随着N2所占比例的增加,N2/CO2混合气体的产物中含氮化合物的种类和浓度发生了变化,因此N2所占比例改变了等离子体过程的反应路径。此外,N2稀释增加CO2转化率的同时也会导致能量效率降低[51]。DBD反应器[52]处理纯CO2气体、Ar/CO2混合气体、N2/CO2混合气体的结果显示,混合气体的转化率均高于纯CO2气体,发现混合气体的击穿电压均低于纯CO2气体,等离子体法处理He(95%)/CO2(5%)混合气体的结果表明了低击穿电压的混合气体的CO2转化率高于纯CO2气体[53]。综上,引入其他气体后反应路径和击穿电压的改变提升了CO2转化率,更多种类的CO2混合气体对CO2转化影响还有待研究。
2 等离子体协同催化转化CO2研究
等离子体协同催化转化CO2具有良好的前景,DBD反应器与催化材料的耦合具有独特优势,以下主要介绍DBD驱动下催化材料的协同效应等方面的研究进展。
2.1 等离子体对催化材料活化性能的影响
引入BaTiO3的同轴DBD反应器CO2转化率和能量效率比无BaTiO3的反应器增强了75%[54]。放电产生的紫外线辐射较弱,难以激活光催化剂[37,55],而CO2放电产生的高能电子可以碰撞BaTiO3表面产生电子-空穴对,形成含氧空位(VO)的催化材料,激发光催化反应(见式(F13)[28]),促进CO2转化。TiO2也能被激发光催化反应,由于禁带宽度不同,BaTiO3和TiO2的激活可分别用式(F14)和式(F15)表示[28]。在光催化反应中,电子和空穴的复合限制了反应进行,而在等离子体装置的电场作用下,电子-空穴对的复合速率变慢,式(F13)反应的时间变长,进一步促进了CO2的转化。
CO2+[催化剂+VO]→CO+[催化剂],
(F13)
BaTiO3+e-(>3.0 eV)→e-+h+,
(F14)
TiO2+e-(>3.2 eV)→e-+h+。
(F15)
g-C3N4也可由高能电子碰撞产生电子和空穴,然后通过高压电场有效分离,DBD反应器结合g-C3N4催化转化CO2,转化率比单一DBD反应器提升了47%[56]。g-C3N4具有半导体性质,高能电子可以碰撞进入g-C3N4的导带,电子与进入的高能电子都参与了g-C3N4表面的CO2转化过程[57],等离子体/g-C3N4催化剂混合系统中的CO2分解过程如图8所示。
TiO2的光催化效应来源于Ti4+与Ti3+互相转化的过程中产生的VO,CeO2在热环境中可发生Ce4+和Ce3+的互相转化产生VO,因此CeO2在热反应中表现出了良好的CO2分解活性[58]。等离子体温度一般足以激活热催化效应,基于该原理,将Fe2O3/CeO2负载于Al2O3上结合DBD反应器催化转化CO2[25],当只有Fe2O3时,CO2转化率为13.3%,当c(Fe)∶c(Ce)为1∶1时,CO2转化率提升到了25.4%,CO2转化效果的提升是加入CeO2后VO数量增加的结果,等离子体结合Fe2O3/CeO2催化转化CO2机制如图9所示,在等离子体的作用下氧从晶体中除去形成VO(见图9 a)),吸附在催化剂表面的CO2受到电子的碰撞后双键断裂(见图9 b)),形成CO和O,之后CO分子从催化剂表面解吸,O填补催化剂表面的空位(见图9 c)和图9 d)),等离子体中的氧原子可以与催化剂表面的氧原子重新结合,形成从表面吸附的O2分子,从而改造VO(见图9 e))。

图9 CO2在催化剂表面的解离机制[25]Fig.9 Dissociation mechanism of CO2 on the surface of catalysts[25]
2.2 催化材料对等离子体行为与物种的影响
催化剂放置于等离子体电场中相当于在电极空隙插入了其他介质,引入BaTiO3的反应器等效模型如图10所示[54]。等离子体放电由丝状放电转化为丝状放电与沿面放电的结合,放电行为的改变必然会对CO2的转化效果产生影响。研究发现BaTiO3的引入引起了转移电荷的增加,并且增强平均电场和平均电子能量,促进了CO2的转化。通过对无填充、填充玻璃珠、填充BaTiO3的DBD反应器中电场强度的对比(见图11)[54],推测放电增强效果与介电常数相关。分别将TiO2(介电常数85)和BaTiO3(介电常数1 000)填入到反应器中进行等离子体反应,后者较前者的电场强度和电子能均高出1.9%[28]。另一研究表明材料介电常数从10增加到1 000时,平均电场强度增加了1.4倍[59]。介电常数的增加会使部分沿面放电进一步演变为更多的局部丝状放电,局部丝状放电引起的能量增加又进一步促进了CO2分解[60]。填入高介电常数的钛锆酸铅(PZT)的平板DBD反应器[61]CO2转化效果比填入BaTiO3的DBD反应器提升了43%。电子能量分布函数显示填充了PZT的反应器中高能电子的密度大。经计算,平均电子能量为8.2 eV的反应器转化效果优于平均电子能量为7.4 eV的反应器,所以CO2分子与高能电子的相互作用通过导致CO*物种形成的中间反应有效促进了CO2分解,见式(F16)和式(F17)。

图10 放电气体间隙加入催化剂后的等效模型[54]Fig.10 Equivalent model of adding catalysts to the discharge gas gap[54]

图11 不同放电功率下填充材料对平均电场强度的影响[54]Fig.11 Effect of filler materials on the average electric filed strength under different discharge power[54]
(F16)
CO2+e-(high energy)→CO(*)+O+e-。
(F17)
将材料引入到大放电间隙中能够更好地提升CO2转化效果[62],结合图10,可推测催化材料的尺寸也会影响等离子体的放电行为。填料珠的直径应至少为间隙大小的1/3,才能提高CO2的转化率和能量效率[63]。不同粒径的催化材料(1.25~2.24 mm)的等离子体催化转化CO2结果显示,CO2转化率随着ZrO2粒径的增大先减小后增加,随BaTiO3,Al2O3粒径的增大CO2转化率不断增加[64]。粒径较小的颗粒能提供更多的接触点,能量更高的电场;粒径较大的颗粒能够提供更大的放电间隙,使气体在放电区域充分反应,不同材料对2种效应的响应不同,造成了CO2转化率随粒径变化趋势的差异。由此可见,催化剂对等离子体行为的影响可以概括为催化材料的极化效应引起的电场和电子能的增强,但过高的电子能量对CO2分解的逆反应也会有促进作用,不同催化材料对应的电子能量分布仍有待研究。
催化材料对CO2的吸附作用延长了CO2在等离子体反应区的停留时间[54],反应更加充分,增强CO2转化效果。催化材料会使气体间隙电子密度降低,但VO捕获的电子可以转移到吸附的CO2进行反应[28]。g-C3N4结合等离子体催化转化CO2的关键是将特定的粒子结合[56],这得益于g-C3N4的半导体特性对高能电子的吸收功能与丰富的孔结构对CO2的吸附功能的综合作用。ZnO可提供吸附CO2的碱性位点,因此负载了ZnO的g-C3N4表现出比g-C3N4更好的CO2转化效果[65]。仅靠ZnO的吸附作用对CO2的转化效果增幅有限,Pb/ZnO2[66]中形成的Pb/Zn合金通过促进CO的脱附,实现了CO2转化率的进一步提升。γ-Al2O3作为两性氧化物,对酸性气体CO2有吸附作用[67],将其填入等离子体反应器可增强CO2转化效果,反应器的前段初始反应物只有CO2,而中段和后段初始反应物包括CO2,CO和O,Al2O3对CO和O的吸附为其重组成CO2提供了更多机会,因此Al2O3填充到反应器的前段时,获得了更高的CO2转化率[23]。此外,负载Ni的Al2O3的等离子体催化转化CO2效果好过Al2O3的等离子体催化转化CO2效果,这是因为Ni表面对基态和激发态的CO2的吸附作用导致。综上,催化材料对CO2和其他等离子体物种的吸脱附影响CO2的转化效果,掺杂金属增加CO2吸附活性位点是催化剂改性较常见的方法,对于等离子体催化转化体系,改性过程中还应考虑到掺杂金属的导电性,防止催化材料成为良导体阻碍等离子体反应的产生。此外,催化材料对等离子体的温度、击穿电压的影响也有待研究。
3 问题与研究展望
3.1 面临的问题
等离子体转化CO2已被证实是一种很有前景的技术,并且能够适应可再生能源的波动供应,利用过剩的风能、太阳能资源化CO2是碳利用的一种潜在方案。近年来,学者们致力于研发高CO2转化率、高能量效率的等离子体装置,探索了不同工艺参数对CO2转化的影响并设计了最佳反应条件,研究表明引入背景气体能够进一步改善CO2的转化效果。但是等离子体中的电子能量高于CO2分解需要的能量,部分能量转化成热能,单一等离子体很难获得理想的CO2转化效果。在等离子体装置中引入催化材料后,等离子体激发光、热催化剂的催化效应,催化剂也会影响等离子体效应,2种效应结合改善了CO2的转化效果。但离子体催化转化CO2技术仍处于研究阶段,研究成果还不能应用于实际工程,等离子体与催化材料的协同机制尚不明晰,适用于等离子体催化材料的制备工艺仍有待探讨。
3.2 研究展望
综上,等离子体资源化转化CO2仍面临一些技术挑战。为了实现等离子体协同催化转化CO2的实际工程应用价值,需对高效等离子体技术和等离子催化化学进行深入研究,建议今后研究重点侧重于以下几方面。
1)进一步揭示等离子体转化CO2的反应机制。等离子体转化CO2的过程复杂,一些反应有助于CO2的分解转化,也有一些反应会阻碍CO2转化。应努力通过改变反应条件,抑制或削弱阻碍CO2转化的反应,进而提升CO2的转化性能。例如在反应器后接冷却装置,阻止高温条件下CO和O2复合为CO2。
2)系统探究等离子体和催化剂协同作用机制。催化剂表面的活性位点是等离子体协同催化转化CO2的关键,因此,需对不同的催化剂进行表征,优选出最适合的催化材料,再对该催化材料的形状、形态、尺寸进行设计,最终改善等离子体催化转化CO2的效果,克服单一等离子体转化CO2效果差的难题。
3)从技术的实际工程应用方面,应关注如何结合生产企业实际CO2排放量和排放浓度,对等离子体反应器结构参数进行工程放大;综合评价等离子体转化CO2技术的经济效益,除了考虑反应过程中等离子体反应器的能源消耗以及催化材料的经济投入,还要考虑CO2还原产物分离所消耗的额外能源等;此外,等离子体反应器,如介质阻挡放电装置容易在高压电接入端产生沿面放电和爬电,引起局部过热起火,而CO2还原产物多属于易燃易爆气体,为了避免设备使用过程中引发爆炸或火灾等安全问题,应加强对该技术安全风险方面的研究。
