原发性宫颈印戒细胞癌一例
2023-11-09敖基兴张建飞刘国华
敖基兴, 张建飞, 刘国华
1 病例介绍
患者,女,66岁,因“反复阴道排液2个月”于2021年6月13日至长沙珂信肿瘤医院就诊。初诊体格检查发现宫颈上唇一直径约5 cm肿块,宫颈管呈桶状增粗,质地硬,触之出血。血小板319×109/L。血浆D-二聚体4.52 μg/ml。血清肿瘤标志物结果示:鳞状细胞癌抗原(SCC)3.32 ng/ml;糖类抗原-199(CA-199)10.48 IU/ml;糖类抗原-125(CA-125)350.20 IU/ml;癌胚抗原(CEA)109.30 ng/ml。双下肢静脉彩超检查示:左侧腘静脉及双侧肌肉间静脉低回声物,考虑血栓形成。盆腔MRI检查示:宫颈及宫颈管巨大肿块影,大小约8.3 cm×5.3 cm×4.7 cm,符合宫颈癌;双侧宫旁未见明显受侵(见图1)。宫颈人乳头瘤病毒(human papilloma virus,HPV)18型阳性。宫颈液基细胞学检查示意义不明确的非典型鳞状细胞。宫颈活检病理结果示(宫颈3、6、9、12点方位)低分化腺癌,大部分为印戒细胞癌。因患者病理类型特殊,且部分消化道肿瘤标志物增高,为排除消化道来源转移性恶性肿瘤,继续行电子胃镜、肠镜检查,胃镜下胃底息肉样赘生物,镜下活检病理结果示胃底腺息肉;肠镜下未见肠黏膜明显占位性病变。结合患者病史及上述检查,初步诊断为:(1)宫颈印戒细胞癌ⅠB3期;(2)双下肢静脉血栓。经过长沙珂信肿瘤医院多学科诊疗模式讨论认为,本例患者应积极行根治性手术治疗,且术后需补充治疗;术前可局部给予介入血管栓塞治疗阻断肿瘤血供,并同时行新辅助化疗缩小瘤体。患者合并下肢静脉血栓,为了降低围术期远处器官栓塞风险,术前应处理血栓。综合以上情况,本例患者于2021年6月17日行下腔静脉滤器植入术,术后给予低分子肝素钠皮下注射。于6月18日行子宫动脉造影下栓塞术+灌注化疗术(化疗为TP方案:多西他赛+顺铂)。在介入治疗1周后复查盆腔MRI示:宫颈肿块较前缩小,大小约6.9 cm×4.3 cm×4.1 cm。患者于7月1日完成根治手术(经腹广泛性子宫切除术+双侧附件切除术+盆腔淋巴结清扫术)。术后大体标本可见:宫颈肿块大小为6.0 cm×4.0 cm×2.5 cm,侵犯宫颈管及宫腔。术后病理结果示:宫颈、宫颈管低分化黏液腺癌,符合印戒细胞癌(见图2)。宫颈浸润深度约1.4 cm(宫颈间质厚约1.5 cm),宫颈管浸润深度约1.0 cm(此处宫颈管深度约1.5 cm),宫颈管腔面见癌组织侵犯,双侧宫旁未见癌,阴道残端未见癌。盆腔淋巴结均未见癌转移。免疫组化结果示:CDX-2、CD10、AFP、CD30、p40、Vimentin、ER、PR、HER-2均为阴性,p16(弥漫2+,见图3)、CK7(弥漫3+)、CK20(灶性+)、Ki-67(阳性指数30%)、CEA(2+)、CK-P(3+)、CK5/6(2+)、p53(灶5%+)。四项错配修复(mismatch repair,MMR)蛋白:MSH2(+)、MSH6(+)、MLH1(+)、PMS2(+),提示pMMR状态(微卫星稳定状态)。综上,患者术后明确诊断为宫颈低分化印戒细胞癌ⅠB3期。患者术后接受了1周期TC方案(多西他赛+卡铂)全身静脉化疗,拟定补充盆腔外照射放疗[临床靶体积(CTV)包括:阴道残端、部分阴道、阴道旁组织、原宫旁及盆腔淋巴引流区,上界L4上缘,下界双侧闭孔下缘,95%计划靶体积(PTV),46Gy:2Gy/23F]。患者于2021年10月18日开始放疗,由于放疗过程中反复出现“尿频、尿急、尿痛”等副反应,患者拒绝继续放疗,因此实际仅执行5次放疗,未能完成全部照射计划。结束治疗后患者于长沙珂信肿瘤医院规律完成复查及随访,目前生化检查及影像学资料仍无疾病进展及复发证据。自患者初诊至2023年4月,总随访生存时间为22个月。
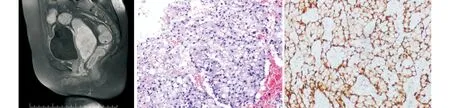
图1 患者宫颈肿块在盆腔MRI的影像学所见 图2 患者术后组织病理学印戒细胞癌表现图(HE×50) 图3 患者p16蛋白的免疫组化染色图(HE×50)
2 讨论
2.1宫颈癌是我国最常见的女性生殖系统恶性肿瘤之一。在组织病理类型上,宫颈鳞癌最为常见且预后最好,约占80%;宫颈腺癌虽仅占15%~20%,但其恶性程度高,且近年来发生率呈上升趋势[1]。2014年世界卫生组织将宫颈黏液性腺癌分为胃型、肠型及印戒细胞型3种类型,其中以原发性宫颈印戒细胞癌(primary cervical signet-ring cell carcinoma,PCSRCC)这类型最为罕见[2-3]。印戒细胞癌常见于消化道恶性肿瘤(比如胃癌),其余部位多为转移瘤。也有报道自肺癌、乳腺癌、阑尾癌、胆管癌或卵巢癌转移[4],而PCSRCC罕见[5-6]。自1990年报道PCSRCC以来[5],目前国内外已发表的文献较少,缺乏对PCSRCC的诊断及治疗经验。
2.2病理学诊断是宫颈印戒细胞癌诊断的金标准。绝大部分宫颈癌患者的症状为不规则阴道流血或性交后阴道流血,其主要病理类型为鳞癌。除上述症状外,部分宫颈腺癌患者还可出现不规则阴道排液。在已报道文献中,有2例主诉为“异常阴道排液”[7-8]。本例患者主诉“不规则阴道排液2个月”就诊,符合既往文献的报道。除此之外,PCSRCC患者在体格检查、实验室检验及MRI、CT等影像学检查等方面,与其他病理类型的宫颈癌患者比较并无特异性差异,增加了PCSRCC诊断的难度。
2.3基于病理诊断的结果,宫颈发现的印戒细胞癌必须与其他部位来源的转移瘤相鉴别[3],除了采用内镜手段排除胃肠道原发肿瘤之外(如本例患者),检测HPV的感染和生物标记蛋白的表达可为PCSRCC的鉴别诊断提供依据[7]。HPV 16型和18型感染与宫颈癌发生最为密切[9],以往文献报道中,大部分PCSRCC患者为HPV 18型阳性[4,7,9-11]。本例患者亦为HPV 18型阳性,推测HPV 18型感染可能与PCSRCC的发病及进展密切相关,但还需更多样本量研究证实。通过免疫组化检测生物标记蛋白表达量在分子层面为PCSRCC的鉴别诊断提供了重要依据。文献提示p16可作为一个重要的诊断标志物[7]。本例患者p16表达阳性且范围弥漫,阳性程度高。本例患者CK20为阳性表达,ER及PR为阴性表达,与文献[4,11-13]报道相符合。有文献指出CDX-2在PCSRCC中为阳性表达[8,13],而本例患者CDX-2为阴性。本例患者的CK7为阳性表达,有文献指出胃转移及乳腺转移的宫颈印戒细胞癌中CK7亦为阳性表达[7],故CK7无法作为鉴别肿瘤来源的分子标志物。本例检测了MMR标志物(MSH2、MSH6、MLH1、PMS2),因PCSRCC尚无有效的治疗方案,检查微卫星稳定状态、PDL1表达量、MMR标志物及肿瘤突变负荷等基因检测十分重要,为PCSRCC患者提供可能的免疫治疗选择。
2.4PCSRCC总体预后较差,从现有报道文献来看,预后与患者国际妇产科学联合(International Federation of Gynecology and Obstetrics,FIGO)分期相关[14]。PCSRCC的治疗主要依据鳞癌、腺癌、腺鳞癌3种病理类型的方案推荐[1]。文献显示,晚期患者疾病进展迅速,3例Ⅳ期患者生存期均不到3个月[10-11],其中1例确诊后7周内死亡[11]。1例ⅢC期患者在接受姑息化疗后随访生存期超过半年[15]。大部分早期患者都接受了手术治疗,其中3例ⅠB期患者仅接受手术并未补充放化疗[9,11,16],仅接受手术的1例患者随访期内生存时间达25个月[16]。有2例ⅠB期患者接受了手术,术后辅助同步放化疗,生存期超过8年(其中1例生存期长达10年)[13,17]。本例患者FIGO分期为ⅠB期,手术前给予介入治疗及新辅助化疗以缩小瘤体,术后计划补充同步放化疗,但由于患者无法耐受未能完成所有巩固治疗计划,截至2023年4月,随访期内生存时间达22个月。
2.5PCSRCC的恶性程度高,预后差。由于病例较少,治疗手段和方案尚未形成专家共识。通过不断累积的案例报道,笔者认为通过HPV感染状态、分子标志物检测等手段,可为PCSRCC的诊断及鉴别诊断提供有力的依据。
