Paxlovid用于肾移植术后新型冠状病毒感染的单中心疗效分析
2023-11-09叶俊生林芬望解俊杰于立新
叶俊生, 林芬望, 解俊杰, 舒 文, 于立新
自2019年12月以来,新型冠状病毒感染(coronavirus disease 2019,COVID-19)在全球范围内流行[1-2]。根据世界卫生组织统计,截至2022年10月,COVID-19大流行已在全球造成死亡病例数超650万例[3]。2022年2月11日,国家药品监督管理局批准奈玛特韦/利托那韦(Paxlovid)用于治疗成人伴有进展为重症高风险因素的轻至中度COVID-19患者,现已在多个国家获得授权或批准使用[4]。随着病毒的变异、毒力减弱及防控政策的优化和调整[5],2022年12月后我国COVID-19病例数量出现一过性快速增加。肾移植患者长期服用免疫抑制剂,是容易感染新型冠状病毒(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)的高危人群,患有COVID-19的住院肾移植受者肺炎重症率、急性肾损伤率和死亡率更高[6-7]。已有数据表明Paxlovid能降低COVID-19的重症率和死亡率[8-10],但在肾移植人群中的应用情况缺乏大样本观察,国内对于Paxlovid用于肾移植受者感染SARS-CoV-2的报道也较少。本文对本移植中心将Paxlovid用于肾移植术后COVID-19的疗效进行回顾性分析。
1 资料与方法
1.1临床资料 回顾性分析2022年12月1日至2023年2月28日期间在我院随诊的同种异体肾移植受者的临床资料,收集其COVID-19疫苗接种史、SARS-CoV-2抗原/核酸检测阳性或出现COVID-19相关的11类症状的日期、症状持续时间、Paxlovid服用情况,感染前的血清肌酐(serum creatinine,Scr)、尿蛋白、体质量指数(body mass index,BMI)、吸烟史、糖尿病史,以及确诊感染后第7天、第14天、第30天的Scr和第14天、第30天尿蛋白结果。COVID-19期间服用了Paxlovid的病例为Paxlovid组,未使用Paxlovid、阿兹夫定等药物的病例为常规治疗组。纳入标准:(1)在2023年1月31日之前已感染了SARS-CoV-2;(2)感染前后均在我院有门诊或住院就诊记录及相关检查记录。排除标准:(1)肾移植受者<18岁;(2)肾移植手术前感染了SARS-CoV-2;(3)肾移植术后14 d之内感染了SARS-CoV-2。共有70例符合上述条件的肾移植受者纳入本研究,其中轻型45例,中型19例,重型6例。接受Paxlovid抗病毒治疗16例,其中轻型2例,中型8例,重型6例。仅接受常规治疗的患者54例,均为轻至中型。在感染SARS-CoV-2之前,Paxlovid组与常规治疗组患者的性别、年龄、BMI、术后时长、感染前Scr、吸烟史、糖尿病史和至少接种一剂COVID-19疫苗的占比差异无统计学意义(P>0.05)。见表1。本研究经北京清华长庚医院伦理委员会批准(审查编号:23603-6-01)。

表1 两组临床资料比较
1.2治疗方法
1.2.1 COVID-19临床分型 根据《新型冠状病毒感染诊疗方案(试行第十版)》[11]进行COVID-19临床分型:(1)轻型:以咽干、咽痛、咳嗽及发热等上呼吸道感染为主要表现,肺部影像学无明显改变。(2)中型:持续高热超过3 d或(和)咳嗽、气促等,但呼吸频率<30次/min、静息状态下吸空气时指氧饱和度>93%,影像学可见特征性COVID-19肺炎表现。(3)重型:成人符合下列任何一条且不能以COVID-19以外的其他原因解释:①出现气促,呼吸频率≥30次/min;②静息状态下,吸空气时指氧饱和度≤93%;③氧合指数≤300 mmHg;④临床症状进行性加重,肺部影像学显示24~48 h内病灶明显进展>50%。
1.2.2 COVID-19治疗方案 COVID-19患者常规治疗包括对症退热、止咳祛痰、保证充分能量与营养摄入,维持水、电解质平衡,中型患者口服头孢类抗生素或莫西沙星预防细菌感染,重型患者静脉给予头孢哌酮舒巴坦或哌拉西林他唑巴坦预防细菌感染。氧合指数<300 mmHg的患者给予鼻导管或面罩吸氧,观察1~2 h症状无改善使用经鼻高流量氧疗(high-flow nasal cannula,HFNC)或无创通气(non-invasive ventilation,NIV)。氧合指数<200 mmHg的患者直接给予HFNC或NIV,观察1~2 h症状无改善或者氧合指数<150 mmHg时给予有创机械通气。所有重型患者积极给予Paxlovid抗病毒治疗。
1.2.3 Paxlovid用药方案以及期间免疫抑制用药调整 估算肾小球滤过率(estimated glomerular filtration rate,eGFR)>60 ml/min时,给予奈玛特韦300 mg+利托那韦100 mg,每12 h一次,连续口服5 d;eGFR在30~60 ml/min时,给予奈玛特韦150 mg+利托那韦100 mg,每12 h一次,连服5 d。根据患者病情停服他克莫司或环孢素减量,霉酚酸类抗增殖药物维持原剂量或适当减量,住院患者静脉滴注甲强龙20~80 mg/d,门诊患者口服醋酸泼尼松20 mg/d或甲泼尼龙16 mg/d,1周后开始逐渐减量至维持剂量。Paxlovid停用2 d后,开始在血药浓度监测指导下逐步恢复口服他克莫司与霉酚酸类抗增殖药物。
1.2.4 未接受Paxlovid抗病毒治疗患者的免疫抑制方案调整 临床分型为重型的患者停服他克莫司或环孢素,霉酚酸类抗增殖药物适当减量或停药,静脉滴注甲强龙40~80 mg/d;临床分型为中型的患者予钙调磷酸酶抑制剂(calcineurin inhibitor,CNI)类药物及霉酚酸类抗增殖药物减量,住院患者静脉滴注甲强龙20~40 mg/d,门诊患者口服醋酸泼尼松20 mg/d或甲泼尼龙16 mg/d,1周后开始逐渐减量至维持剂量,他克莫司与霉酚酸类抗增殖药物恢复至感染前维持剂量。轻型患者以对症治疗为主,免疫抑制剂不作调整。
1.3检测方法 他克莫司血药浓度采用酶联免疫分析法测定(ELx800型通用酶标仪,Wellwash 4Mk2型酶标洗板机,PRO-TracTMⅡPacrlimus ELISA试剂盒)。碱性苦味酸法(Jaffe法)测定Scr(0.04 moI/L苦味酸溶液,0.32 moI/L氢氧化钠溶液,碱性苦味酸溶液)。采用试纸条指示剂蛋白误差法测定尿蛋白。采用反转录+实时聚合酶链式反应法检测COVID-19核酸。
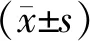
2 结果
2.1两组感染前后蛋白尿定性、重症率比较及转归情况 在感染前,感染后第14天、第30天,Paxlovid组和常规治疗组尿蛋白阳性的比例差异均无统计学意义(P>0.05)。Paxlovid组和常规治疗组COVID-19重型患者比例差异有统计学意义(P<0.001)。见表2。两组患者经过治疗后,症状均逐步好转,无复发、进展为危重型和死亡的病例。
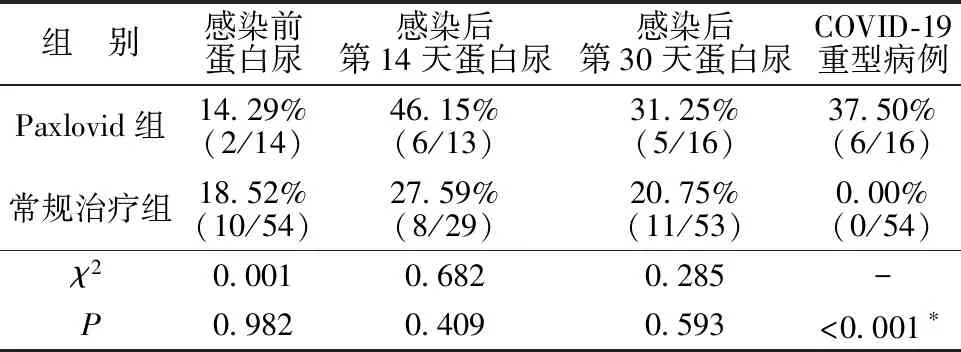
表2 两组感染前后蛋白尿定性、重症率比较
2.2两组Scr及尿蛋白比较 在感染后的1个月内,Paxlovid组的Scr最高值为(176.00±39.43)μmol/L,显著高于常规治疗组的(142.65±36.87)μmol/L,t=2.602,P=0.013。见图1。Paxlovid组和常规治疗组在感染后的第7、14、30天的Scr分别为(173.71±43.59)μmol/L vs (131.53±27.95)μmol/L、(151.00±39.97)μmol/L vs (131.19±35.12)μmol/L、(150.75±50.25)μmol/L vs (131.78±40.05)μmol/L,P值分别为0.046、0.091和0.127。见图2。
*表示P<0.05
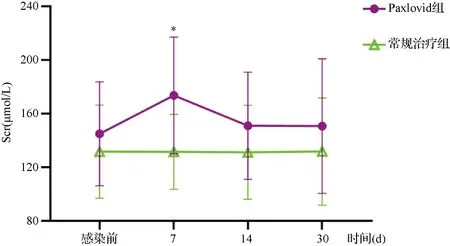
图2 COVID-19前后Scr对比图
2.3他克莫司药物相互作用 Paxlovid的主要成分之一利托那韦是肝脏细胞色素P450酶3A(cytochrome P450 enzyme 3A,CYP3A4)的强抑制剂,因此能抑制CNI类药物代谢。本研究患者在服用Paxlovid前1 d停用他克莫司,Paxlovid停用2 d后开始在血药浓度监测下从小剂量开始逐步恢复他克莫司口服剂量,发现Paxlovid组的他克莫司谷浓度总体水平平稳。2例患者停用他克莫司口服Paxlovid期间,他克莫司血药浓度仍维持在10 ng/ml以上,2例患者恢复口服他克莫司后血药浓度高达20 ng/ml以上。见图3。
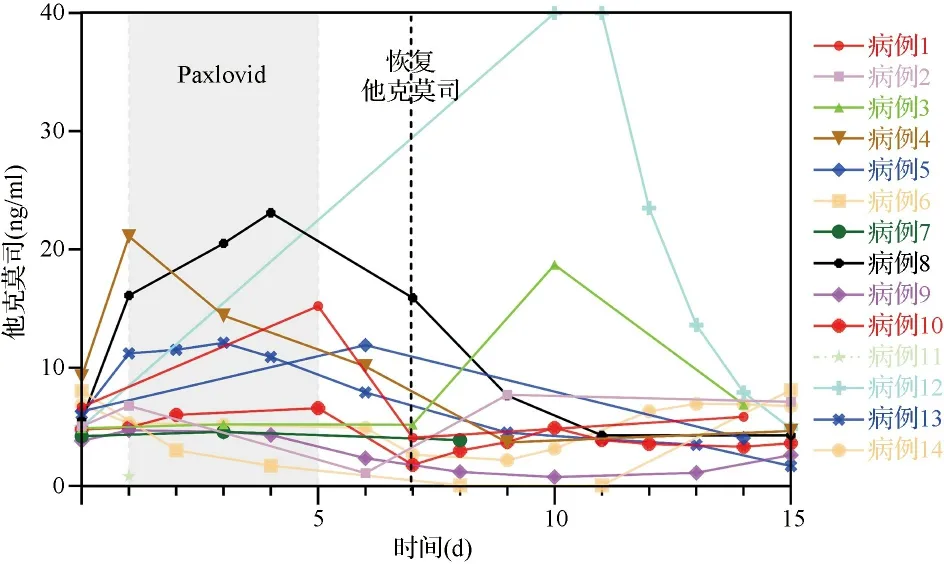
图3 他克莫司血药浓度变化图
3 讨论
3.1SARS-CoV-2是一种RNA冠状病毒,通过呼吸道飞沫在人与人之间传播,可导致呼吸道和全身性疾病。COVID-19以血管紧张素转换酶-2(angiotensin-conversion enzyme-2,ACE-2)为受体,亲和力强,ACE-2在肾脏有分布,且近端肾小管细胞ACE-2阳性细胞的比例约为呼吸道上皮细胞的2倍[12]。已有研究表明,COVID-19可能通过肾脏上皮细胞表面的ACE-2受体直接对肾脏造成损伤,或通过肺部损伤介导的缺氧和休克间接损害肾脏[13]。肾脏是COVID-19的潜在靶器官,COVID-19累及肾脏的主要表现是Scr升高、蛋白尿、尿量减少,一部分患者进展为急性肾损伤,合并急性肾损伤的患者发展为重症的风险显著增高[14]。
3.2既往Paxlovid主要推荐用于治疗成人伴有进展为重症高风险因素的轻至中度COVID-19患者,但COVID-19重型患者往往更有机会服用Paxlovid。本研究中,Paxlovid组患者在COVID-19后的第7天Scr显著高于常规治疗组[(173.71±43.59)μmol/L vs (131.53±27.95)μmol/L,P=0.046],主要是因为Paxlovid组患者COVID-19临床症状较重,重型患者所占的比例更高(37.50% vs 0.00%),但经过Paxlovid治疗后,两组患者在感染的第14天和第30天时的Scr差异均无统计学意义(P>0.05),表明Paxlovid有助于控制COVID-19患者的病情,减轻COVID-19对Scr的近期影响,远期预后尚待继续随访观察。Paxlovid组与常规治疗组在感染SARS-CoV-2前及感染后30 d内的尿蛋白定性差异无统计学意义(P>0.05),未见Paxlovid存在明确的肾毒性。一项来自比利时的研究也观察到,与服用Paxlovid的前1 d相比,服用Paxlovid第7天Scr浓度相似(P=0.866),但COVID-19病毒载量降低(P<0.002),尽管个体差异大,治疗结束时他克莫司谷浓度总体水平平稳,并且在中位时间为34 d的随访中,未观察到死亡或病毒性肺炎加重[10]。表明肾移植患者应用Paxlovid治疗COVID-19是安全的。
3.3器官移植受者是感染SARS-CoV-2的高危人群,接种COVID-19疫苗和做好个人防护是最有效、最经济的预防手段,肾移植受者接受COVID-19疫苗的不良反应发生率与健康人群相似,且不会增加短期内排斥反应的风险[15]。文献表明,健康甚至透析受试者对COVID-19疫苗接种有良好反应,但肾移植受者接种2剂次COVID-19疫苗后5%~48%的人群能产生保护性抗体[16-18],抗体滴度也有差异[19]。本研究中,在感染前接种过COVID-19疫苗的21例患者重型感染率仅为4.76%(1/21),并且在6例重型COVID-19患者中有5例患者未接种过疫苗。因此,推断肾移植受者接种COVID-19疫苗可降低COVID-19的重症率。
3.4本研究中,所有患者服用的钙调神经磷酸酶抑制剂均为他克莫司,尽管患者在开始服用Paxlovid之前已经停用他克莫司,但仍可见Paxlovid服药期间血液内仍有较高浓度的他克莫司,并且不同患者之间血药浓度差异较大。一方面,由于CYP3A4是人体参与他克莫司代谢的主要同工酶之一[20],利托那韦通过抑制CYP3A4酶而减少他克莫司的代谢清除[21];另一方面,考虑是因为CYP3A4存在基因多态性[22],不同患者的CYP3A4酶活性不同而导致他克莫司的代谢速度不一。服用Paxlovid时应密切监测他克莫司血药浓度,尽可能停用经CYP3A4酶代谢的辅助用药,同时可适当应用通便及护肝药,减少他克莫司肝肠循环,保护肝脏。
综上所述,Paxlovid用于治疗肾移植患者COVID-19是安全有效的,尽管本研究为回顾性分析,样本量偏少,观察时间较短,但仍可为临床医师提供参考,尤其是当肾移植患者发生中重型COVID-19时,可考虑使用Paxlovid进行抗病毒治疗,以改善患者预后。
