再生障碍性贫血继发恶性实体肿瘤二例
2023-11-09胡海波乔建林
顾 蔚, 胡海波, 朱 伟, 乔建林
1 病例介绍
病例1 女,56岁,1992年因“反复发热2周”在徐州市第一人民医院就诊。血常规结果示:白细胞1.5×109/L,中性粒细胞0.47×109/L,血红蛋白90 g/L,血小板50×109/L。骨髓细胞学示:骨髓小粒偶见,呈空架状,有核细胞量减少。中性粒细胞各阶段细胞比例降低,幼稚粒细胞少见,部分中性粒细胞胞浆内含有中毒性颗粒。淋巴细胞约占69.5%,巨核细胞全片未见,血小板少见。骨髓活检示:骨髓增生显著低下,仅见2个巨核细胞,未见明显异型增生及原始细胞增多。综合以上检查结果诊断为再生障碍性贫血(aplastic anemia,AA)。予以积极抗感染,环孢素A、十一酸睾丸酮治疗后,症状好转,病情平稳。2019年7月24日患者因受凉后出现咳嗽、咳痰再次入住徐州市第一人民医院。患者咳嗽阵发性发作,痰较难咳出,呈白色黏液痰,无发热、骨痛、憋喘、阵发性呼吸困难。入院前曾在当地社区医院予阿奇霉素抗感染治疗,效果不佳。查胸部CT示:考虑右肺下叶炎症可能;其他双肺散在少许炎症,考虑双肺尖陈旧性病变可能。以抗感染治疗2周后复查血常规结果示:白细胞3.33×109/L,中性粒细胞1.47×109/L,血红蛋白93 g/L,血小板74×109/L;胸部CT示炎症部位大小较前无明显改变;磷癌抗原24.89 ng/ml,较正常升高。2019年8月19日行胸部增强CT示:右肺下叶内基底位置占位,符合肺恶性肿瘤CT表现。18F-脱氧葡萄糖(18F-fluorodeoxy glucose,18F-FDG)肿瘤全身探查示:右肺下叶病灶FDG代谢轻度增高,考虑肿瘤性病变可能。复查骨髓细胞学示:粒系、红系、巨核系增生活跃,血小板散在可见,未见异常肿瘤细胞。综合检查结果考虑患者存在肺癌可能,患者于2019年8月23日至外院行胸腔镜手术,术后病理诊断为肺腺癌。
病例2 女,57岁,2013年因“反复发作头晕、乏力不适”,就诊于徐州市第一人民医院血液科。血常规结果示:白细胞1.8×109/L,中性粒细胞0.32×109/L,血红蛋白90 g/L,血小板36×109/L。多部分行骨髓穿刺,骨髓细胞学示:多部位骨髓增生减低,淋巴细胞比例70%,骨髓小粒空虚。骨髓活检示:全切片增生减低,造血组织减少,未见异常细胞。综合以上检查结果诊断为AA,予间断输血支持治疗,予以口服环孢素A联合司坦唑醇等治疗,症状好转。2022年10月至2022年11月患者因多次黑便,出现胸闷、心悸症状,遂到徐州市第一人民医院就诊。复查血常规示:白细胞2.73×109/L,血红蛋白43 g/L,血小板36×109/L。予以输注红细胞、血小板对症支持治疗后,复查骨髓细胞学示:骨髓增生减低,有核红细胞散在不明显灶性分布,粒系、巨核系增生减低。胃镜检查结果示:浅表性胃窦炎,伴胆汁反流;胃窦小弯侧大片增生及溃疡改变。胃窦病理结果:考虑低分化腺癌(印戒细胞癌)。予以阿伐曲泊帕口服联合输注血小板治疗,以提升血小板水平、改善止凝血功能,为行手术治疗创造条件。患者于2022年12月1日转入普外科治疗,12月2日术中发现肿瘤位于胃窦部,大小约3 cm×2 cm×1 cm,尚未侵犯浆膜外(见图1ⓐ)。行胃癌根治术(毕I式),术后予以抗炎、补液、抑酸等对症支持治疗。术后病理示:距上切端5 cm下切端3 cm胃窦小弯侧浸润溃疡型低黏附性癌,部分为印戒细胞癌。Lauren分型:弥漫型,癌侵犯胃壁全层达浆膜下脂肪组织内,部分侵犯间皮层,侵犯神经,脉管内见癌栓,上下切端均(-),下切端脉管内见癌栓,胃小弯淋巴结见癌转移(15/16枚),胃大弯淋巴结见癌转移(9/9枚),胃网膜组织未见癌,“吻合口”未见癌。CK7(+),CK20(-),Villin(+),CEA(小灶+),CDX-2(+),HER-2(1+),EGFR(部分弱+),MUC5AC(+),MUC6(少量弱+),PMS2(+),MSH2(+),MSH6(+),MLH1(+),Ki-67(阳性指数60%),免疫组化结果支持原诊断,并示错配修复功能完整(见图1ⓑ)。
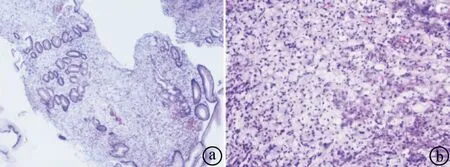
ⓐ胃窦病理(HE×10); ⓑ术后病理(HE×100)
2 讨论
2.1AA是一种常见的骨髓造血功能衰竭性疾病,发病机制至今尚未完全明确,可能与免疫系统异常、造血干细胞减少、基因突变以及造血微环境的改变有关,以全血细胞减少为特征,主要临床表现为感染、出血、贫血[1-2]。诊断本病需要完善血常规、骨髓细胞形态学、骨髓活检、流式细胞术、染色体核型分析、基因检测等相关检查,以全面评估患者病情,明确有无先天性造血功能衰竭等疾病存在,并排除阵发性睡眠性血红蛋白尿以及骨髓增生异常综合征。临床发现本病与阵发性睡眠性血红蛋白尿相关,并可进展为骨髓增生异常综合征或急性髓系白血病[3]。但临床上继发恶性实体肿瘤的文献报道较少。
2.2病例1多年前在多家医院就诊,均诊断为AA,予以环孢素、十一酸睾丸酮治疗后,病情平稳。2019年7月患者因出现咳嗽、咳痰等呼吸道症状就诊,与肺部感染相似,经抗感染后未明显好转,行增强胸部CT、正电子发射计算机断层扫描检查考虑肺部恶性肿瘤可能,最终行肺病理活检,及时诊断肺部恶性肿瘤,进行早期切除,未延误病情。随访至2022年5月,患者病情平稳。
2.3病例2诊断AA明确,消化道出血为患者此次就诊原因,血小板减少引发出血是AA常见症状之一,但因反复消化道出血行电子内镜检查发现胃部恶性肿瘤。在多学科共同诊疗下,最终行胃部肿瘤切除术,延长患者生存时间同时提高患者生存质量。随访至2022年5月,患者病情平稳。AA有向恶性疾病进展或转变的风险,一方面与AA本身的发病机制有关:已知免疫异常是AA的重要发病机制之一,研究结果显示细胞毒性T淋巴细胞通过激活FAS/FASL凋亡通路或者上调肿瘤坏死因子-α、干扰素-γ的产生从而介导了造血干细胞免疫损伤易引起AA的发生[4],而免疫系统负责清除癌性基因,当免疫受损后抑癌作用减弱,因此容易合并肿瘤的发生。另一方面,AA患者长期维持治疗中需要应用免疫抑制剂[5],环孢素A或他克莫司的长期作用引发机体免疫监控失常,不能及时消灭突变的细胞;此外,环孢素A可阻碍断裂的DNA修复以及促进转化生长因子-β产生增高,他克莫司可增加肿瘤的侵袭性等作用促进了肿瘤的发生[6-7]。研究还发现AA存在细胞遗传学方面的异常[8-9]。研究发现,部分AA患者存在染色体异常,常见有+8、+6、13号染色体异常等,这些异常的克隆性增生占AA患者的4%~11%,而存在染色体异常或基因异常是否会发生其他肿瘤性疾病尚需进行密切观察及随访[10]。
2.4AA可与多种血液系统疾病发生转化,如AA与骨髓增生异常综合征、阵发性睡眠性血红蛋白尿之间可相互转化,有的最终发展成急性髓系白血病[11]。但AA合并恶性实体肿瘤较少见[12]。这类肿瘤的临床表现与AA类似,及时、积极进行骨髓复查等相关检查是减少临床漏诊的可行方法。
