稻田土-水界面降NH3菌株的筛选与鉴定
2023-11-09高帅帅吴民熙尹红梅喻孟元杜东霞刘标陈薇王震许丽娟吴迎奔李咏梅赵信林
高帅帅,吴民熙,尹红梅,喻孟元,杜东霞,刘标,陈薇,王震,许丽娟,吴迎奔,李咏梅,赵信林
(1.湖南省微生物研究院,长沙 410009;2.中国农业科学院麻类研究所,长沙 410205)
施肥可以显著提高作物产量,据统计,化肥对主要粮食作物产量的贡献率高达40%~60%[1-2]。氮对作物的生长和产量至关重要,施氮则成为提高粮食产量的关键手段[3-4]。我国是世界上最大的水稻生产和消费国,需要持续增加水稻产量来满足日益增长的对粮食的需求[5]。水稻对氮的需求量较大,且需要分次施氮才会有更好的效果[6]。为保证产量,农民一般选择直接将尿素撒在稻田上覆水进行追氮。在尿素转化为铵态氮或进一步转化为其他形态无机氮后,除部分被作物吸收利用,还有相当部分通过NH3挥发、径流、淋溶、硝化-反硝化等途径损失[7],这不仅造成肥料资源的浪费,还会诱发多种环境污染问题[8-9]。研究表明,NH3挥发是氮素损失的主要形式之一,NH3挥发量占施氮量的9%~40%[4,10],NH3挥发不仅降低了肥料利用率,还会对水体、大气带来不良影响[11]。因此,亟待改善施肥技术或寻找其他途径减少NH3挥发。
关于稻田NH3挥发的研究很多,多种方法已经被证明可以有效降低NH3挥发。例如:Chen等[12]通过多点多年试验发现土壤-作物综合系统管理可以有效降低NH3挥发并提高产量;Li 等[13]通过深度分析发现缓控释肥、硝化抑制剂、脲酶抑制剂等的使用可显著降低NH3挥发并提高产量;有研究表明尿素深施[14]、合理晚施[15]等也可以提高氮肥利用率并降低NH3挥发。尽管上述措施在一定程度上减少了NH3挥发损失,提高了氮的利用效率,但其经济性和劳动力投入都限制了其在水稻种植系统中的广泛应用。
微生物在自然界的物质循环和能量流动中发挥着不可替代的作用,对农田生态系统中的氮循环具有重要意义[16-17],但微生物在降低农田氮损失方面的研究报道较少。微生物同化无机氮作用是构成土壤氮素保蓄能力的重要组成,Li 等[18-20]研究发现合理恢复退化生态系统的土壤微生物同化无机氮作用可有效提高土壤氮素保蓄能力,减少氮素损失风险。微生物在减少氮损失方面的应用还体现在堆肥中,如Guo等[21]通过在猪粪和麦秸混合堆肥中添加5%的巨大芽孢杆菌发现NH3和N2O的排放量减少;Tu等[22]发现,将由乳酸杆菌等组成的微生物菌剂与生物炭组合添加到猪粪与锯末混合的堆肥中,可以有效降低NH3和N2O排放量,增加堆肥中的氮素存储量。然而,目前有关利用相关微生物降低稻田氮损失的报道还不多见。
土-水界面是稻田土壤和上覆水中氮“交流”的必经之所,特殊的环境条件使其与上覆水体和耕层土壤相比,在理化、氮磷化学计量、微生物种类方面存在特殊性,土-水界面氮素迁移转化极大地影响着稻田氮素走向[23-24]。NH3挥发是稻田氮损失的主要途径,稻田土-水界面降NH3工作的开展有利于降低肥料损失,而生物降NH3[25]具有经济、高效的特点。本研究拟利用湖南省益阳市典型稻田的土-水界面样本筛选土壤中降NH3效果较好的菌株,并对其致病性和生化特征等进行鉴定,以期利用该菌株有效降低稻田NH3挥发和提高氮肥利用率。
1 材料与方法
1.1 试验材料
1.1.1 试验样品
水稻插秧后,在湖南省益阳市某典型稻田(28.373 4°N,112.339 1°E)土-水界面采集土水混合样本带回实验室用于分离降NH3菌株。
1.1.2 培养基
氨选择性培养基[26-27]:蔗糖50.0 g,KH2PO42.0 g,MgSO40.5 g,FeSO40.1 g,ZnSO40.5 g,NaCl 2.0 g,1 000 mL H2O,氨水10 mL,自然pH。
营养肉汤(NB)培养基:蛋白胨10.0 g,牛肉粉3.0 g,NaCl 5.0 g,蒸馏水1 000 mL,pH 7.0~7.4。
分离培养基:牛肉膏蛋白胨培养基、马铃薯葡萄糖培养基、高氏一号培养基。
富氨培养基:葡萄糖5.0 g,K2HPO40.5 g,MgSO40.25 g,FeSO40.01 g,(NH4)2SO40.47 g,NaCl 1.0 g,1 000 mL H2O,pH 7.0。培养基灭菌后用无菌水稀释4倍使用,经测定铵态氮浓度为25 mg·L-1。
富硝培养基:葡萄糖5.0 g,K2HPO40.5 g,MgSO40.25 g,FeSO40.01 g,KNO30.72 g,NaCl 1.0 g,1 000 mL H2O,pH 7.0。培养基灭菌后用无菌水稀释3 倍使用,经测定硝态氮浓度为34 mg·L-1。
尿素酚红培养基:尿素20 g,酚红1 g,蛋白胨10 g,牛肉膏3 g,NaCl 5.0 g,琼脂20 g,蒸馏水1 000 mL,pH 6.4。
低氨选择性培养基:100 mL 无氨选择性培养基中加入2 mL 500 mg·L-1的氨水。
1.2 试验方法
1.2.1 降NH3菌株的富集、分离纯化
称取土壤10 g 置于装有90 mL 无菌水的三角瓶中,室温环境下于180 r·min-1摇床处理30 min,随后静置20 min,吸取10 mL 稀释液接种至装有100 mL氨选择性培养基的三角烧瓶中,置于30 ℃、180 r·min-1摇床上恒温培养5 d 后,观察菌液变化,若菌液浑浊则表明菌株具有降解NH3能力,如此反复连续富集7代。
分别在牛肉膏蛋白胨培养基、马铃薯葡萄糖培养基、高氏一号培养基中,利用梯度稀释平板涂布法分离纯化菌液中的单菌落,筛选其中长势良好的菌落,再采用划线法多次分离纯化,直至获得完全纯的单菌落,将分离出的单菌落接种至试管斜面,4 ℃低温保存待用。
1.2.2 降NH3菌株的复筛及NH3降低率的测定[26-27]
将分离得到的单菌株接种至10 mL 营养肉汤培养基中,35 ℃、180 r·min-1培养24 h后,分别吸取细菌培养液置于无菌离心管中,8 000 r·min-1离心2 min后弃上清液,加无菌水重新悬浮,重复以上操作3 次,去除菌株生长过程中产生的氨,最后用无菌水重悬,制得无氨种子液。
取上述种子液2 mL 于装有100 mL 低氨选择性培养基的250 mL 密封瓶中,再向瓶中放入装有10 mL 0.005 mol·L-1硫酸吸收液的20 mL 试管,35 ℃、180 r·min-1摇床培养。对照组不加种子液,加2 mL无菌水。于培养的第1、2、3、4 天取样,采用纳氏试剂法测定NH3的释放量。
式中:R为NH3释放量的降低率,%;C0为对照组硫酸吸收液中铵的浓度,mg·L-1;C为加菌液处理硫酸吸收液中铵的浓度,mg·L-1。
1.3 菌种鉴定
将菌株接种在平板上35 ℃培养,待长出菌落后,观察菌落形态特征,并结合《微生物学实验》进行生理生化特征的鉴定[28]。
利用细菌DNA 提取试剂盒提取菌株的DNA,然后利用通用引物27F 和1492R 进行PCR 扩增[26],扩增反应条件:95 ℃预变性3 min;94 ℃变性1 min,56 ℃退火1 min,72 ℃延伸2 min,该过程进行30 个循环;72 ℃保持10 min。整个过程结束后,仪器设置为4 ℃终止保存。
PCR产物检测合格后,切割目的条带进行纯化回收,用回收后的产物进行Sanger 测序。Sanger 测序结果用软件ContigExpress 进行拼接,并去除两端不准的部分。批量对拼接序列进行blastn(最新版本v2.13)比对核酸数据库。其中,核酸数据库选择最新版本的nt库,通过与nt库进行blastn比对,即可得到同源序列的Accession Number号及物种鉴定和注释。将测得的序列结果在NCBI 进行BLAST 比对,利用Mega7 软件中的NJ法构建系统发育树,确定菌株的种属类别。
1.4 菌株对不同氮源的利用能力测定[27]
将无氨种子液,以2%的接种量,分别接种于富氨和富硝培养基中,35 ℃、180 r·min-1摇床培养,分别在第1、2、3、4 天取样,8 000 r·min-1离心2 min 后测定上清液中的铵态氮和硝态氮浓度。铵态氮采用纳氏试剂法进行测定,硝态氮参照《水和废水检测分析方法》[29]中的紫外分光光度法进行测定。
1.5 菌株产脲酶情况
产脲酶的细菌分解尿素后产生的氨使pH 上升,培养基呈碱性,以酚红为酸碱指示剂,颜色由黄色变为红色。因此,检验目标菌株是否产生脲酶采用尿素酚红培养基[30]。
同时开展土柱培养试验,设置添加目标菌株和不添加(对照)处理,在培养的第1、3、5 天取土-水界面泥土作为样品,利用脲酶试剂盒测定界面处脲酶活性。
1.6 数据分析
采用Excel 2016进行试验数据的处理,运用SPSS 22.0进行方差分析,利用Origin 2019b绘图,采用Duncan法在0.05的显著水平上进行多重比较。
2 结果与分析
2.1 降NH3菌株的筛选
土壤样品经氨选择性培养基富集、分离纯化后,共获得3 株长势较好的降NH3菌株,分别命名为菌Ⅰ、菌Ⅱ、菌Ⅲ,3 株菌均为细菌。利用低氨的选择性培养基对3 株菌株进行复筛,测定其NH3降低率,结果如图1 所示。在试验持续期间,菌Ⅰ和菌Ⅲ对NH3的降低率随着培养时间的延长而降低,菌Ⅱ在培养的前3 d 的NH3降低率比较平稳,第4 天出现上升。在培养的第1、2、3、4 天中,NH3降低率均是菌Ⅱ>菌Ⅰ>菌Ⅲ,菌Ⅱ的最高NH3降低率出现在第1 天,为88.60%,显著高于其他2个菌株。
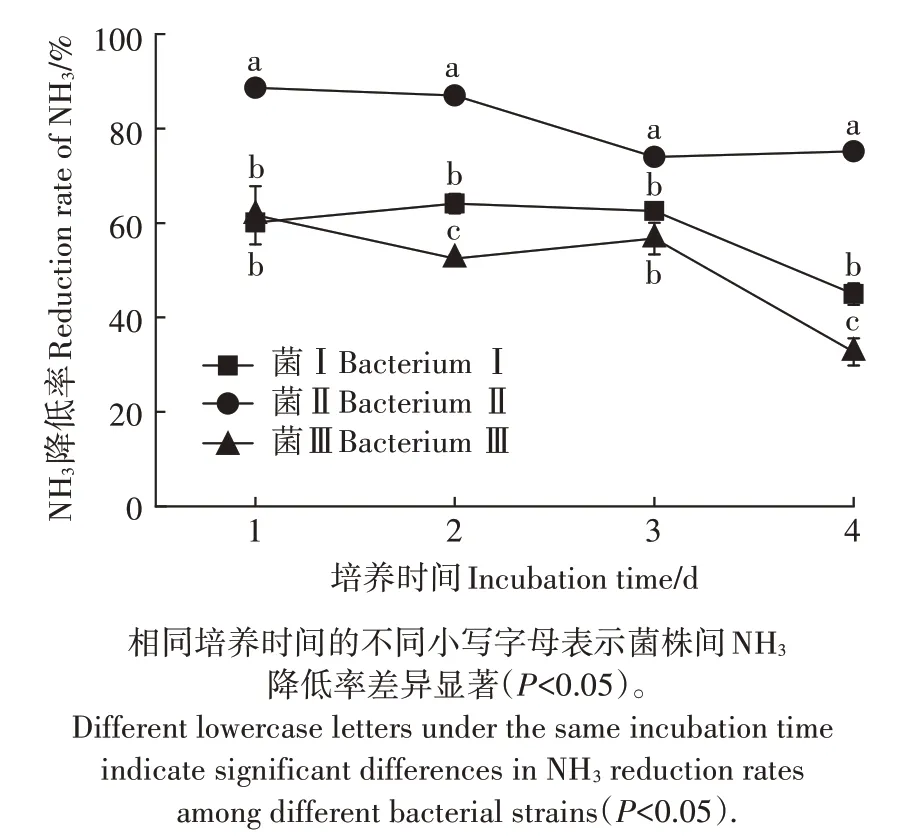
图1 不同菌株的NH3降低率Figure 1 NH3 reduction rates of different bacterial strains
2.2 菌种鉴定
选择NH3降低率最高的菌Ⅱ进行菌种鉴定,将其在牛肉膏蛋白胨培养基上培养,其菌落形态和显微观察特征及革兰氏染色结果见图2。菌Ⅱ的菌落呈圆形,边缘不整齐,颜色呈微黄色,不透明;革兰氏染色结果为阴性,菌体呈杆状。

图2 菌Ⅱ的形态特征及革兰氏染色情况Figure 2 Morphological characteristics and Gram staining of bacterium Ⅱ
扩增菌Ⅱ的16S rDNA 基因序列,得到一个1 419 bp 的PCR 产物,NCBI BLAST 比对结果显示菌Ⅱ与污水溶杆菌Lysobacter defluvii相似性最高(99.72%以上)。16S rDNA 基因序列系统发育树显示(图3),菌Ⅱ与污水溶杆菌Lysobacter defluvii聚为一支。结合形态学分析、革兰氏染色结果以及16S rDNA基因序列分析,菌Ⅱ被鉴定为污水溶杆菌。

图3 菌Ⅱ的系统发育树Figure 3 Phylogenetic tree of bacterium Ⅱ
2.3 菌株对不同氮源的利用能力
菌Ⅱ降NH3效果见图4a,加菌处理4 d内铵态氮浓度从25.00 mg·L-1降到9.85 mg·L-1,铵态氮降低率达到60.60%,其中第4 天降低率最高。在降低铵态氮的同时,培养基中的硝态氮浓度从0增加到1.08 mg·L-1。
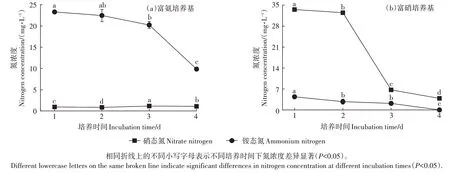
图4 菌Ⅱ对不同氮源的利用能力Figure 4 Utilization ability of different nitrogen of bacterium Ⅱ
菌Ⅱ降硝能力测定结果见图4b,加菌处理4 d 内硝态氮浓度从34.00 mg·L-1降到3.85 mg·L-1,硝态氮降低率达到88.68%,其中第3天降低率最高。在降低硝态氮的同时,培养基中的铵态氮浓度从0 增加到4.37 mg·L-1,随后降低至0。
2.4 产脲酶性能和溶血性能
将菌Ⅱ接种于尿素酚红培养基,培养48 h 后“十字”菌株周围未出现红圈(图5a),说明菌Ⅱ周围的尿素没有被分解,即该菌不产生脲酶。泥柱土-水界面样品的脲酶活性测定结果见图5b,接种菌Ⅱ后脲酶的活性与对照相比在第1 天无显著差异,但在第3 天和第5天显著降低。
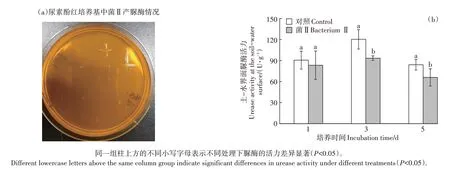
图5 菌Ⅱ产脲酶情况Figure 5 Urease production status of bacterium Ⅱ
溶血性是体外对相关菌株安全性测定过程中需要分析的关键指标之一。将菌Ⅱ接种于血平板,30 ℃培养48 h,进行溶血性实验,结果见图6,可以看出菌Ⅱ在血平板上生长良好,菌落附近没有出现溶血圈,说明菌Ⅱ不具有溶血性。
3 讨论
NH3挥发是稻田氮损失的重要途径,目前关于稻田NH3挥发的研究主要集中在施肥方式[15,31]、肥料用量[32]、氮肥种类[33-34]、土壤改良剂[35]等,但利用微生物降低稻田NH3挥发的报道较少,所以筛选土-水界面处的降NH3菌株十分必要。本研究通过采集湖南省典型稻田土-水界面样品,进一步筛选出的菌Ⅱ降NH3效果较好,NH3降低率最高可达88.60%,具有一定降低稻田NH3挥发的潜力。高通量测序所得菌株基因序列与NCBI 基因序列数据库进行对比分析,证明所筛选菌株为溶杆菌属,进一步通过菌落形态、颜色以及革兰氏染色结果发现所筛选菌株与Yassin等[36]报道的Lysobacter defluvii十分相似,所以判断所得菌株为污水溶杆菌。但是,目前有关污水溶杆菌的研究较少,关于污水溶杆菌的降NH3或氮转化功能方面的研究更为缺乏。同时,由于本试验是在室内开展的培养试验,该菌株在实际田间的降NH3效果还需要进一步验证。
与尹红梅等[27]的实验结果相比,菌Ⅱ的硝态氮利用能力和氨氮利用能力较弱,一方面这可能是因为本研究接种率为2%,低于尹红梅实验中的5%,另一方面可能是由于该菌株大量繁殖吸收了部分的氮。富氨培养基中铵态氮下降,但是硝态氮没有显著增加,由于本试验是在非厌氧条件下进行,好养的溶杆菌不易使反硝化发生,因此,富氨培养基中铵态氮降低的一个原因很可能是所培养菌株将其利用并转化为生物量氮,试验开展期间,随着菌的生长,供试培养基逐渐变浑浊,这也在一定程度上反映了菌株确实有一定的增殖,另一方面,由于是非厌氧条件,部分氨氮也可能通过NH3挥发损失。由于硝态氮相对稳定,同时试验在有氧条件下进行,所以富硝培养基中减少的硝态氮极有可能是被菌株增殖利用了。
脲酶是尿素分解过程中的关键酶[37],尿素酚红培养基研究表明菌Ⅱ几乎不产生脲酶[30],同时在土-水界面添加该菌株可能还有抑制脲酶产生的作用,这说明菌Ⅱ不会通过产生脲酶加速尿素产NH3的过程,满足稻田土-水界面降NH3的基本要求。溶血性是体外对相关菌株安全性测定过程中需要分析的关键指标之一,本研究发现菌Ⅱ无溶血性[38-39],初步断定菌Ⅱ的致病性可能较低,但是还需要开展进一步试验来鉴定其是否为致病菌株,从而决定该菌是否可应用于生产实践。
4 结论
(1)通过对稻田土-水界面降NH3菌株的筛选,获得了一株在室内试验条件下具有较好降NH3效果的菌株——菌Ⅱ,经鉴定该菌株为污水溶杆菌。
(2)菌Ⅱ几乎不产脲酶,且不具有溶血性,具有降低稻田NH3挥发的潜力。
(3)菌Ⅱ可能对氨氮和硝态氮具有较好的吸收和利用能力,其在稻田降低氮肥损失方面的效果需要进一步在田间验证。
