磷素对紫花苜蓿镉累积和抗氧化酶活性的影响
2023-11-09邓随枫廖雨梦章昊祖艳群
邓随枫,廖雨梦,章昊,祖艳群
(云南农业大学资源与环境学院,昆明 650201)
镉胁迫可使植物发生一系列的生理生化变化。长期的镉胁迫会使细胞中的活性氧累积,进而诱导氧化,降低植株的根系活力,抑制植株生长,促使叶绿素降解,导致植株枯萎[10-11]。而抗氧化体系则能通过调整活性氧在细胞中的含量来缓解植物受到的伤害[12-13]。本文针对镉胁迫条件下施磷对紫花苜蓿生物量、植株镉含量、植株亚细胞镉分布、抗氧化酶活性等进行分析,探究不同施磷水平对镉胁迫下紫花苜蓿的生长发育和对镉累积的特点,以期阐明磷素对紫花苜蓿缓解镉毒的影响,为镉污染土壤的综合利用提供参考。
1 材料与方法
1.1 试验地概况与试验材料
试验地位于云南农业大学农场(25°14′30″ N,102°56′27″ E),海拔约1 891 m,平均温度14.9 ℃,年降雨量1 000.5 mm,降水以5—9 月为主,年日照2 327.5 h,年蒸发量1 856.4 mm,相对湿度76%。试验土壤为山原红壤,基本物理化学性质为:pH 值6.81,全氮含量0.75 g·kg-1、全磷含量0.67 g·kg-1、全钾含量16.01 g·kg-1,速效磷含量82.81 mg·kg-1、速效钾含量188.96 mg·kg-1,碱解氮含量56.75 mg·kg-1、有机质含量30.12 g·kg-1、总镉含量0.38 mg·kg-1。
试验作物:紫花苜蓿(Medicago sativaL.),品种名为中苜一号。
1.2 试验设计
设置6 个磷(P2O5)处理水平,分别为0、40、80、160、240、300 mg·kg-1,采用钙镁磷肥(P2O5≥12%)配制;3个镉处理含量,分别为0、2、20 mg·kg-1,以CdCl2·2H2O 配制。共18 个处理,每个处理5 个重复,共90盆,随机排列。
供试土壤风干后过2 mm 筛。钙镁磷肥和CdCl2·2H2O 根据设计水平混合加入土壤,与土壤充分混拌均匀。尿素(100 mg·kg-1)和K2SO4(100 mg·kg-1)作为基肥一次性施入土壤,混拌均匀。将混匀后的土壤装入塑料花盆中,每盆5 kg,用去离子水调节土壤含水量为最大田间持水量(60%左右),平衡14 d。选择籽粒大小均匀、饱满的紫花苜蓿种子,用10%H2O2溶液消毒30 min,然后用少量的蒸馏水反复冲刷,每盆播种10粒,当紫花苜蓿的幼苗长到10 cm时,每盆留苗5株,在生长期定时浇水。生长45 d(初花期)后采样。
1.3 指标测定方法
生物量测定:参照王洪斌等[14]的方法,将作物分成地上、地下两个部分,分别先用自来水清洗,再用蒸馏水清洗,洗净后的样品装进牛皮纸袋,置于105 ℃烤箱中,0.5 h 后,75 ℃干燥72 h,待质量恒定后称取质量,以测定生物量。
植株镉含量测定:称取0.5 g过0.25 mm 筛的干燥植物样品,用HNO3-HClO4(4∶1)的混合酸湿法消解(石墨消解器Hanon220s)处理,采用25 mL 容量瓶定容,用原子吸收分光光度计(Varian SpectrumAA220)测定镉的含量[15]。
三是政府应引导国产钾肥与境外开发资源由竞争走向竞合,构建协调统一的境外预警机制。国内外统筹规划已经成为重新布局中国钾盐战略的切入点,在国内产能提升、境外资源即将释放之时,国内外的统筹规划、协调发展并制订合理的“游戏规则”显得尤为重要。随着境外开发企业取得的共识,境外钾盐企业与国内企业应当“从竞争走向竞合”,实现资源开发与市场渠道的合作共享。此外,“走出去”的企业应建立彼此的互信关系,协调统一地构建境外舆情监测机制,提升危机公关意识和应对能力,化解政治、环保、人文、地域矛盾。
镉的亚细胞分布:取嫩叶1 g,将其放入10 mL 预冷匀浆料中,匀浆料成分为250 mmol·L-1蔗糖、50 mmol·L-1Tris-HCl(pH 7.4)、1 mmol·L-1二硫赤藓糖醇(C4H10O2S2),嫩叶研磨成浆后,采用差速离心法,依次在600 r·min-1下离心10 min 得到细胞壁沉淀,1 000 r·min-1下离心15 min 得到叶绿体沉淀,10 000 r·min-1下离心20 min 得到线粒体沉淀,上层的溶液是细胞质组分(含液泡、核糖等),每次离心重复进行3次[16]。
粗酶液的制备:称取植物组织0.5 g,先加入2.5 mL PBS(磷酸缓冲液)研磨成浆后,再加入2.5 mL PBS混匀,4 ℃下10 000 r·min-1离心15 min,上清液即为粗酶液。粗酶液用于酶活性测定。
超氧化物歧化酶(SOD)活性采用氮蓝四唑(NBT)光抑制法测定;过氧化物酶(POD)活性采用愈创木酚法测定;过氧化氢酶(CAT)活性采用紫外吸收法测定[17]。丙二醛含量(MDA)采用硫酸巴比妥酸法测定[18]。
式中:CMDA为MDA 含量,µmol·g-1,以鲜质量计;A450、A532、A600分别为450、532、600 nm 波长下测得的吸光度值;V1为反应液体积,mL;VT为提取液总体积,mL;V2为测定液体积,mL;W为植物组织鲜质量,g。
1.4 数据处理与统计分析方法
采用Excel 2016 软件对数据进行初步的分析。利用SPSS 20 软件,采用新复极差法(New complex range method)对数据进行差异显著性分析,P<0.05 表示差异显著。
植株地上部镉累积量(µg·盆-1)为植株地上部镉含量与植株地上部生物量的乘积,植株地下部镉累积量(µg·盆-1)为植株地下部镉含量与植株地下部生物量的乘积。转运系数为植株地上部镉含量与植株地下部镉含量的比值。
2 结果与分析
2.1 磷素对镉胁迫下紫花苜蓿生物量的影响
在相同镉处理含量下,随施磷水平的增加,生物量呈现出先增加后减少的趋势。在240 mg·kg-1磷水平下,生物量开始减少(图1)。在相同施磷水平下,随镉处理含量的增加,生物量先增加后减少。其中,2 mg·kg-1镉+160 mg·kg-1磷处理下,紫花苜蓿生物量达到最大值13.54 g·盆-1。双因素方差分析表明,磷镉交互作用对紫花苜蓿生物量存在极显著的影响。

图1 磷素对不同含量镉胁迫下紫花苜蓿生物量的影响Figure 1 Effects of phosphorus on alfalfa biomass under different contents of cadmium
2.2 磷素对镉胁迫下紫花苜蓿叶片亚细胞镉含量的影响
在相同镉处理含量下,随施磷水平的增加,各亚细胞镉含量呈现出先减少后增加的趋势;在相同的施磷水平下,随镉处理含量的增加,各亚细胞镉含量显著增加(表1)。紫花苜蓿叶片亚细胞镉含量存在差异,表现为细胞壁>细胞质>线粒体>叶绿体,其中细胞壁镉含量最高,占总量的50%~64%,其次为细胞质,占总量的18%~29%,最少的是叶绿体,其镉含量仅占总量的1%~8%。
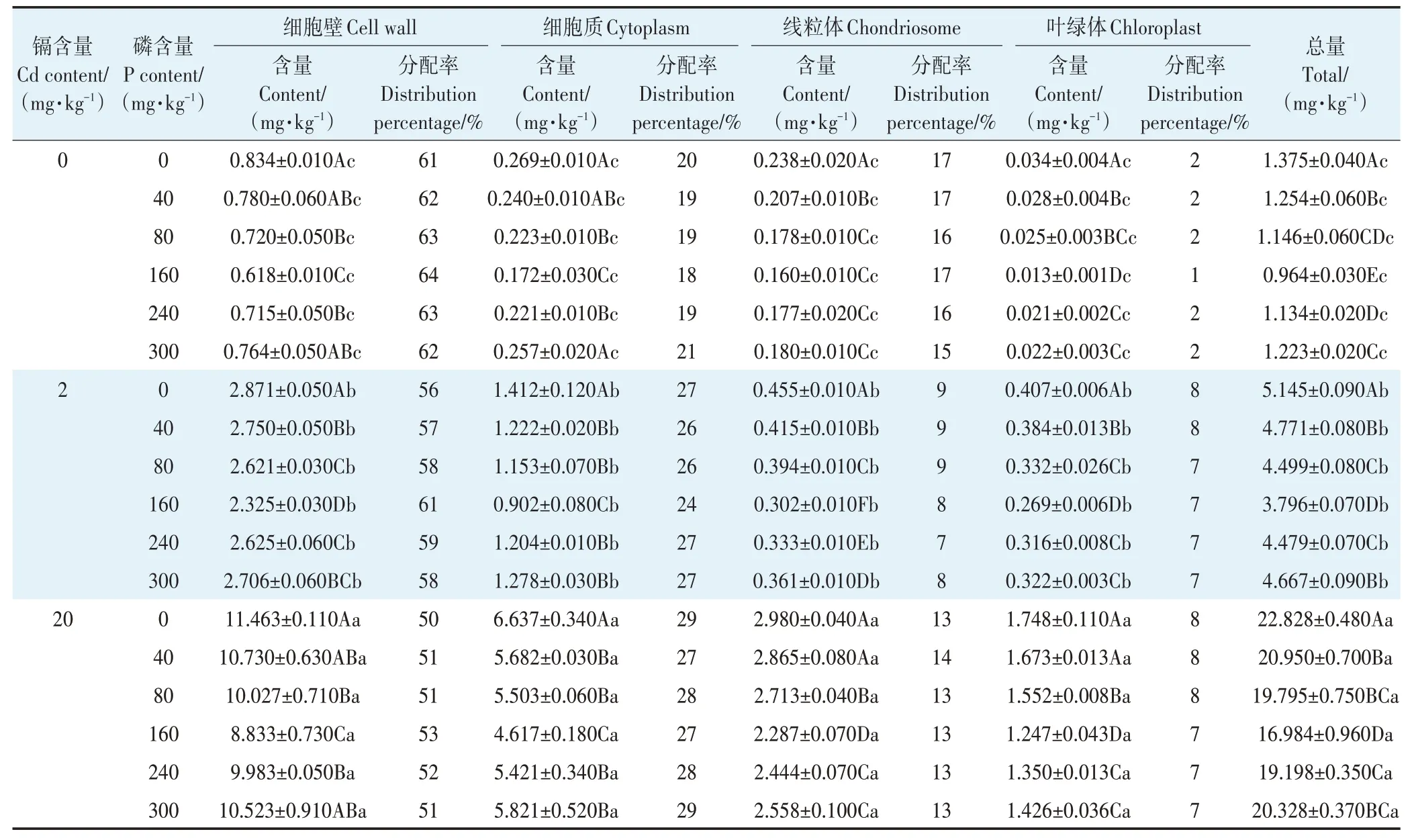
表1 磷素对不同含量镉胁迫下紫花苜蓿叶片亚细胞镉含量及分配率的影响Table 1 Effects of phosphorus on subcellular cadmium content and distribution percentage in alfalfa leaves under different contents of cadmium
2.3 磷素对镉胁迫下紫花苜蓿镉含量和累积量的影响
在相同镉处理含量下,随施磷水平的增加,地上部和地下部镉含量显著降低,镉累积量先增加后减少;在相同施磷水平下,随镉处理含量的增加,地上部和地下部镉含量及镉累积量均显著增加,且地下部镉含量、镉累积量均大于地上部(表2)。在20 mg·kg-1镉处理下未施磷时,转运系数和地上部镉累积量达到最大值,分别为0.35和65.06µg·pot-1。

表2 磷素对不同含量镉胁迫下紫花苜蓿镉含量和累积量的影响Table 2 Effects of phosphorus on Cd content and accumulation of alfalfa under different contents of cadmium
2.4 磷素对镉胁迫下紫花苜蓿MDA 含量和抗氧化酶活性的影响
在相同镉处理含量下,随施磷水平的增加,MDA含量表现出先降低后增加的趋势(图2)。在未受到镉胁迫时,与未施磷处理相比较,40、80、160 mg·kg-1磷处理下MDA含量分别下降了40.7%、48.7%、75.9%,240、300 mg·kg-1磷处理下MDA 含量分别上升了59.3%、102.5%;在2 mg·kg-1镉处理下,与未施磷处理相比较,40、80、160 mg·kg-1磷处理下MDA 含量分别下降了35.7%、54.8%、72.7%,240、300 mg·kg-1磷处理下MDA含量分别上升了27.3%、48.0%;在20 mg·kg-1镉处理下,与未施磷处理相比较,40、80、160 mg·kg-1磷处理下MDA 含量分别下降了15.5%、42.3%、60.2%,240、300 mg·kg-1磷处理下MDA 含量分别上升了4.8%、18.8%。在相同施磷水平下,随镉处理含量的增加,MDA 含量显著增加。双因素方差分析表明,磷镉交互作用对紫花苜蓿MDA含量存在极显著的影响。

图2 磷素对不同含量镉胁迫下紫花苜蓿丙二醛含量的影响Figure 2 Effects of phosphorus on MDA content of alfalfa under different contents of cadmium
在相同镉含量下,随施磷水平的增加,POD 酶活性表现出先增加后降低的趋势(图3)。在未受到镉胁迫时,与未施磷处理相比较,40、80、160、240、300 mg·kg-1磷处理下POD 酶活性分别增加了22.2%、58.3%、121.7%、55.5%、22.2%;在2 mg·kg-1镉处理下,与未施磷处理相比较,40、80、160、240 mg·kg-1磷处理下POD 酶活性分别增加了23.9%、64.5%、134.2%、37.4%,300 mg·kg-1磷处理下POD 酶活性降低了14.5%;在20 mg·kg-1镉处理下,与未施磷处理相比较,40、80、160、240 mg·kg-1磷处理下POD 酶活性分别增加了23.4%、69.0%、124.2%、49.5%,300 mg·kg-1磷处理下POD 酶活性降低了32.2%。在0~240 mg·kg-1磷水平下,随镉含量的增加,POD 酶活性先增加后降低;300 mg·kg-1磷水平下,随镉含量的增加,POD酶活性显著降低。2 mg·kg-1镉处理下,施160 mg·kg-1磷时,POD 酶活性达到最大值17.33µmol·g-1。双因素方差分析表明,磷镉交互作用对紫花苜蓿POD酶活性存在极显著的影响。
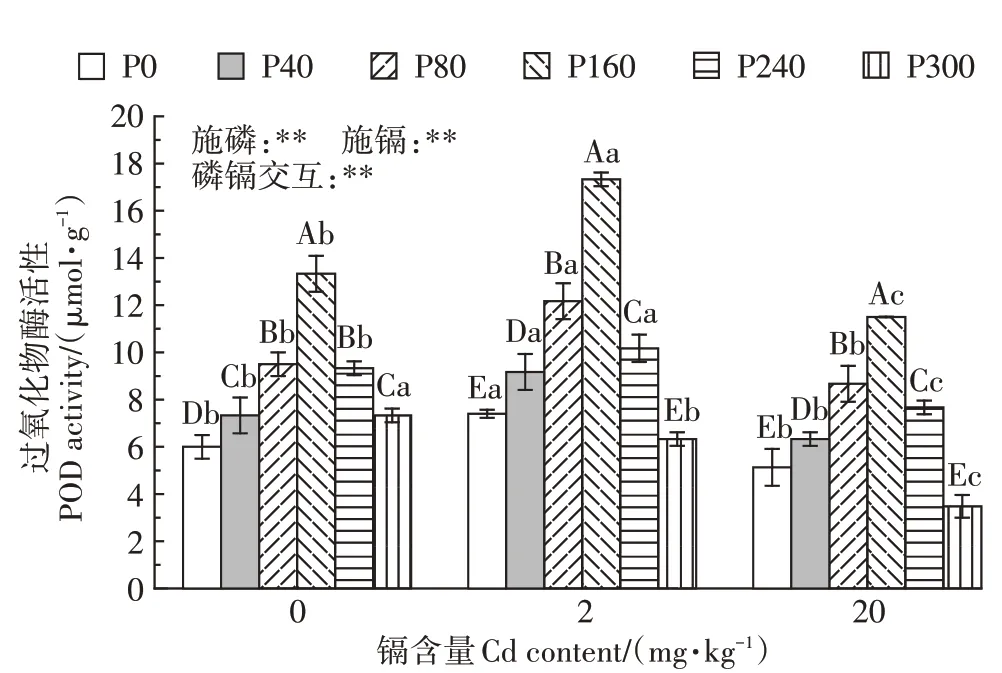
图3 磷素对不同含量镉胁迫下紫花苜蓿过氧化物酶活性的影响Figure 3 Effects of phosphorus on POD activity of alfalfa under different contents of cadmium
在相同镉含量下,随施磷水平的增加,SOD 酶活性表现出先增加后降低的趋势(图4)。在未受到镉胁迫时,与未施磷处理相比较,40、80、160、240、300 mg·kg-1磷处理下SOD 酶活性分别增加了22.7%、52.2%、73.6%、47.2%、6.9%;在2 mg·kg-1镉处理下,与未施磷处理相比较,40、80、160、240、300 mg·kg-1磷处理下SOD 酶活性分别增加了64.6%、70.0%、106.6%、57.4%、9.2%;在20 mg·kg-1镉处理下,与未施磷处理相比较,40、80、160、240 mg·kg-1磷处理下SOD酶活性分别增加了38.3%、44.5%、62.5%、35.7%,300 mg·kg-1磷处理下SOD酶活性降低了3.3%。在相同施磷水平下,随镉含量的增加,SOD 酶活性先增加后降低。2 mg·kg-1镉处理下,施160 mg·kg-1磷时,SOD 酶活性达到最大值231.84 µmol·g-1。双因素方差分析表明,磷镉交互作用对紫花苜蓿SOD 酶活性存在极显著的影响。
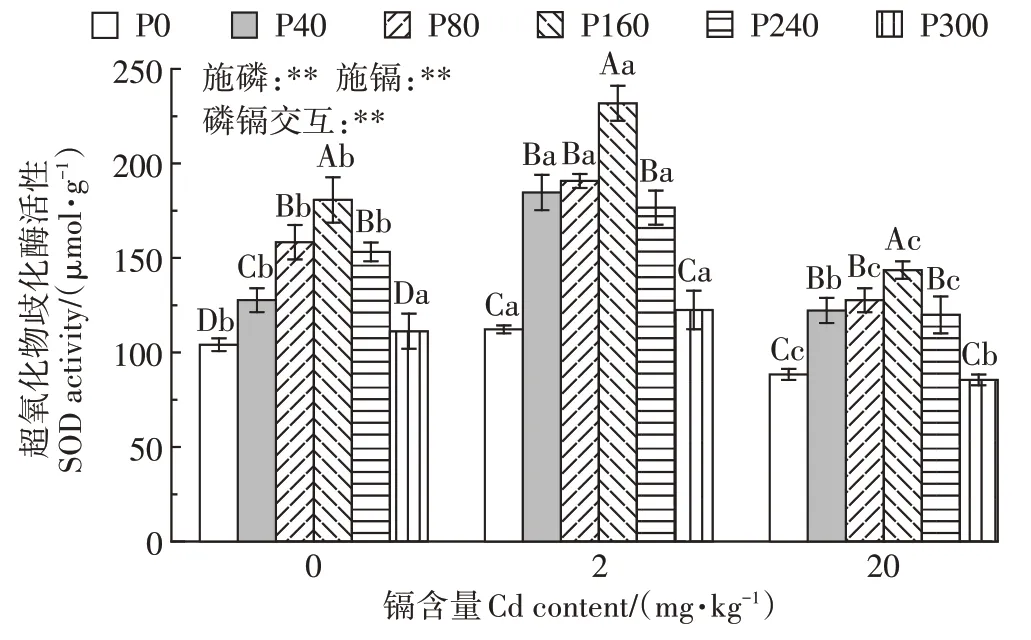
图4 磷素对不同含量镉胁迫下紫花苜蓿超氧化物歧化酶活性的影响Figure 4 Effects of phosphorus on SOD activity of alfalfa under different contents of cadmium
在相同镉含量下,随施磷水平的增加,CAT 酶活性呈现出先增加后降低的趋势(图5)。在未受到镉胁迫时,与未施磷处理相比较,40、80、160、240 mg·kg-1磷处理下CAT 酶活性分别增加了17.4%、30.0%、64.7%、22.2%,300 mg·kg-1磷处理下CAT 酶活性降低了7.7%;在2 mg·kg-1镉处理下,与未施磷处理相比较,40、80、160、240、300 mg·kg-1磷处理下CAT 酶活性分别增加了13.1%、18.4%、44.6%、35.4%、10.5%;在20 mg·kg-1镉处理下,与未施磷处理相比较,40、80、160 mg·kg-1磷处理下CAT 酶活性分别增加了6.2%、11.6%、24.5%,240、300 mg·kg-1磷处理下CAT 酶活性降低了4.9%、10.2%。在相同施磷水平下,随镉含量的增加,CAT酶活性显著增加。20 mg·kg-1镉处理下,施160 mg·kg-1磷时,CAT酶活性达到最大值89.07µmol·g-1。双因素方差分析表明,磷镉交互作用对紫花苜蓿CAT酶活性存在极显著的影响。

图5 磷素对不同含量镉胁迫下紫花苜蓿过氧化氢酶活性的影响Figure 5 Effects of phosphorus on CAT activity of alfalfa under different contents of cadmium
3 讨论
本研究中,在相同施磷水平下,随镉含量的增加,紫花苜蓿生物量先增加后减少。这与张杨杨等[19]的研究结果一致,即低含量镉胁迫对百脉根、变异小冠草等植物的生长有一定的促进作用,但随着镉含量的增加,植物生物量降低。镉对生物量的“低促高抑”作用比较普遍[20]。贾月慧等[21]研究发现,高浓度(50~100 mg·L-1)镉的胁迫对生菜(Lactuca sativa)生物量、干质量和鲜质量仍有显著的促进作用,这可能是因为不同植物对镉的吸收及耐受性不同,但总的趋势是高镉对植株的生长有一定的抑制作用[22-23]。在相同镉含量下,随施磷水平的增加,生物量也表现出先增加后减少的趋势。这是由于在低磷处理下,植株吸收大量的磷素,从而促进植物的生长[24]。生物量是衡量紫花苜蓿生产性能的重要指标,施磷过高或过低均会影响其干物质累积量和产量形成,即紫花苜蓿生物量的形成对磷素的吸收存在阈值,在一定范围内施加磷素对紫花苜蓿具有增产作用[25-26]。综上,磷素对镉胁迫下紫花苜蓿生长发育的影响是有一定限度的,施磷量过高反而会对紫花苜蓿产生毒害作用,只有在一定范围内施加磷素才对紫花苜蓿有增产作用。
植物可以调节亚细胞中镉的分布,从而对镉胁迫产生耐性[16]。在本试验中,亚细胞中镉的含量为细胞壁>细胞质>线粒体>叶绿体,这与Wang等[27]的研究结果一致。镉主要分布在细胞壁上,以阻止镉进入细胞质,减少镉对细胞的毒害[28]。在相同施磷水平下,随镉处理含量的增加,叶绿体及细胞质中镉含量增加,而细胞壁及线粒体中镉含量则减少,表明细胞壁对镉的固定能力有限,过多的镉会进入细胞质。在相同施磷水平下,随镉处理含量的增加,各亚细胞器中镉含量均显著增加。在植物细胞中,叶绿体和线粒体是具有重要作用的细胞器,镉含量的增加可能使类囊体发生损伤,导致双膜结构破裂[29],大量的镉进入到叶绿体后,将会严重破坏叶绿体的结构与功能[30]。研究表明,细胞壁中的镉储存量达到一定程度后,镉就会进入细胞质,细胞质中一些小分子物质可以与镉结合并沉淀下来,形成镉耐性[31]。
在相同镉处理含量下,随施磷水平的增加,地上部、地下部镉含量均显著降低。这与邹茸等[32]的研究类似,即施用磷肥可使苋菜地上部镉含量下降15.7%。王朋超等[33]研究也发现,在施用钙镁磷肥和普钙后,油菜地上部分的镉含量分别下降74.4%~79.6%和54.3%~86.7%。这是因为施加钙镁磷肥能有效减少镉在油菜地上部分的迁移,从而使镉在油菜植株根部累积[34]。其作用机制包括:(1)施磷增加土壤pH值,使根系的磷素与镉形成不溶性磷酸盐沉淀,减少根系对镉的吸收和植物体内镉的长距离运输[35];(2)磷素能以CdHPO4和Cd3(PO4)2的形式沉淀镉,降低植株体内镉的迁移能力,从而降低镉对植物的毒害[36];(3)施磷提高了镉胁迫下植物体内抗氧化物酶的活性,减少植株对镉的吸收从而缓解氧化应激,防止膜损伤[37-38]。在相同镉含量下,随施磷水平的增加,地上部、地下部镉累积量先增加后减少,其主要原因是在低磷水平下紫花苜蓿的生物量显著增加,导致镉累积量增加。
在相同施磷水平下,随镉含量的增加,紫花苜蓿叶片中MDA 含量、CAT活性显著增加,POD 和SOD 活性总体上表现出先增加后降低的趋势。在较低含量的镉胁迫下,紫花苜蓿POD、SOD 和CAT 能被活化,从而有效地消除活性氧。在20 mg·kg-1镉处理下,POD 和SOD 活性显著下降,CAT 活性则显著被激活,协同清除植株体内的活性氧,降低高含量镉对膜脂过氧化的影响,说明高含量镉在一定程度上会抑制POD、SOD 的活性。在高含量镉胁迫条件下,植株叶片MDA 的含量高,叶片中SOD 和POD 活力下降,尤其是POD 酶的活性,这说明MDA 的高累积对SOD、POD 活性的影响有一定抑制作用[39],表明不同的镉胁迫含量下,抗氧化酶活化的速率和程度存在差异,这可能与植物的器官和酶的类型有关[11]。
4 结论
(1)在相同磷水平下,镉处理对紫花苜蓿生物量存在“低促高抑”作用。
(2)在相同镉处理含量下,随施磷水平的增加,紫花苜蓿生物量增加,抗氧化酶活性增强,镉主要存在于紫花苜蓿的细胞壁中,植株地上部和地下部中的镉含量显著降低,最多降低了41.7%和39.2%。
(3)在一定范围内施磷能提高紫花苜蓿对镉的耐受能力,缓解镉胁迫对紫花苜蓿的毒害作用,降低紫花苜蓿中镉含量。
