肺炎继发脓毒症患者血清sFasL和s-Met水平及预后评估价值
2023-11-08余秉昌赖震宇赵展庆谢小芳蔡秋燕
余秉昌 赖震宇 赵展庆 谢小芳 蔡秋燕

摘要:目的 探討肺炎继发脓毒症患者的血清可溶性Fas配体(sFasL)和可溶性间质表皮转化因子(s-Met)的临床预后价值。方法 纳入150例肺炎继发脓毒症患者并根据其入院28 d生存情况分为存活组(96例)和死亡组(54例),另纳入70例肺炎患者为肺炎组,60例体检健康者为对照组。酶联免疫吸附试验检测血清sFasL和s-Met水平。Spearman秩相关分析肺炎继发脓毒症患者sFasL、s-Met水平与序贯器官衰竭评分(SOFA)、快速序贯器官衰竭评分(q-SOFA)的相关性。多因素Logistic回归分析影响肺炎继发脓毒症患者死亡的危险因素。受试者工作特征曲线分析各指标对肺炎继发脓毒症患者死亡的诊断价值。结果 对照组、肺炎组入院即刻及肺炎继发脓毒症组入院时sFasL和s-Met水平依次升高(P<0.05)。与存活组相比,死亡组0、24、48、72及120 h血清sFasL和s-Met水平均较高(均P<0.05)。肺炎继发脓毒症患者血清sFasL、s-Met及PCT与SOFA、q-SOFA呈正相关性(均P<0.01)。较高水平血清PCT、sFasL、s-Met和q-SOFA是影响肺炎继发脓毒症患者死亡的独立危险因素。血清PCT、sFasL、s-Met和q-SOFA联合检测对肺炎继发脓毒症患者死亡预测的曲线下面积(AUC)为0.872(95%CI:0.838~0.909),高于血清PCT、sFasL、s-Met和q-SOFA单项指标检测0.778(95%CI:0.739~0.817)、0.795(95%CI:0.761~0.829)、0.712(95%CI:0.672~0.753)、0.815(95%CI:0.774~0.857),Z分别为6.450、4.305、5.117、2.384(均P<0.05)。结论 肺炎继发脓毒症患者血清sFasL和s-Met是评估肺炎继发脓毒症预后的血清标志物。
关键词:脓毒症;肺炎;预后;可溶性Fas配体;可溶性间质表皮转化因子;序贯器官衰竭评分
中图分类号:R563.1文献标志码:ADOI:10.11958/20230029
The prognostic value of serum sFasL and s-Met levels in patients with
sepsis secondary to pneumonia
YU Bingchang, LAI Zhenyu, ZHAO Zhanqing△, XIE Xiaofang, CAI Qiuyan
Department of Critical Care Medicine, Hainan West Central Hospital, Haikou 571700, China
Corresponding Author E-mail: 1834163815@qq.com
Abstract: Objective To investigate the prognostic value of serum soluble Fas ligand (sFasL) and soluble interstitial epidermal transforming factor (s-Met) in patients with pneumonia and sepsis. Methods A total of 150 patients with pneumonia secondary sepsis were were divided into the survival group (96 cases) and the death group (54 cases) according to the prognosis of 28 days after admission. Seventy patients with pneumonia were selected as the pneumonia group, and 60 healthy people were selected as the control group. Serum sFasL and s-Met levels were detected by ELISA in all subjects. Spearman rank correlation analysis was used for correlation analysis of sFasL, s-Met levels and SOFA, q-SOFA scores in patients with pneumonia secondary sepsis. Multivariate Logistic regression analysis was used to analyze factors influencing the death of patients with pneumonia secondary sepsis. The diagnostic value of each index in death of patients with pneumonia secondary sepsis was analyzed by receiver characteristic operating curve. Results Levels of sFasL and s-Met increased sequentially immediately after admission in the control group, the pneumonia group and the pneumonia combined with sepsis group (P<0.05). Compared with the survival group, serum sFasL and s-Met levels were higher at 0, 24, 48, 72 and 120 h in the death group (P<0.05). Serum PCT, sFasL, s-Met and q-SOFA score were independent risk factors for death of patients with pneumonia secondary sepsis. The area under the curve of the combined detection of serum PCT, sFasL, s-Met, and q-SOFA scores for predicting mortality in patients with pneumonia secondary sepsis was 0.872 (0.838-0.909), which was higher than the single indicator detection of serum PCT, sFasL, s-Met, and q-SOFA scores of 0.778 (0.739-0.817), 0.795 (0.761-0.829), 0.712 (0.672-0.753) and 0.815 (0.774-0.857) (Z=6.450, 4.305, 5.117, 2.384, all P<0.05). Conclusion The serum sFasL and s-Met levels in patients with pneumonia secondary sepsis are serum biomarkers for evaluating the prognosis of pneumonia secondary sepsis patients.
Key words: sepsis; pneumonia; prognosis; soluble Fas ligand; soluble mesenchymal epidermal transforming factor; sequential organ failure assessment
脓毒症是由感染引起的全身性炎症反应综合征,可导致多器官功能障碍,是临床危重患者的重要死因之一[1]。肺炎是脓毒症的最常见病因,约占所有感染原因的70%[2]。C-反应蛋白(C-reactive protein,CRP)、降钙素原(procalcitonin, PCT)等炎症标志物是评估肺炎继发脓毒症的重要指标,但在评估预后方面特异性较差[3]。Fas配体(Fas ligand,FasL)又称CD178,其能够在基质金属蛋白酶作用下裂解为可溶性FasL(soluble FasL,sFasL),进而介导细胞凋亡[4]。研究表明,血清sFasL水平与脓毒症患者疾病严重程度有关,可能是一种新的脓毒症标志物[5]。可溶性间质表皮转化因子(soluble mesenchymal to epithelial transition factor,s-Met)是肝细胞生长因子受体的可溶性形式。研究表明,血浆中s-Met水平能够反映血管内皮细胞c-Met表达情况,并且血浆中s-Met水平与脓毒症内皮损伤程度有关[6]。肺炎继发脓毒症会导致多器官功能障碍,导致患者预后不良。序贯器官衰竭评分(sepsis-related organ failure assessment,SOFA)和快速序贯器官衰竭评分(quick sepsis-related organ failure assessment,q-SOFA)是评估器官功能障碍的严重程度的重要指标,广泛应用于脓毒症患者的预后评估[7]。本研究通过检测肺炎继发脓毒症患者血清sFasL、s-Met水平,分析sFasL、s-Met水平与SOFA、q-SOFA的相关性及其在肺炎继发脓毒症患者中的临床预后价值。
1 资料与方法
1.1 —般资料 选取2019年2月—2021年2月于海南西部中心医院诊治的150例肺炎继发脓毒症患者(肺炎继发脓毒症组)为研究对象,男86例,女64例,平均年龄(63.57±10.75)岁;根据入院28 d的生存情况分为存活组96例和死亡组54例。选取同期我院诊治的70例肺炎患者为肺炎组,男40例,女30例,平均年龄(62.72±9.46)岁。同期60例体检健康人群作为对照组,男36例,女24例,平均年龄(64.03±11.46)岁。纳入标准:(1)肺炎的诊断符合美国胸科协会和感染性疾病协会2016年制定的《医院获得性肺炎和社区获得性肺炎诊治指南》[8]。(2)肺炎继发脓毒症诊断符合2016年《国际脓毒症会议制定的脓毒症3.0诊断标准》[9]。(3)初次诊治,未接受抗菌药物、激素等药物治疗者。(4)病史、实验室检查等临床资料完整。排除標准:(1)合并各系统恶性肿瘤。(2)年龄<18周岁。(3)妊娠或哺乳期。(4)入院后24 h内死亡。(5)患肝硬化、慢性心力衰竭、肺源性心脏病等严重慢性病,以及脑梗死、脑出血、心肌损伤、肾功能衰竭及自身免疫系统疾病。3组性别(χ2=0.270)、年龄(F=4.546)差异均无统计学意义(P>0.05)。本研究符合医学伦理学标准,并经医院伦理委员会批准(M2018-0037)。患者及家属对本研究知情同意并签字。
1.2 主要仪器与试剂 人sFasL酶联免疫吸附试验试剂盒(货号RQ-E10057)购自深圳瑞清生物公司。s-Met酶联免疫吸附试验试剂盒(货号ZK-398637)购自上海臻科生物公司。Varioskan LUX全波长酶标仪购自美国赛默飞世尔科技公司。RS-28高速低温离心机购自德国贺利氏公司。MilliQ超纯水仪购自美国Millipore公司。
1.3 治疗方法 除对照组外,所有患者入院后均接受规范治疗,包括吸氧、雾化吸入、化痰、升血压、抗生素(包括β-内酰胺类、碳青霉烯类、利奈唑胺及氟喹诺酮类)、适量糖皮质激素、维持水电解质平衡及辅助机械通气干预等。
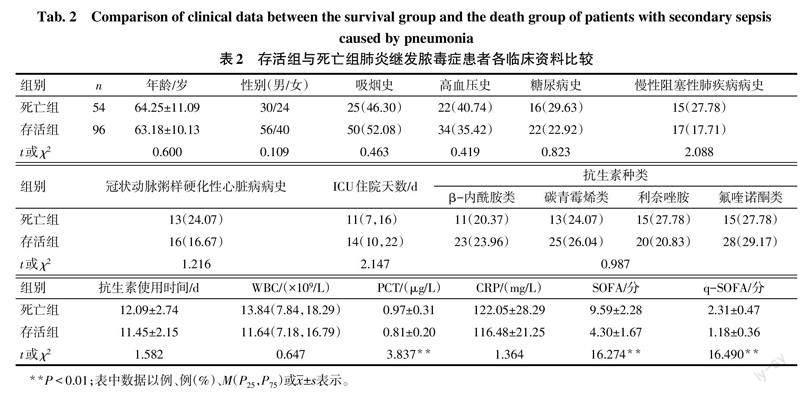
1.4 观察指标 收集患者一般临床资料,包括性别、年龄、吸烟史、高血压史、糖尿病史、慢性阻塞性肺疾病病史、冠状动脉粥样硬化性心脏病病史、重症监护室(ICU)住院天数及患者入院28 d预后情况。收集患者入院24 h内实验室检查指标,包括白细胞计数(WBC)、PCT、CRP。根据入院24 h内患者体温、呼吸、心率、收缩压、血常规﹑肝肾功能及精神状态等,进行SOFA(0~24分,评分越高疾病严重程度越重)和q-SOFA(0~3分,评分越高疾病严重程度越重)。
1.5 不同时间点血清sFasL和s-Met检测 分别留取肺炎继发脓毒症组入院即刻(0 h)、24 h、48 h、72 h及120 h的静脉血2 mL,肺炎组入院即刻的静脉血2 mL,对照组健康体检时清晨空腹静脉血2 mL,均予3 000 r/min离心10 min,取上层血清保存于-20 ℃冰箱待测。采用酶联免疫吸附试验(双抗体夹心法)检测血清sFasL和s-Met水平。实验步骤按说明书进行,酶标仪检测各孔450 nm波长处的光密度(OD)值,并根据标准品浓度的OD值,计算每孔样品的浓度值。
1.6 统计学方法 采用SPSS 22.0软件进行数据分析。符合正态分布的计量资料以x±s表示,2组间比较采用2独立样本t检验,多组间均数比较采用单因素方差分析,组间多重比较采用SNK-q检验。重复测量资料用2因素重复测量方差分析。偏态分布的计量资料以M(P25,P75)表示,组间比较采用Mann-whitney U检验。计数资料以例或例(%)表示,组间比较采用χ2检验。相关性分析采用Spearman秩相关。多因素Logistic回归和受试者工作特征(ROC)曲线分析影响肺炎继发脓毒症患者死亡的危险因素,曲线下面积比较采用DeLong's检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组血清sFasL和s-Met水平比较 对照组、肺炎组及肺炎继发脓毒症组sFasL和s-Met水平依次升高(P<0.05),见表1。
2.2 死亡组和存活组一般资料比较 与死亡组比较,存活组血清PCT、SOFA、q-SOFA降低(均P<0.01),见表2。
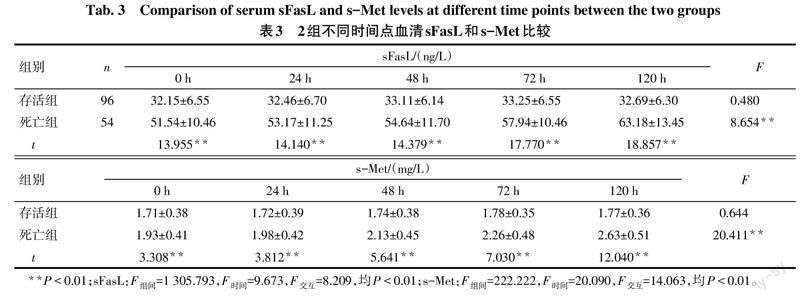
2.3 死亡组和存活组不同时间点血清sFasL和s-Met比较 与存活组相比,死亡组0、24、48、72及120 h血清sFasL和s-Met水平均升高(均P<0.01),死亡组血清sFasL,s-Met水平随时间呈增高趋势(均P<0.01),见表3。
2.4 肺炎继发脓毒症患者血清指标与SOFA、q-SOFA的相关性 肺炎继发脓毒症患者血清sFasL、s-Met、PCT与SOFA呈正相关(rs分别为0.745、0.769和0.810,均P<0.01),与q-SOFA亦呈正相关(rs分别为0.789,0.804和0.821,均P<0.01)。
2.5 影响肺炎继发脓毒症患者死亡的多因素Logistic回归分析 以肺炎继发脓毒症患者28 d内是否发生死亡(存活=0,死亡=1)为因变量,以PCT、sFasL、s-Met、SOFA和q-SOFA为自变量,多因素Logistic回归分析结果显示,较高水平PCT、sFasL、s-Met和q-SOFA是影响肺炎继发脓毒症患者死亡的独立危险因素(P<0.05),见表4。
2.6 各指标对肺炎继发脓毒症患者死亡的预测价值 ROC曲线显示,各指标联合检测(2.5所得回归分析方程)预测肺炎继发脓毒症患者死亡的曲线下面积高于PCT、sFasL、s-Met、SOFA单项指标(Z分别为6.450、4.305、5.117、2.384,P<0.05),见图1、表5。
3 讨论
脓毒症的发病率和病死率均较高[10]。肺炎是导致脓毒症最常见的原因。既往研究显示,肺炎继发脓毒症致死率为30%~70%[11]。本研究亦显示肺炎继发脓毒症患者病死率为36.00%(54/150)。FasL是肿瘤坏死因子膜受体超家族成员,其分泌形式sFasL可结合Fas,激活凋亡的外源性途径,从而促进细胞凋亡。研究表明,在脂多糖诱导脓毒症小鼠动物模型中,心肌细胞活性氧产生增加,心肌细胞出现核碎裂、染色质固缩及凋亡小体增加情况[12]。Duplessis等[13]发现,将循环游离DNA等凋亡途径生物标志物纳入预测模型有助于脓毒症患者的诊断及预后判断。本研究中肺炎继发脓毒症患者血清sFasL较对照组升高,与Lorente等[5]报道结果一致。李英等[14]认为,脓毒症患者血清miRNA-98与sFasL呈负相关,sFasL是miRNA-98的潜在靶标,miRNA-98表达升高能够降低Fas诱导的细胞凋亡。本研究中,肺炎继发脓毒症患者血清sFasL与SOFA和q-SOFA均呈正相關,提示sFasL可能参与促进肺炎继发脓毒症患者疾病进展。分析原因为sFasL结合Fas后能够启动坏死性细胞程序性死亡,抑制Notch信号通路,介导CD4+和CD8+T淋巴细胞死亡,加重炎症和局部组织的损伤[15]。有研究发现,FasL基因敲除的脓毒症小鼠的死亡风险显著降低,并且利用sFasL竞争性融合蛋白治疗脓毒症小鼠能够显著降低病死率[16]。本研究中,死亡组患者血清sFasL水平随时间延续呈逐渐升高趋势,而存活组无明显变化,提示血清sFasL水平升高能够增加肺炎继发脓毒症患者的死亡风险,而较高水平sFasL是影响肺炎继发脓毒症患者死亡的独立危险因素,考虑原因为血清sFasL水平升高可激活胱天蛋白酶8,导致细胞钙超载、活性氧生成与腺苷三磷酸耗竭,增加细胞坏死率,加重患者不良预后。Ou等[17]在脓毒症小鼠中利用间充质干细胞衍生的凋亡囊泡阻断Fas/FasL通路的研究显示,该方案可促进中性粒细胞凋亡,改善脓毒性小鼠的多器官功能障碍并提高其存活率。因此,以sFasL为靶点的治疗可能有助于改善肺炎继发脓毒症患者的预后。
激活肝细胞生长因子/c-Met通路能够稳定细胞骨架,保持血管内皮细胞间质的连接,从而在脓毒症发生、发展过程中发挥保护性作用[18-19]。s-Met是肝细胞生长因子的膜受体c-Met的可溶性形式,能够反映c-Met水平。本研究中,肺炎继发脓毒症患者血清s-Met升高,与既往研究结果一致[6]。脓毒症发生时,机体中性粒细胞被大量激活并聚集于受损的组织中,分泌产生大量基质金属蛋白酶-9、去整合素等,将c-Met的细胞外段剪切形成可溶性的s-Met,导致血清s-Met水平升高[6]。本研究结果显示,血清s-Met与肺炎继发脓毒症患者病情严重程度呈正相关。作为c-Met的可溶性形式,s-Met能够与肝细胞生长因子竞争性结合,抑制肝细胞生长因子/c-Met通路激活,促进炎症组织损伤[20]。有研究报道,在肝脏敲除s-Met基因表达的脓毒症小鼠中,肝细胞肿瘤坏死因子-α等炎性因子释放减少,肝细胞凋亡率降低,动物存活率升高[19]。本研究中,死亡组患者入院后血清s-Met水平随时间延续呈逐渐升高的趋势,表明监测肺炎继发脓毒症患者血清s-Met水平动态变化可有助于评估肺炎继发脓毒症患者的死亡风险。多因素Logistic回归分析结果亦显示,较高水平s-Met是影响肺炎继发脓毒症患者死亡的危险因素,表明血清s-Met升高可提示肺炎继发脓毒症患者预后不良。
PCT是临床常用的脓毒症生物标志物。本研究中PCT在诊断肺炎继发脓毒症患者死亡的截断值为0.92 μg/L,低于既往文献报道的1.82 μg/L[21]。笔者分析,肺炎继发脓毒症患者可能同时存在真菌、病毒感染或混合感染,而在非细菌性感染性疾病中PCT不升高。因此,单一用于PCT评估肺炎继发脓毒症预后的准确性和有效性受到一定的限制。本研究中,血清PCT、sFasL、s-Met和q-SOFA联合检测相比于比任何单一因素更为准确,可以有效评估肺炎继发脓毒症患者的临床短期预后。
综上所述,肺炎继发脓毒症患者血清sFasL和s-Met水平升高,两者与SOFA和qSOFA呈正相关,能反映肺炎继发脓毒症患者病情严重程度。血清PCT、sFasL、s-Met评分和q-SOFA评分均为影响肺炎继发脓毒症患者死亡的危险因素,四者联合检测对肺炎继发脓毒症患者死亡具有较高的诊断价值。但本研究为单中心研究,样本量有限,结果可能存在一定偏倚,有待今后设计多中心大样本临床实验进一步研究。
参考文献
[1] 王海波,时详,王宇,等. IL-8和GRO-α与U-HBP评估ICU脓毒症患者预后的临床价值[J]. 中华医院感染学杂志,2023,33(2):161-165. WANG H B,SHI X,WANG Y,et al. The clinical value of evaluating the prognosis of ICU sepsis patients with U-HBP,IL-8 and GRO-α[J]. Chin J Nosocomiol,2023,33(2):161-165. doi:10.11816/cn.ni.2023-213102.
[2] 周燕南,周思穎,慕婉晴,等. 血清炎性标志物连续监测联合序贯器官衰竭评分对肺部感染所致脓毒症患者预后的评估价值[J]. 中国临床医学,2021,28(3):364-369. ZHOU Y N,ZHOU S Y,MU W Q,et al. The value of continuous monitoring of serum inflammatory markers combined with sequential organ failure score in evaluating the prognosis of patients with sepsis caused by pulmonary infection[J]. Chin J Clin Med,2021,28(3):364-369. doi:10.12025/j.issn.1008-6358.2021.20202056.
[3] PIERRAKOS C,VELISSARIS D,BISDORFF M,et al. Biomarkers of sepsis:time for a reappraisal[J]. Crit Care,2020,24(1):287-295. doi:10.1186/s13054-020-02993-5.
[4] SALEKI K,BANAZADEH M,MIRI N S,et al. Triangle of cytokine storm,central nervous system involvement,and viral infection in COVID-19:the role of sFasL and neuropilin-1[J]. Rev Neurosci,2022,33(2):147-160. doi:10.1515/revneuro-2021-0047.
[5] LORENTE L,MARTIN M M,ORTIZ-LOPEZ R,et al. Serum sFasL concentrations and mortality prediction in patients with sepsis[J]. Infect Dis(Lond),2021,53(8):643-646. doi:10.1080/23744235.2021.1901982.
[6] 王利公,白凯,陶慧,等. 血清HGF、MMP-9及s-Met水平对脓毒症患者预后的评估价值[J]. 中国急救复苏与灾害医学杂志,2022,17(6):759-762,771. WANG L G,BAI K,TAO H,et al. The prognostic value of serum HGF,MMP-9,and s-Met levels in sepsis patients[J]. Chin J Emerg Resus Disaster Med,2022,17(6):759-762,771. doi:10.3969/j.issn.1673-6966.2022.06.016.
[7] WANG Z,HE Y,ZHANG X,et al. Prognostic accuracy of SOFA and qSOFA for mortality among children with infection:a Meta-analysis[J]. Pediatr Res,2022,4(5):114-120. doi:10.1038/s41390-022-02213-6.
[8] KALIL A C,METERSKY M L,KLOMPAS M,et al. Executive Summary:Management of Adults With Hospital-acquired and Ventilator-associated Pneumonia:2016 Clinical Practice Guidelines by the Infectious Diseases Society of America and the American Thoracic Society[J]. Clin Infect Dis,2016,63(5):575-582. doi:10.1093/cid/ciw504.
[9] SINGER M,DEUTSCHMAN C S,SEYMOUR C W,et al. The third international consensus definitions for sepsis and septic shock(Sepsis-3)[J]. JAMA,2016,315(8):801-810. doi:10.1001/jama.2016.0287.
[10] RUDD K E,JOHNSON S C,AGESA K M,et al. Global,regional,and national sepsis incidence and mortality,1990-2017:analysis for the Global Burden of Disease Study[J]. Lancet,2020,395(10219):200-211. doi:10.1016/S0140-6736(19)32989-7.
[11] CECCONI M,EVANS L,LEVY M,et al. Sepsis and septic shock[J]. Lancet,2018,392(10141):75-87. doi:10.1016/S0140-6736(18)30696-2.
[12] QI Z,WANG R,LIAO R,et al. Neferine ameliorates sepsis-induced myocardial dysfunction through anti-apoptotic and antioxidative effects by regulating the PI3K/AKT/mTOR signaling pathway[J]. Front Pharmacol,2021,12(8):7062-7071. doi:10.3389/fphar.2021.706251.
[13] DUPLESSIS C,GREGORY M,FREY K,et al. Evaluating the discriminating capacity of cell death(apoptotic) biomarkers in sepsis[J]. J Intensive Care,2018,6(5):72-80. doi:10.1186/s40560-018-0341-5.
[14] 李英,邓超,计超. 微小RNA-98与脓毒症患者可溶性自杀相关因子/配体系统、疾病严重程度及短期预后关系研究[J]. 创伤与急危重病医学,2022,10(2):105-109,114. LI Y,DENG C,JI C. A study on the relationship between small RNA-98 and soluble suicide related factors/ligand systems,disease severity,and short-term prognosis in sepsis patients[J]. Trau and Crit Care Med,2022,10(2):105-109,114. doi:10.16048/j.issn.2095-5561.2022.02.07.
[15] JIN B,LIANG Y,LIU Y,et al. Notch signaling pathway regulates T cell dysfunction in septic patients[J]. Int Immunopharmacol,2019,76(5):1059-1067. doi:10.1016/j.intimp.2019.105907.
[16] MESSER M P,KELLERMANN P,WEBER S J,et al. Silencing of fas,fas-associated via death domain,or caspase 3 differentially affects lung inflammation,apoptosis,and development of trauma-induced septic acute lung injury[J]. Shock,2013,39(1):19-27. doi:10.1097/SHK.0b013e318277d856.
[17] OU Q,TAN L,SHAO Y,et al. Electrostatic charge-mediated apoptotic vesicle biodistribution attenuates sepsis by switching neutrophil NETosis to apoptosis[J]. Small,2022,18(20):2200-2206. doi:10.1002/smll.202200306.
[18] TSUJIMOTO H,HORIGUCHI H,MATSUMOTO Y,et al. A potential mechanism of tumor progression during systemic infections via the hepatocyte growth factor(HGF)/c-Met signaling pathway[J]. J Clin Med,2020,9(7):1258-1264. doi:10.3390/jcm9072074.
[19] GIEBELER A,BRANDENBURG L O,KALDENBACH M,et al. Lack of hepatic c-Met and gp130 expression is associated with an impaired antibacterial response and higher lethality after bile duct ligation[J]. Lab Invest,2012,92(12):1726-37. doi:10.1038/labinvest.2012.122.
[20] FIESTAS V E,DE R C,DE E L. The role of growth factors in the pathogenesis of dengue:a scoping review[J]. Pathogens,2022,11(10):478-485. doi:10.3390/pathogens11101179.
[21] 陳静波. C-反应蛋白、降钙素原对脓毒症患者早期诊断及病情评估的应用价值[J]. 国际检验医学杂志,2020,41(2):242-244. CHEN J B. The value of C-reactive protein and pro Calcitonin in the early diagnosis and assessment of sepsis[J]. Inter J Lab Med,2020,41(2):242-244. doi:10.3969/j.issn.1673-4130.2020.02.029.
(2023-01-08收稿 2023-04-19修回)
(本文编辑 陆荣展)
