一叶萩碱对大鼠脑缺血再灌注损伤后神经功能的影响
2023-11-08张金武谢丁玲陈莉
张金武 谢丁玲 陈莉
摘要:目的 基于Toll樣受体4(TLR4)/核转录因子-κB(NF-κB)通路,探讨一叶萩碱(SE)对大鼠脑缺血再灌注损伤(CIRI)后神经功能的影响及相关机制。方法 100只成年SD大鼠随机分为假手术组(Sham组),模型组(CIRI组),SE低、中、高剂量组,每组20只。采用线栓法建立大鼠CIRI模型,建模成功后立即腹腔注射低、中、高剂量(20 mg/kg、40 mg/kg、80 mg/kg)的SE,连续3 d,Sham组与CIRI组给予等量生理盐水。术后24、48、72 h,参照Longa法对各组大鼠进行神经功能缺损评分;术后72 h,干湿重法测定大鼠脑组织含水量,2,3,5-氯化三苯基四氮唑(TTC)染色评估大鼠脑梗死体积百分比,Western blot检测大鼠脑组织离子钙结合衔接分子1(Iba-1)、TLR4、NF-κB p65和p-NF-κB p65蛋白表达,酶联免疫吸附试验(ELISA)检测大鼠脑组织白细胞介素(IL)-1β、肿瘤坏死因子-α(TNF-α)和IL-6水平,免疫荧光染色检测小胶质细胞活化和神经元存活情况。结果 与Sham组相比,CIRI组大鼠神经功能缺损评分、脑组织含水量升高,脑梗死体积百分比增大,脑组织中TLR4、p-NF-κB p65、Iba-1、IL-1β、TNF-α和IL-6表达水平升高(P<0.05)。中、高剂量的SE可降低大鼠CIRI后神经功能缺损评分和损伤后脑组织含水量,降低脑梗死体积百分比及损伤区域TLR4、p-NF-κB p65、Iba-1蛋白表达水平及IL-1β、TNF-α和IL-6水平(P<0.05)。结论 SE可通过抑制TLR4/NF-κB通路激活降低大鼠CIRI后神经炎症反应,发挥脑保护作用。
关键词:脑缺血;再灌注损伤;TLR4/NF-κB通路;一叶萩碱;炎性因子
中图分类号:R743.3文献标志码:ADOI:10.11958/20221801
The effect of securinine on neurological function recovery after cerebral ischemia-reperfusion injury in rats
ZHANG Jinwu, XIE Dingling, CHEN Li
Department of Neurology, Xianning Central Hospital, the First Affiliated Hospital of Hubei University of Science and Technology, Xianning 437100, China
Corresponding Author E-mail: easy1851@eyou.com
Abstract: Objective To explore the effect and mechanism of securinine (SE) on cerebral ischemia reperfusion injury (CIRI) in rats based on toll-like receptor 4 (TLR4)/nuclear transcription factor-kappa B (NF-κB) pathway. Methods A total of 100 male or female adult SD rats were randomly divided into the sham group, the CIRI group and the SE low-, medium- and high-dose (20 mg/kg, 40 mg/kg, 80 mg/kg) groups, with 20 rats in each group. The rat model of CIRI was established by thread occlusion. Rats were treated with SE (20 mg/kg, 40 mg/kg and 80 mg/kg) immediately after successful modeling for 3 consecutive days. Rats in the sham group and the CIRI group were given the same amount of normal saline. At 24 h, 48 h and 72 h after operation, the neurological deficits of rats were measured according to Longa score. At 72 h after operation, brain tissue water content was evaluated by wet-dry weight method, and the percentage of cerebral infarction volume was assessed by triphenyltetrazolium chloride (TTC) staining. Protein expression levels of Iba-1,TLR4, NF-κB p65 and p-NF-κB p65 in brain tissue were determined by Western blot assay. Expression levels of inflammatory factors such as interleukin-1β (IL-1β), tumor necrosis factor-α (TNF-α) and IL-6 were detected by enzyme-linked immunosorbent assay (ELISA). Level of microglia activation and the number of surviving neurons were examined by immunofluorescence staining. Results Compared with the sham group, neurological function scores, brain tissue water content and the percentage of cerebral infarction volume were significantly increased in the CIRI group (all P<0.05). Expression levels of TLR4, p-NF-κB p65, Iba-1, IL-1β, TNF-α and IL-6 in brain tissue were significantly increased (all P<0.05). However, medium- and high-doses of SE could significantly alleviate the neurological deficits, reduce the water content of brain tissue and the size of cerebral infarction volume, decrease expression levels of TLR4, p-NF-κB p65, Iba-1, IL-1β, TNF-α and IL-6 in the injured area of brain tissue in rats. Conclusion SE can alleviate CIRI-induced neuroinflammatory response via inhibiting TLR4/NF-κB pathway activation, thereby conferring a protective role in brain of rats.
Key words: brain ischemia; reperfusion injury; TLR4/NF-κB pathway; securinine; inflammatory factors
缺血性脑卒中是一种严重的急性脑血管疾病,具有高发病率、高致残率和高死亡率等特点[1]。早期恢复局部脑血流量是治疗脑卒中的关键,然而脑血管再通后可能进一步诱发脑组织损伤和加重神经功能缺损,即脑缺血再灌注损伤(cerebral ischemia reperfusion injury,CIRI)[2]。CIRI的损伤机制错综复杂,主要涉及离子失衡、血脑屏障(BBB)损伤、能量代谢障碍、兴奋性氨基酸细胞毒性、炎症反应和氧化应激等多个病理过程,其中炎症反应是CIRI发生发展的重要病理机制[3]。大量研究显示,减轻大鼠炎症反应可以改善CIRI后的神经功能[4-5]。因此,抑制CIRI后炎症反应的激活,减少促炎因子的释放,对改善脑损伤具有显著的意义。一叶萩碱(securinine,SE)又名一叶碱,是一种从植物根部提取的生物碱[6],已经证实SE可以特异性拮抗γ-氨基丁酸(GABA)A受体的活性,因此被广泛应用于中枢神经系统疾病的治疗,如肌萎缩侧索硬化症[7]、小儿麻痹症[8]和多发性硬化症[9]。近年来,体内外相关研究发现,SE在帕金森病(Parkinson's disease,PD)中发挥着显著的抗炎和神经保护作用[10-11]。然而有关SE在CIRI中应用的研究尚鲜见报道。基于此,本研究旨在探讨SE对大鼠CIRI后神经功能的影响及其可能的作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 2月龄清洁级成年SD大鼠100只,雌雄各半,体质量(200±20)g,购自辽宁长生生物技术股份有限公司,动物生产许可证号:SCXK(辽)2020-0001。所有动物饲养于温度(22±2)℃,湿度50%±20%,自由饮水和摄食,12 h昼夜规律交替的动物房中。本研究所有动物实验均遵循“国家实验动物护理和使用健康研究所指南”(NIH出版物No.80-23)进行,并获得湖北科技学院动物伦理委员会批准(编号:2020-01-900)。
1.1.2 主要试剂与仪器 线栓(北京西浓科技有限公司),SE(纯度>98%,中国源叶生物科技有限公司),离子钙结合衔接分子1(Iba-1)、Toll样受体4(TLR4,美国Santa Cruz公司),核转录因子-κB(NF-κB)p65/p-p65、β-actin、辣根过氧化物酶(HRP)标记山羊抗兔/鼠IgG H&L(沈阳万类生物科技有限公司),Neuron(美国Millipore公司),荧光二抗兔/鼠(美国ThermoFisfer Scientific公司),大鼠白细胞介素(IL)-1β、肿瘤坏死因子-α(TNF-α)和IL-6酶联免疫吸附试验(ELISA)试剂盒(上海酶联生物科技有限公司),PVDF膜(0.45 ?m,美国Millipore公司),RIPA裂解液、BCA蛋白定量试剂盒、Western blot制胶试剂盒(上海碧云天生物科技有限公司),标准蛋白Maker(上海雅酶生物医药科技有限公司),超敏ECL发光试剂盒(沈阳万类生物科技有限公司)。2,3,5-氯化三苯基四氮唑(TTC,美国Sigma公司),超敏ECL化学发光试剂盒(北京biosharp公司),蛋白电泳仪、转膜装置(美国Bio-Rad公司)。
1.2 方法
1.2.1 动物模型构建 100只大鼠适应性饲养1周后,采用随机数字表法分为假手术组(Sham组),模型组(CIRI组),SE低、中、高剂量组,每组20只。参照改良的Zea-Longa[12]线栓法建立大鼠CIRI模型。过程如下:腹腔注射2%戊巴比妥钠(30 mg/kg)麻醉,满意后,颈部剃毛,皮肤碘伏消毒,沿正中偏右切口分离暴露右颈总、颈内和颈外动脉,结扎右颈总和颈外动脉近心端,颈总动脉头侧端剪口,将线栓从颈内动脉轻柔推至大鼠大脑前动脉,进线长度约20 mm,固定后缝合。线栓阻断2 h后抽出丝线,切口丝线结扎。Sham组仅分离血管,不进行剪口和线栓操作。SE低、中、高剂量组于造模成功后立即腹腔分别注射20、40、80 mg/kg SE,持续3 d。造模成功标志为麻醉清醒后,大鼠提尾时左侧前肢不能前伸,爬行时向患侧偏斜,不能走直线。造模不成功或未到相应时间死亡者被剔除,并按照随机原则及时补充。Sham组与CIRI组腹腔注射等体积的生理盐水。
1.2.2 神经功能缺损评分 术后24、48、72 h,每组随机抽取8只大鼠,由单盲观察者参照Longa评分法进行神经功能缺损评分:0分,无神经功能缺损;1分,轻度神经功能缺损,梗死半球对侧前爪不能完全伸展;2分,中度神经功能缺损,行走时向梗死半球侧转圈;3分,严重神经功能缺损,行走时向梗死半球侧倾倒;4分,无法自发行走,刺激无反应,存在意识丧失。
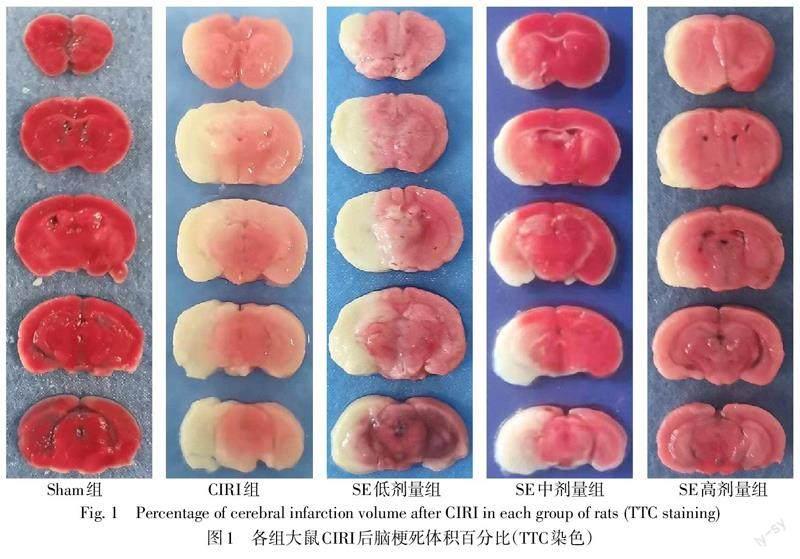
1.2.3 TTC染色检测大鼠脑梗死体积百分比 术后72 h,每组随机抽取5只大鼠,成功麻醉后,立即断头处死并迅速取出大脑组织,于脑切片机上连续切取5个冠状脑片(厚2 mm),随后置于2%的TTC染色液中,37 ℃避光孵育15~20 min,隨即浸于4%多聚甲醛溶液4 ℃固定24 h。将切片平铺于纯色版上扫描,经TTC染色后,正常脑组织显示红色,梗死区域出现白色,梗死体积百分比=(梗死总体积/脑部总体积)×100%,采用Image J软件进行数据分析。
1.2.4 脑含水量的检测 采用干湿重法[13]检测各组大鼠脑含水量变化,用于评估脑水肿的程度。术后72 h,每组随机抽取6只大鼠,成功麻醉后,断头处死,快速分离取出脑组织,放入电子天平称湿质量,随后将脑组织放置105 ℃烘箱中烘烤24 h直至完全烘干,称干质量3次,取其平均值。最后统计各组脑含水量=(湿质量-干质量)/湿质量×100%。
1.2.5 Western blot检测大鼠脑组织Iba-1、TLR4和NF-κB p65蛋白表达 术后72 h,每组随机抽取6只大鼠,成功麻醉后,断头处死。冰上快速取出大脑梗死组织,其中一半组织采用RIPA裂解并提取组织总蛋白,经过BCA法测定蛋白浓度后制备样品。取25 μg蛋白樣品上样,行10% SDS-PAGE,湿转法转膜,室温下封闭液快速封闭12 min后加入一抗Iba-1、TLR4(均1∶200)和NF-κB p65、p-NF-κB p65、β-actin(均1∶1 000),4 ℃摇床孵育过夜,次日回收相应一抗,于0.1 mol/L TBST清洗(5 min×3次)后加入鼠二抗或兔二抗(1∶5 000)室温摇床孵育2 h,再次0.1 mol/L TBST 洗涤(5 min×3次)后ECL显色,以β-actin为内参,通过计算各组蛋白与相应内参的灰度值比值,检测目的蛋白的相对表达水平。
1.2.6 ELISA法检测大鼠脑组织IL-1β、TNF-α和IL-6分子表达 快速收取1.2.5中另一半大鼠脑组织,充分研磨后收取上清液,按照相关ELISA试剂盒说明书步骤检测IL-1β、TNF-α和IL-6的表达水平。
1.2.7 免疫荧光染色检测大鼠脑组织Iba-1和Neuron蛋白表达 术后72 h,每组取3只大鼠,成功麻醉后,立即暴露胸腔,于左心室插管注入提前预冷的生理盐水,剪刀剪破右心耳,待流出清澈液体后,换用4%多聚甲醛灌流直至大鼠颈部强直,肝肠发白,四肢、尾部僵硬后取出右侧损伤脑组织。随后依次将其浸泡于4%多聚甲醛固定及30%蔗糖溶液沉糖。OCT包埋后速冻,连续获取厚度8 ?m冰冻切片,室温放置30 min后,0.1 mol/L PBS清洗(5 min×3次),10%山羊血清室温封闭1 h后加入Iba-1(1∶50)或Neuron(1∶50),4 ℃冰箱孵育过夜。次日,0.1 mol/L PBS清洗(5 min×3次)后滴加1∶400的鼠荧光二抗,室温避光孵育2 h。0.1 mol/L PBS清洗(5 min×3次),DAPI染色8 min并用50%甘油封片,随后荧光显微镜下拍照。
1.3 统计学方法 采用SPSS 25.0进行数据分析。符合正态分布的计量资料以均数±标准差(x±s)表示。2组均数比较采用独立样本t检验,多组间均数比较采用单因素方差分析,组间多重比较行LSD-t法。P<0.05为差异有统计学意义。
2 结果
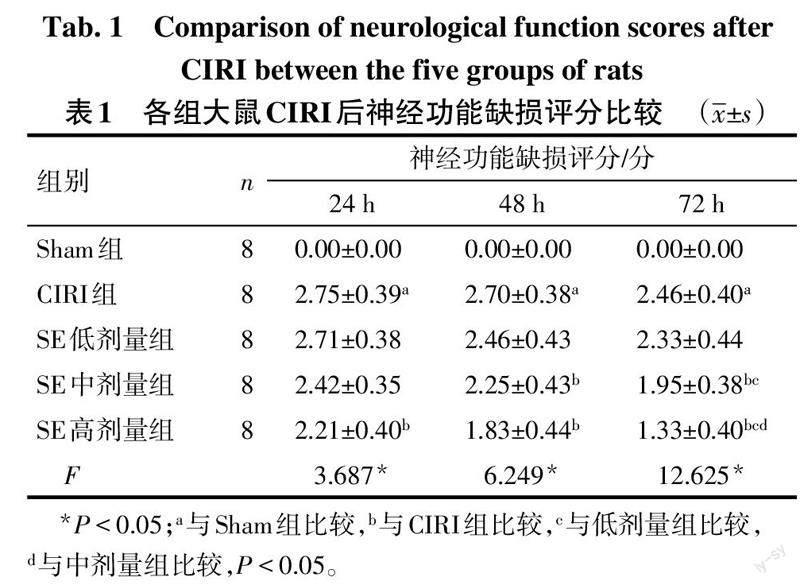
2.1 SE促进大鼠CIRI后神经功能恢复 CIRI组术后24、48和72 h时大鼠神经功能缺损评分均高于Sham组(P<0.05),SE低剂量组与CIRI组比较差异无统计学意义(P>0.05)。除术后24 h时SE中剂量组与CIRI组差异无统计学意义外,SE中、高剂量组大鼠神经功能缺损评分均低于CIRI组(P<0.05)。术后24、48 h时,SE低、中、高剂量组大鼠神经功能缺损评分差异无统计学意义;术后72 h时,SE低、中、高剂量组大鼠神经功能缺损评分依次降低(P<0.05)。见表1。
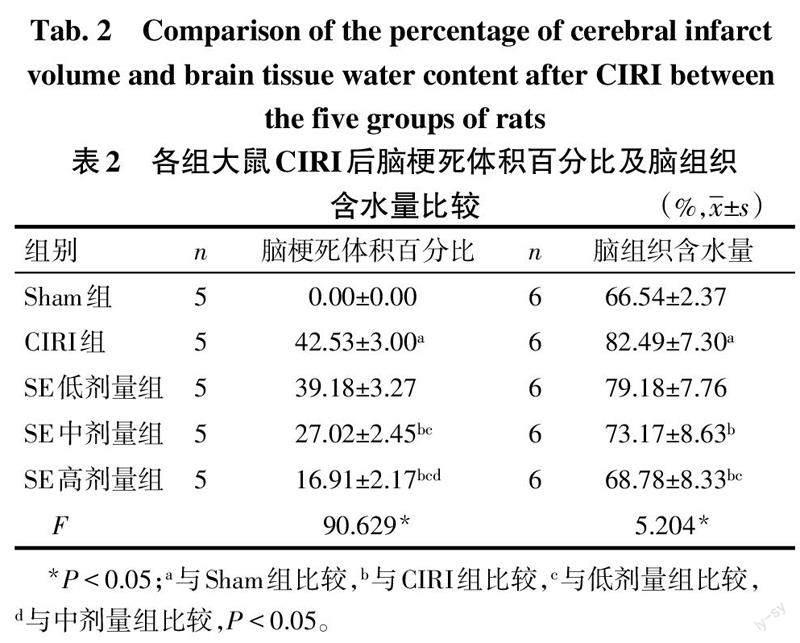
2.2 SE降低大鼠CIRI后脑梗死体积百分比及缓解脑水肿 Sham组大鼠脑组织颜色正常,未见梗死。与Sham组比较,CIRI组大鼠脑梗死体积百分比增大,脑组织含水量增多(P<0.05)。与CIRI组比较,SE低剂量组大鼠脑梗死体积百分比及脑组织含水量差异均无统计学意义;中、高剂量组大鼠脑梗死体积百分比减小,脑组织含水量降低(P<0.05)。SE低、中、高剂量组脑梗死体积百分比依次降低(P<0.05)。见图1、表2。
2.3 SE抑制大鼠CIRI后TLR4、p-NF-κB p65和Iba-1蛋白的表达 与Sham组相比,CIRI组大鼠脑组织TLR4、p-NF-κB p65和Iba-1蛋白表达水平均升高(P<0.05),SE低剂量组与CIRI组差异无统计学意义。SE中、高剂量组大鼠脑组织TLR4、p-NF-κB p65和Iba-1蛋白表达水平均低于CIRI组和SE低剂量组(P<0.05);SE高剂量组脑组织Iba-1蛋白表达水平低于SE中剂量组,TLR4、p-NF-κB p65蛋白表达水平与SE中剂量组差异无统计学意义,见表3、图2。免疫荧光染色检测Iba-1蛋白表达的结果与Western blot一致,见图3。
2.4 SE缓解大鼠ICRI后炎性因子的释放 与Sham组相比,CIRI组促炎因子IL-1β、TNF-α和IL-6水平均升高(P<0.05),SE低剂量组与CIRI组差异无统计学意义。SE低、中、高剂量组IL-1β、TNF-α和IL-6水平依次降低,差异均有统计学意义(P<0.05),见表4。
2.5 SE促进大鼠CIRI后神经元的存活 Sham组大鼠神经元数量较多,形态结构正常,分布均匀。CIRI组大鼠神经元数量显著减少,细胞形态不规则,细胞核破坏明显。低剂量组大鼠神经元数量和形态较CIRI组轻微缓解。中、高剂量组大鼠神经元数量较CIRI组明显增多,细胞形态显著缓解。见图4。
3 讨论
缺血性脑卒中是最常见的脑卒中类型,其发病率呈逐年上升趋势且趋于年轻化,致残率和死亡率均较高[1]。早期有效的溶栓、疏通血管是治疗缺血性脑卒中的关键。但当溶栓治疗后血管再通的同时极易引发CIRI[14]。小胶质细胞介导的炎症反应是CIRI发生的主要原因,在脑缺血再灌注进展中具有显著的负面影响,脑缺血再灌注后刺激小胶质细胞的活化,后者释放大量炎性因子,加重脑组织的损伤并导致神经元的凋亡[5,15]。因此寻求有效的药物治疗、抑制炎性细胞的活化和炎性因子的释放对缓解CIRI和改善神经功能缺损具有重要的作用。
近年来研究发现,SE在阿尔茨海默病(AD)和PD中发挥显著的抗炎、抗氧化应激及抗凋亡作用[16];Lin等[10]在大鼠β-淀粉样蛋白沉积诱导的AD模型中证实,口服SE(20 mg/kg和40 mg/kg)可以有效抑制小胶质细胞介导的炎症反应,缓解大鼠脑认知功能障碍和神经退行性病变。Leonoudakis等[11]通过体外复制PD模型亦证实SE可以有效抑制小胶质细胞和星形胶质细胞的活化,降低TNF-α、IL-1β和IL-6等炎性因子的释放,发挥神经保护作用。此外,有研究显示,SE可以显著促进抑郁大鼠神经元的分化和突触形成,发挥抗抑郁功能[17]。以上研究均提示SE在中枢神经系统疾病中发挥保护性作用,然而SE在大鼠CIRI后相关作用少见报道。本研究通过线栓法建立大鼠右侧CIRI模型,发现大鼠在经历局部脑组织的缺血和再灌注后表现出明显的神经功能障碍,出现脑梗死和水肿,缺血侧脑组织内小胶质细胞显著激活及炎性因子IL-1β、TNF-α、IL-6水平升高;SE低剂量对大鼠CIRI无显著的神经保护作用,SE中、高剂量可降低大鼠CIRI后神经功能缺损评分,减少脑梗死体积,缓解脑组织水肿程度,并且抑制脑组织中Iba-1蛋白的表达及促炎因子IL-1β、TNF-α、IL-6的释放,进而促进神经元的存活,发挥脑损伤保护作用,这与既往研究结果基本一致。另外,本研究结果显示,SE中、高剂量组大鼠在术后72 h神经功能缺损评分和脑梗死体积百分比低于低剂量组,高剂量组大鼠神经功能缺损评分和脑梗死体积百分比低于中剂量组,提示SE对CIRI大鼠的脑保护作用可能具有剂量依赖性。
TLR4是一种模式识别受体,广泛分布于脑室周围血管丛、小胶质细胞和星形胶质细胞,主要参与细胞免疫应答和炎症反应的调控[18]。大鼠局部脑缺血损伤后,TLR4表达水平明显上升,随后活化下游的信号因子NF-κB,促进IL-6、TNF-α等炎性因子的釋放,进一步加重局部缺血再灌注引起的细胞损伤[19]。大量研究已证实,抑制大鼠CIRI后TLR4/NF-κB通路可有效阻止细胞内炎症信号级联反应的扩大,抑制炎性因子的释放,从而发挥神经细胞保护作用[20-21]。本研究进一步探讨SE抑制CIRI诱导炎症的可能机制,通过Western blot检测大鼠CIRI后TLR4和p-NF-κB p65蛋白的表达,结果显示,与Sham组相比,CIRI组TLR4和p-NF-κB p65蛋白表达水平升高,提示CIRI后可诱导TLR4/NF-κB通路的激活;与CIRI组相比,中、高剂量SE可降低TLR4和p-NF-κB p65蛋白表达水平;采用免疫荧光染色评估大鼠CIRI后损伤区域神经元存活情况,发现大鼠CIRI后导致神经元结构破坏及数量减少,给予中、高剂量SE后可显著促进神经元的存活,缓解神经元形态结构的破坏。
综上,SE可以有效缓解大鼠CIRI后脑梗死和水肿程度,改善大鼠损伤后神经功能障碍,促进神经元存活,且其作用机制可能与TLR4/NF-κB通路相关,即SE可通过抑制TLR4/NF-κB通路,降低小胶质细胞介导的炎性因子的释放,发挥抗炎和脑保护作用。本研究亦发现SE在发挥CIRI保护作用时可能具有剂量依赖性,高剂量SE的脑保护效果更加明显。
参考文献
[1] BOOT E,EKKER M S,PUTAALA J,et al. Ischaemic stroke in young adults:a global perspective[J]. J Neurol Neurosurg Psychiatry,2020,91(4):411-417. doi:10.1136/jnnp-2019-322424.
[2] DONG X,WANG L,SONG G,et al. Physcion protects rats against cerebral ischemia-reperfusion injury via inhibition of TLR4/NF-κB signaling pathway[J]. Drug Des Devel Ther,2021,15:277-287. doi:10.2147/DDDT.S267856.
[3] ZHOU X,WANG Z,XU B,et al. Long non-coding RNA NORAD protects against cerebral ischemia/reperfusion injury induced brain damage,cell apoptosis,oxidative stress and inflammation by regulating miR-30a-5p/YWHAG[J]. Bioengineered,2021,12(2):9174-9188. doi:10.1080/21655979.2021.1995115.
[4] XIE X,WANG F,LI X. Inhibition of TRIM14 protects cerebral ischemia/reperfusion injury through regulating NF-κB/NLRP3 pathway-mediated inflammation and apoptosis[J]. J Recept Signal Transduct Res,2022,42(2):197-205. doi:10.1080/10799893.2021.1887218.
[5] ZHENG K,ZHANG Y,ZHANG C,et al. PRMT8 attenuates cerebral ischemia/reperfusion injury via modulating microglia activation and polarization to suppress neuroinflammation by upregulating Lin28a[J]. ACS Chem Neurosci,2022,13(7):1096-1104. doi:10.1021/acschemneuro.2c00096.
[6] CHIRKIN E,ATKATLIAN W,POREE F H. The securinega alkaloids[J]. Chem Biol,2015,74:1-120. doi:10.1016/bs.alkal.2014.11.001.
[7] BEUTLER J A,KARBON E W,BRUBAKER A N,et al. Securinine alkaloids:a new class of GABA receptor antagonist[J]. Brain Res,1985,330(1):135-140. doi:10.1016/0006-8993(85)90014-9.
[8] BURAVTSEVA G R. Result of application of securinine in acute poliomyelitis[J]. Farmakol Toksikol,1958,21(5):7-12. doi:10.1371/journal.pone.0021203.
[9] COPPERMAN R,COPPERMAN G,DER MARDEROSIAN A. From Asia securinine:a central nervous stimulant is used in treatment of amytrophic lateral sclerosis[J]. Pa Med,1973,76(1):36-41.
[10] LIN X,JUN T Z. Neuroprotection by D-securinine against neurotoxicity induced by beta-amyloid(25-35)[J]. Neurol Res,2004,26(7):792-796. doi:10.1179/016164104225014148.
[11] LEONOUDAKIS D,RANE A,ANGELI S,et al. Anti-inflammatory and neuroprotective role of natural product securinine in activated glial cells:Implications for Parkinson's disease[J]. Mediators Inflamm,2017,2017:8302636. doi:10.1155/2017/8302636.
[12] LONGA E Z,WEINSTEIN P R,CARLSON S,et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke,1989,20(1):84-91. doi:10.1161/01.str.20.1.84.
[13] YE Y,JIN T,ZHANG X,et al. Meisoindigo protects against focal cerebral ischemia-reperfusion injury by inhibiting NLRP3 inflammasome activation and regulating microglia/macrophage polarization via TLR4/NF-kappaB signaling pathway[J]. Front Cell Neurosci,2019,13:553. doi:10.3389/fncel.2019.00553.
[14] WU M Y,YIANG G T,LIAO W T,et al. Current mechanistic concepts in ischemia and reperfusion injury[J]. Cell Physiol Biochem,2018,46(4):1650-1667. doi:10.1159/000489241.
[15] CUI Y,ZHANG N N,WANG D,et al. Modified citrus pectin alleviates cerebral ischemia/reperfusion injury by inhibiting NLRP3 inflammasome activation via TLR4/NF-κB signaling pathway in microglia[J]. J Inflamm Res,2022,15:3369-3385. doi:10.2147/JIR.S366927.
[16] NEGANOVA M E,KLOCHKOV S G,AFANASIEVA S V,et al. Neuroprotective effects of the securinine-analogues:Identification of allomargaritarine as a lead compound[J]. CNS Neurol Disord Drug Targets,2016,15(1):102-107. doi:10.2174/1871527314666150821111812.
[17] XIAO H,ZHANG Q,ZHONG P,et al. Securinine promotes neuronal development and exhibits antidepressant-like effects via mtor activation[J]. ACS Chem Neurosci,2021,12(19):3650-3661. doi:10.1021/acschemneuro.1c00381.
[18] LIU Q,ZHANG Y. PRDX1 enhances cerebral ischemia-reperfusion injury through activation of TLR4-regulated inflammation and apoptosis[J]. Biochem Biophys Res Commun,2019,519(3):453-461. doi:10.1016/j.bbrc.2019.08.077.
[19] ZHAO D,JI J,LI S,et al. Skullcapflavone II protects neuronal damage in cerebral ischemic rats via inhibiting NF-κB and promoting angiogenesis[J]. Microvasc Res,2022,141:104318. doi:10.1016/j.mvr.2022.104318.
[20] TIAN X Y,XIE L,WANG W Y,et al. Pomelo peel volatile oil alleviates neuroinflammation on focal cerebral ischemia reperfusion injury rats via inhibiting TLR4/NF-κB signaling pathway[J]. Curr Pharm Biotechnol,2021,22(14):1878-1890. doi:10.2174/1389201022666201231114403.
[21] LIU J,MA W,ZANG C H,et al. Salidroside inhibits NLRP3 inflammasome activation and apoptosis in microglia induced by cerebral ischemia/reperfusion injury by inhibiting the TLR4/NF-κB signaling pathway[J]. Ann Transl Med,2021,9(22):1694. doi:10.21037/atm-21-5752.
(2022-11-14收稿 2023-01-12修回)
(本文編辑 陈丽洁)
