蒙古黄芪皂苷对铅暴露致发育期大鼠神经炎症与肠道菌群紊乱的影响
2023-11-08胡明月李鑫高磊关明杰
胡明月 李鑫 高磊 关明杰

摘要:目的 探討蒙古黄芪皂苷对铅暴露致发育期SD大鼠神经炎症及肠道菌群紊乱的干预效果。方法 40只4周龄SD大鼠随机分为对照(CG)组,铅染毒(LE)组,皂苷低、中、高剂量干预(SL、SM、SH)组,相应干预4周后,氢化物原子荧光光谱法检测大鼠血铅水平,酶联免疫吸附试验检测大鼠海马中肿瘤坏死因子(TNF)-α、白细胞介素(IL)-6、IL-1β水平,16S rDNA高通量测序检测盲肠内容物中肠道菌群的组成。结果 与CG组比较,其余各组血铅水平均升高,LE组海马中TNF-α、IL-6和IL-1β水平升高,肠道菌群α、β多样性显著改变,Shannon指数和Simpson指数降低,罗姆布茨菌属、布劳特氏菌属、毛罗菌科_UCG-001菌属相对丰度减少,而瘤胃球菌属、普雷沃菌科_UCG-001菌属相对丰度增加(P<0.05)。与LE组比较,SL、SM组血铅水平降低(P<0.05),SL组海马IL-6水平、SM组IL-1β及SM、SH组海马TNF-α、IL-6水平降低(P<0.05),SL、SM组β多样性及SM组α多样性显著改善,SM组Simpson指数升高(P<0.05),SH组、SM组瘤胃球菌属、普雷沃菌科_UCG-001菌属相对丰度减少(P<0.05),SM组罗姆布茨菌属、毛罗菌科_UCG-001菌属、布劳特氏菌属及SL组布劳特氏菌属相对丰度均增加(P<0.05)。SM组比SH组增加罗姆布茨菌丰度作用更明显(P<0.05)。结论 蒙古黄芪皂苷可有效抑制铅致发育期大鼠海马中的神经炎症反应和肠道菌群的紊乱,且中剂量干预效果明显。
关键词:铅中毒,神经系统,儿童;胃肠道微生物组;黄芪皂苷;蒙古黄芪;炎性因子
中图分类号:R598.11文献标志码:ADOI:10.11958/20221821
Effects of Mongolian astragalus saponin on neuroinflammation and intestinal microflora disorder induced by lead exposure in developing rats
HU Mingyue, LI Xin, GAO Lei, GUAN Mingjie
School of Public Health, Baotou Medical College, Inner Mongolia University of Science and Technology, Baotou 014060, China
Corresponding Author E-mail: guanmj1202@163.com
Abstract: Objective To investigate the effect of Mongolian astragalus saponin on neuroinflammation and intestinal microbiota disorder caused by lead exposure in developing SD rats. Methods Forty 4-week-old Sprague Dawley rats were randomly divided into the control group (CG), the lead exposure group (LE) and the saponin intervention groups [high-dose (SH), medium-dose (SM) and low-dose (SL)]. After 4 weeks of corresponding intervention, blood lead content of rats was detected by hydride generation atomic fluorescence spectrometry. Levels of tumor necrosis factor-α (TNF-α), interleukin-6 (IL-6) and interleukin-1β (IL-1β) in hippocampal tissue were detected by enzyme linked immunosorbent assay. Changes of intestinal microbiota composition in cecal contents were detected by 16S rDNA sequencing. Results Compared with the CG group, blood lead levels were increased in other groups(P<0.05), levels of TNF-α, IL-6 and IL-1β in hippocampus were increased in the LE group, and the α and β diversity of intestinal flora were significantly changed in the LE group. Shannon index and Simpson index were decreased, and relative abundance of Romboutsia, Blautia and Lachnospiraceae_UCG-001 was decreased. The relative abundance of Ruminococcus and Prevotellaceae_UCG-001 was increased (P<0.05). Compared with the LE group, blood lead levels were decreased in the SL group and the SM group (P<0.05). Hippocampal IL-6 level in the SL group, the level of IL-1β in the SM group, levels of TNF-α and IL-6 in the SM group and the SH group were decreased (P<0.05). β diversity in the SL group and the SM group, and α diversity in the SM group were significantly improved, and Simpson index was increased in the SM group (P<0.05). The relative abundance of Ruminococcus and Prevotellaceae_UCG-001 decreased in the SM group and the SH group (P<0.05). The relative abundance of Romboutsia, Lachnospiraceae_UCG-001 and Blautia were significantly increased in the SM group and the SL group (P<0.05). The abundance of Romboutsia increased more significantly in the SM group than that in the SH group (P<0.05). Conclusion Mongolian astragalus saponins can effectively inhibit neuroinflammatory response and intestinal flora disorder in hippocampus of lead-induced developing rats, and the effect of medium dose intervention is obvious.
Key words: lead poisoning, nervous system, childhood; gastrointestinal microbiome; astragaloside; astragalus membranaceus bungevar.mongholicus(bunge) P.K.Hsiao; inflammatory factor
铅是一种可以通过呼吸道、胃肠道和皮肤接触等途径进入人体并蓄积产生毒性的重金属元素[1]。儿童是对铅暴露最敏感和最脆弱的群体,即使低剂量铅暴露也会影响儿童大脑发育和神经行为[2-3]。铅透过血脑屏障后主要在脑灰质特别是海马体中累积,可诱发神经炎症,进而导致神经及认知功能障碍[4-5]。近来有研究显示,铅暴露与儿童肠道菌群及其代谢组的改变关系密切[6],而肠道菌群的变化又与神经精神类疾病有着紧密的联系[7]。黄芪(astragali radix)为蒙古黄芪或膜荚黄芪的干燥根,是一种天然药物,具有广泛的药理作用。蒙古黄芪皂苷(saponin)为蒙古黄芪中主要活性成分之一,具有抗炎、抗氧化及调节免疫、内分泌与代谢等作用,在治疗神经系统疾病上具有较大优势[8]。本课题组前期研究发现,蒙古黄芪皂苷具有抗氧化和神经保护作用,可提高铅暴露大鼠的学习记忆能力[9]。另有文献报道,黄芪皂苷可通过影响肠道菌群来维持肠道微环境稳态,而肠道菌群又能增强其生物利用度,促进人体健康[10]。本研究利用蒙古黄芪皂苷对发育期铅暴露大鼠进行干预,观察大鼠炎性因子及肠道菌群的变化,探讨蒙古黄芪皂苷对铅致神经损伤和肠道菌群紊乱的保护效果。
1 材料与方法
1.1 主要仪器与试剂 采用醇提法从中药蒙古黄芪粗粉(包头医学院药学院蒙药药物资源保护与开发利用院士工作站)中提取蒙古黄芪皂苷(简称皂苷),纯度98.22%;0.2%醋酸铅(上海实验试剂有限公司);肿瘤坏死因子(TNF)-α、白细胞介素(IL)-6及IL-1β酶联免疫吸附试验(ELISA)试剂盒(江苏酶免实业有限公司);氢化物原子荧光光谱仪(杭州尔首科学仪器有限公司);多功能酶标仪(美国BioTek有限公司)。
1.2 分组与处理 40只4周龄清洁级雄性SD大鼠购自北京维通利华实验动物技术有限公司,动物生产许可证号:SCXK(京)2016-0006;体质量55?75 g。适应性喂养1周后,采用随机数字表法分为对照(CG)组、铅染毒(LE)组及皂苷低、中、高剂量干预(SL、SM、SH)组,每组8只。结合课题组前期研究,SL、SM、SH组干预剂量分别为75、150及300 mg/kg[9]。CG组自由饮用纯净水,LE组与皂苷干预组自由饮用0.2%醋酸铅溶液进行染毒,并在染毒同时分别给予皂苷干预组相应剂量皂苷进行灌胃,CG组与LE组给予相同剂量(10 mL/kg)的生理鹽水灌胃,1次/d,连续灌胃4周。
1.3 生物样本采集 大鼠连续灌胃4周后,禁食12 h,称体质量,腹腔注射3%戊巴比妥钠麻醉,腹主动脉采血3 mL,摇匀后置于冰箱-20 ℃保存,用于血铅水平测定。大鼠取血后立即断头处死,剥离脑海马组织,用预冷的生理盐水清洗干净,滤纸吸干水分称质量,然后于灭菌的EP管内加入缓冲液[每0.1 g海马加入0.9 mL预冷的磷酸盐缓冲液(PBS)]再放入预冷的匀浆机匀浆,4 ℃、2 500 r/min离心20 min,收集上清液并分装于灭菌的EP管,-80 ℃保存。在无菌环境下,将盲肠内容物分离后置于灭菌的EP管内,液氮速冻-80 ℃保存。
1.4 大鼠血铅水平测定 全血样品消解:取1 mL血液,放入经酸缸浸泡、清洗晾干的三角烧瓶中,加入5 mL硝酸-高氯酸(4∶1)混合溶液消化,用2%的盐酸溶液将消化后产物逐步转入洁净比色管中,加入5 mL草酸溶液和5 mL铁氰化钾溶液,再用2%盐酸溶液定容至50 mL,摇匀后室温静置30 min,4 000 r/min离心10 min取上清液,移入灭菌的EP管中,同时准备好空白管作为对照。铅标准系列溶液配制后,氢化物原子荧光光谱仪检测样品,根据自动生成的标准曲线,计算全血样品的血铅水平。
1.5 ELISA法检测大鼠海马组织中炎性因子水平 参照ELISA试剂盒说明书,用多功能酶标仪检测大鼠海马组织中TNF-α、IL-6、IL-1β的水平。
1.6 16 S rDNA高通量测序方法检测大鼠盲肠内容物
1.6.1 测序 盲肠内容物收集后由上海百趣生物医学科技有限公司进行测序。采用十六烷基三甲基溴化铵(CTAB)法对样本的基因组DNA进行提取,用琼脂糖凝胶电泳检测DNA的纯度和浓度。取适量样本DNA于离心管中,无菌水稀释样本至1 μg/L。以稀释后的基因组DNA为模板,根据测序区域的选择,使用带Barcode的特异引物和高效高保真酶进行聚合酶链式反应(PCR)。PCR产物经琼脂糖凝胶电泳检测合格后进行磁珠纯化,采用酶标定量,根据PCR产物浓度进行等量混样,充分混匀后使用2%琼脂糖凝胶电泳检测PCR产物。使用TruSeq? DNA PCR-Free Sample Preparation Kit建库试剂盒构建DNA文库,构建好的文库经过Qubit定量和文库检测合格后,使用NovaSeq6000上机测序。
1.6.2 测序数据处理 测序得到的原始数据,存在一定比例的干扰数据(dirty data),参照文献[11]对原始数据进行拼接、过滤,得到有效数据(effective tags)。
1.6.3 OTU聚类和物种注释 基于有效数据进行聚类和物种分类分析(operational taxonomic units,OTUs)。参照文献[12],根据OTUs聚类结果,对每个OTU的代表序列做物种注释,得到对应的物种信息和基于物种的丰度分布情况。
1.6.4 样本复杂度分析(alpha diversity) 使用Qiime软件(Version 1.9.1)计算Alpha多样性指数和Shannon、Simpson指数(物种分布多样性和均匀度指标)及Chao1指数(物种丰富度指标)。使用R软件(Version 2.15.3)绘制稀释曲线(曲线平坦程度代表测序深度和数据量合理性,高度反映物种的丰富度),等级聚类曲线(水平宽度反映物种的丰富度,平滑程度反映物种的均匀程度),从中得到样本内物种丰富度和多样性信息等。
1.6.5 多样本比较分析(beta diversity) 基于Bray-Curtis距离,使用R软件(Version 2.15.3)绘制无度量多维标定法(non-metric multi-dimensional scaling,NMDS)分析图(点与点间的距离反映组间和组内差异)及基于weighted_unifrac_wilcox分析组间物种Beta多样性指数差异以发现不同组别间群落结构的差异。
1.6.6 组间差异物种分析 根据不同分类水平上物种注释结果,选取门水平[厚壁菌门(Firmicutes)、疣微菌门(Verrucomicrobiota)、拟杆菌门(Bacteroidota)及放线菌门(Actinobacteriota)]及属水平[罗姆布茨菌属(Romboutsia)、瘤胃球菌属(Ruminococcus)、毛罗菌科_UCG-001菌属(Lachnospiraceae_UCG-001)、布劳特氏菌属(Blautia)、普雷沃菌科_UCG_001菌属(Prevotellaceae_UCG-001)]优势菌进行统计分析,得到分组间相对丰度变化差异显著的物种及差异物种在各组的富集情况。
1.7 统计学方法 采用SPSS 22.0软件进行数据分析。符合正态分布计量数据用x±s表示,多组间比较用单因素方差分析,方差齐者组间多重比较采用LSD-t检验;方差不齐者采用Welch's ANOVA分析,组间多重比较采用Games-Howell检验。不符合正态分布的计量资料以M(P25,P75)表示,组间比较采用Kruskal-Wallis H检验,组间多重比较采用Bonferroni法。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠灌胃4周后体质量及血铅水平比较 各组大鼠连续灌胃4周后,各组间体质量差异无统计学意义。与CG组比较,LE组及皂苷各剂量干预组大鼠血铅水平升高(P<0.05);与LE组比较,SL组、SM组血铅水平降低(P<0.05),但皂苷各剂量干预组间血铅水平差异无统计学意义,见表1。
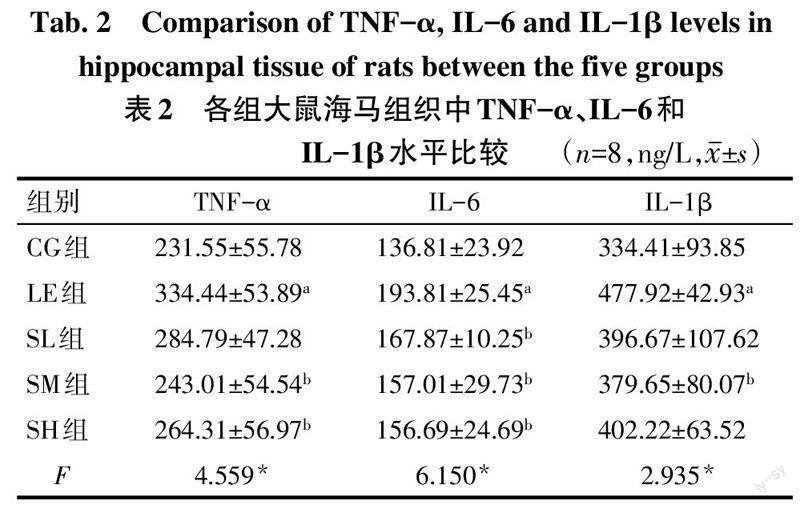
2.2 各组大鼠海马组织中炎性因子水平比较 与CG组比较,LE组大鼠海马中的TNF-α、IL-6和IL-1β水平均升高(P<0.05);与LE组比较,SL组大鼠海马中IL-6水平降低(P<0.05),SM組大鼠海马中TNF-α、IL-6和IL-1β水平均降低(P<0.05),SH组大鼠海马中TNF-α和IL-6水平降低(P<0.05);皂苷各剂量干预组间差异均无统计学意义,见表2。
2.3 大鼠盲肠内容物16 S rDNA测序结果分析
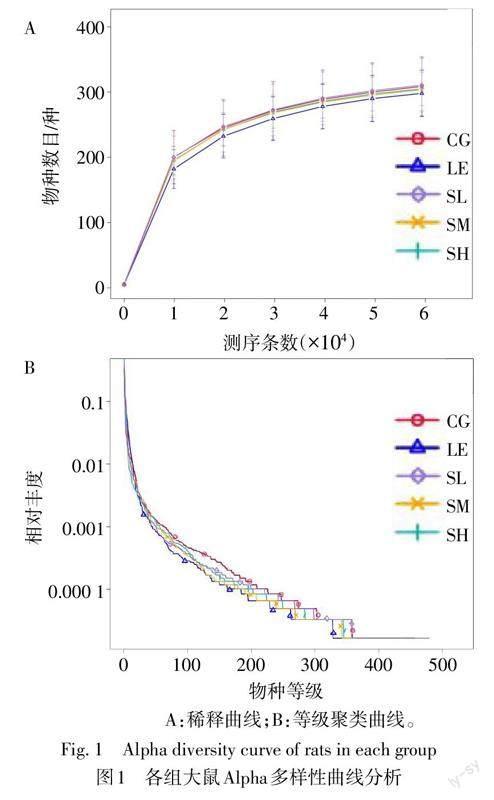
2.3.1 菌群Alpha多样性 稀释曲线趋向平坦,测序深度基本达到饱和,测序数据量合理,其中与CG组、SL组、SM组和SH组比较,LE组曲线最低,提示测到的物种种类较少,物种多样性较低,见图1A。等级聚类曲线显示,与CG组比较,LE组曲线在横轴上的跨度小,物种丰富度低,曲线较陡峭,物种分布参差;与LE组比较,SL组、SM组、SH组曲线在横轴上的跨度大,物种丰富度高,曲线平缓,物种分布均匀,见图1B。与CG组比较,LE组Shannon指数、Simpson指数均降低(P<0.05);与LE组比较,SM组Simpson指数升高(P<0.05);SL组、SM组和SH组间3个指数差异无统计学意义,见表3。
2.3.2 组间群落结构差异分析 NMDS结果示各组间聚类具有一定的区别,见图2A。Beta多样性指数分析显示,LE组与CG组、SL组、SM组间群落差异明显(F=2.259,P<0.05),见图2B。
2.3.3 组间差异物种分析 (1)在门水平上,厚壁菌门、疣微菌门、拟杆菌门及放线菌门均是各组大鼠肠道菌群中的绝对优势菌种,占总序列的95%以上,见图3。但以上4种菌门在各组大鼠肠道菌群中相对丰度差异均无统计学意义(H=5.976、4.601、2.180、8.188,P>0.05),见图4。(2)在属水平上,与CG组比较,LE组罗姆布茨菌属、毛罗菌科_UCG-001菌属、布劳特氏菌属相对丰度减少,瘤胃球菌属、普雷沃菌科_UCG-001菌属相对丰度增加(P<0.05),SL组毛罗菌科_UCG-001菌属相对丰度减少(P<0.05)。与LE组比较,SL组布劳特氏菌属相对丰度增加(P<0.05);SM组瘤胃球菌属及普雷沃菌科_UCG-001菌属相对丰度均减少,而罗姆布茨菌属、毛罗菌科_UCG-001菌属及布劳特氏菌属相对丰度增加(P<0.05);SH组瘤胃球菌属和普雷沃菌科_UCG-001菌属相对丰度减少(P<0.05)。与SM组比较,SH组罗姆布茨菌属相对丰度降低(P<0.05)。见表4。
3 讨论
研究认为,4周龄SD大鼠相当于儿童6~7岁阶段[13]。研究显示,通过自由饮用不同浓度醋酸铅对小鼠进行染毒,小鼠体质量没有显著变化[14]。本研究结果亦显示,铅暴露没有引起发育期大鼠体质量降低,可能此浓度铅暴露不足以引起体质量的减轻。但铅会在发育期大鼠体内蓄积,血液中的铅水平是常用的铅暴露评价指标[15]。本研究结果显示,相较于CG组,其余组的血铅水平均升高,表明醋酸铅暴露能增加发育期大鼠体内铅的蓄积;而与LE组相比,SH组可能由于皂苷剂量过高,血铅水平降低并不显著,但SL、SM组的血铅水平均降低,表明蒙古黄芪皂苷可以有效抑制铅在发育期大鼠体内的累积。
铅暴露可在多个组织中诱导炎症反应,从而威胁人体健康[16]。研究显示,铅暴露引起的神经炎症是导致铅神经毒性的主要原因,而海马中星形胶质细胞和小胶质细胞过度活化可促进TNF-α、IL-6、IL-1β和抑制转化生长因子-β(TGF-β)等因子的释放[17]。本研究结果亦显示,相较于CG组,LE组海马中促炎因子TNF-α、IL-6和IL-1β水平上升,表明醋酸铅暴露可以引起发育期大鼠海马神经炎症;而与LE组相比,SL组海马IL-6水平,SM组海马TNF-α、IL-6及IL-1β水平,SH组海马TNF-α、IL-6水平降低,表明蒙古黄芪皂苷具有抗炎活性,可以有效抑制因铅暴露引起的发育期大鼠海马神经炎症,发挥神经保护作用,但各剂量组间各炎性指标差异无统计学意义,表明其神经保护与药物剂量关系不大。
近年来有研究显示,铅暴露可以引起儿童或动物肠道菌群的紊乱,主要是菌群多样性和群落结构的改变[6,18]。本研究发现,相较于CG组,LE组大鼠肠道菌群α、β多样性显著改变,Shannon指数和Simpson指数减小,虽然2组在门水平上菌群相对丰度差异无统计学意义,但在属水平上,LE组罗姆布茨菌属、布劳特氏菌属、毛罗菌科_UCG-001菌属相对丰度显著减少,瘤胃球菌属、普雷沃菌科_UCG-001菌属相对丰度显著增加,表明铅暴露可以导致发育期大鼠肠道菌群多样性降低及群落结构紊乱,这可能与铅对肠道屏障的损害或肠道代谢产物的改变有关。另外,与LE组相比,SM组大鼠肠道菌群α多样性Simpson指数增加,SM、SH组瘤胃球菌属、普雷沃菌科_UCG-001菌属相对丰度减少,SM组罗姆布茨菌属、毛罗菌科_UCG-001菌属、布劳特氏菌属及SL组布劳特氏菌属相对丰度均显著增加,表明蒙古黄芪皂苷可以有效调节铅致发育期大鼠肠道菌群紊乱的功能,且中剂量干预组效果显著,考虑其机制可能是黄芪皂苷通过影响肠道菌群的群落结构、代谢以及肠道细胞功能等方式维持肠道微环境稳态,从而实现铅对发育期大鼠肠道健康的损伤的预防。
研究认为,肠道菌群的紊乱影响依赖短链脂肪酸、神经递质等其产生的副产物,进而通过肠-脑轴对大脑产生影响,最终引发抑郁症、焦虑症、精神分裂症、自闭症、阿尔茨海默病和帕金森病等精神类疾病[7]。增加肠道嗜酸乳杆菌、鼠李糖乳杆菌、副干酪乳杆菌、嗜热链球菌、瑞士乳杆菌 、发酵乳杆菌及长双歧杆菌等益生菌水平可改善铅暴露所致神经行为改变或神经损伤[19]。在克罗恩病患者症状发作期间,瘤胃球菌属大量繁殖并产生炎症多糖,诱导树突状细胞产生炎性因子,TNF-α是克罗恩病的炎症标志物[20]。有研究显示,降低普雷沃菌科_UCG-001数量可改善大鼠抑郁样行为,其机制可能与增加短链脂肪酸水平并抑制肠道炎症有关[21]。罗姆布茨菌属和毛螺菌属能促进丁酸生成,而丁酸对人体肠道及免疫系统调节起关键作用[22-23]。布劳特氏菌属毛罗菌科,可缓解炎症性疾病和代谢性疾病,所以笔者推测,铅致发育期大鼠海马神经炎症可能与肠道菌群紊乱有关,蒙古黄芪皂苷可能通过调节肠道菌群的紊乱来干预铅对发育期大鼠的神经毒性作用,但其相关机制还需进一步研究。
综上所述,铅暴露可以引起发育期大鼠海马神经炎症及肠道菌群的紊乱,蒙古黄芪皂苷可有效调节铅暴露所致发育期大鼠海马中炎性因子的改变以及肠道菌群紊乱,发挥神经及肠道保护作用。肠道菌群的改变可能是铅致神经炎症甚至神经损伤机制之一,蒙古黄芪皂苷可能通过调节肠道菌群,从而改善铅暴露所致的神经毒性作用。
参考文献
[1] ZENG X,HUO X,XU X,et al. E-waste lead exposure and children's health in China[J]. Sci Total Environ,2020,734:139286. doi:10.1016/j.scitotenv.2020.139286.
[2] 梁艷,肖华,孙建岭,等. 警惕儿童的“隐形杀手”[J]. 中国工业医学杂志,2021,34(3):288. LANG Y,XIAO H,SUN J L,et al. Watch out for 'invisible killers' of children[J]. Chin J Industrial Med,2021,34(3):288. doi:10.13631/j.cnki.zggyyx.2021.03.033.
[3] D?REA J G. Environmental exposure to low-level lead (Pb) co-occurring with other neurotoxicants in early life and neurodevelopment of children[J]. Environ Res,2019,177:108641. doi:10.1016/j.envres.2019.108641.
[4] TENA A,PERU E,MARTINETTI L E,et al. Long-term consequences of early postnatal lead exposure on hippocampal synaptic activity in adult mice[J]. Brain Behav,2019,9(8):e01307. doi:10.1002/brb3.1307.
[5] CHIBOWSKA K,KORBECKI J,GUTOWSKA I,et al. Pre- and neonatal exposure to lead(Pb) Induces neuroinflammation in the forebrain cortex,hippocampus and cerebellum of rat pups[J]. Int J Mol Sci,2020,21(3):1083. doi:10.3390/ijms21031083.
[6] ZENG X,ZENG Z,WANG Q,et al. Alterations of the gut microbiota and metabolomics in children with e-waste lead exposure[J]. J Hazard Mater,2022,434:128842. doi:10.1016/j.jhazmat.2022.128842.
[7] 李瑞盈,鄢明辉,游春苹. 脑-肠轴与精神疾病肠道微生物的研究进展[J]. 食品工业科技,2021,42(18):427-434. LI R Y,YAN M H,YOU C P. Advances in the study of brain-gut axis and intestinal microorganisms in neuropsychiatric diseases[J]. Science and Technology of Food Industry,2021,42(18):427-434. doi:10.13386/j.issn1002-0306.2020080250.
[8] 徐锘,吴晓俊. 黄芪皂苷对神经系统疾病的药理作用研究进展[J]. 中国中药杂志,2021,46(18):4674-4682. XU N,WU X J. Research advance of pharmacological effects ofastragalosides on nervous system diseases[J]. Chin J Chin Mater Med,2021,46(18):4674-4682. doi:10.19540/j.cnki.cjcmm.20210610.704.
[9] 蔚立濤,赵秉宏,李鑫,等. 蒙古黄芪总皂苷对铅染毒大鼠学习记忆损伤的保护作用[J]. 包头医学院学报,2020,36(6):52-55. WEI L T,ZHAO B H,LI X,et al. Protective effect of Mongolian Astra agalus saponins on learning and memory impairment in rats exposed to lead[J]. Journal of Baotou Medical College,2020,36(6):52-55. doi:10.16833/j.cnki.jbmc.2020.06.021.
[10] 田雨,丁艳平,邵宝平,等. 黄芪等药食同源类中药作为功能性食品与肠道菌群的相互作用[J]. 中国中药杂志,2020,45(11):2486-2492. TIAN Y,DING Y P,SHAO B P,et al. Interaction between homologous functional food Astragali Radix and intestinal flora[J]. Chin J Chin Mater Med,2020,45(11):2486-2492. doi:10.19540/j.cnki.cjcmm.20200119.401.
[11] ROGNES T,FLOURI T,NICHOLS B,et al. VSEARCH: a versatile open source tool for metagenomics[J]. PeerJ,2016,4:e2584. doi:10.7717/peerj.2584.
[12] EDGAR R C. UPARSE:highly accurate OTU sequences from microbial amplicon reads[J]. Nat Methods,2013,10(10):996-998. doi:10.1038/nmeth.2604.
[13] ANDREOLLO N A,SANTOS E F,ARA?JO M R,et al. Rat's age versus human's age:what is the relationship?[J]. Arq Bras Cir Dig,2012,25(1):49-51. doi:10.1590/s0102-67202012000100011.
[14] 朱嘉伟,许永杰,李韵婷,等. 铅暴露引起小鼠学习记忆改变与肠道菌群紊乱的相关性研究[J]. 中华劳动卫生职业病杂志,2022,40(2):83-89. ZHU J W,XU Y J,LI Y T,et al. Relationships between lead-induced learning and memory impairments and gut microbiota disturbancein mice[J]. Chin J Industrial Hygiene Occupational Dis,2022,40(2):83-89. doi:10.3760/cma.j.cn121094-20210121-00041.
[15] KLOTZ K,G?EN T. Human biomonitoring of lead exposure[J]. Met Ions Life Sci,2017,17:99-121. doi:10.1515/9783110434330-006.
[16] BOSKABADY M,MAREFATI N,FARKHONDEH T,et al. The effect of environmental lead exposure on human health and the contribution of inflammatory mechanisms,a review[J]. Environ Int,2018,120:404-420. doi:10.1016/j.envint.2018.08.013.
[17] SU P,WANG D,CAO Z,et al. The role of NLRP3 in lead-induced neuroinflammation and possible underlying mechanism[J]. Environ Pollut,2021,287:117520. doi:10.1016/j.envpol.2021.117520.
[18] ZHAI Q,QU D,FENG S,et al. Oral Supplementation of lead-intolerant intestinal microbes protects against lead (Pb) toxicity in mice[J]. Front Microbiol,2020,10:3161. doi:10.3389/fmicb.2019.03161.
[19] 黄曦瑶,汪惠丽. 益生菌摄入对铅暴露大鼠社会行为的影响[J]. 合肥工业大学学报(自然科学版),2020,43(6):839-843. HUANG X Y,WANG H L. Effect of probiotics on social behavior of lead-exposed rats[J]. Journal of Hefei University of Technology(Natural Science),2020,43(6):839-843.
[20] HENKE M T,KENNY D J,CASSILLY C D,et al. Ruminococcus gnavus,a member of the human gut microbiome associated with Crohn's disease,produces an inflammatory polysaccharide[J]. Proc Natl Acad Sci USA,2019,116(26):12672-12677. doi:10.1073/pnas.1904099116.
[21] ZHU H Z,LIANG Y D,MA Q Y,et al. Xiaoyaosan improves depressive-like behavior in rats with chronic immobilization stress through modulation of the gut microbiota[J]. Biomed Pharmacother,2019,112:108621. doi:10.1016/j.biopha.2019.108621.
[22] LI Q,CUI Y,XU B,et al. Main active components of Jiawei Gegen Qinlian decoction protects against ulcerative colitis under different dietary environments in a gut microbiota-dependent manner[J]. Pharmacol Res,2021,170:105694. doi:10.1016/j.phrs.2021.105694.
[23] SUN D,BAI R,ZHOU W,et al. Angiogenin maintains gut microbe homeostasis by balancing α-Proteobacteria and Lachnospiraceae[J]. Gut,2021,70(4):666-676. doi:10.1136/gutjnl-2019-320135.
(2022-11-07收稿 2023-02-14修回)
(本文編辑 陆荣展)
