复方藤梨汤含药血清对人脑胶质瘤U251细胞增殖、凋亡及上皮间质转化的影响
2023-11-08武海博梁燕沈雷范展傅国惠
武海博 梁燕 沈雷 范展 傅国惠
摘要:目的 探究復方藤梨汤含药血清对人脑胶质瘤U251细胞增殖、凋亡及上皮间质转化的影响。方法 将24只雄性SD大鼠分为对照组和低、中、高剂量组[复方藤梨汤6、12、24 g/(kg·d)],每组6只,制备含药血清处理人脑胶质瘤U251细胞。采用CCK-8法检测细胞活力,集落形成实验检测细胞克隆形成能力,流式细胞术检测细胞周期分布与细胞凋亡,定量聚合酶链反应检测原癌基因C-myc、细胞周期蛋白D1(CyclinD1)基因表达,Western blot法检测细胞凋亡蛋白[B细胞淋巴瘤-2(Bcl-2)、Bcl-2相关X蛋白(Bax)、胱天蛋白酶(Caspase)-3、Caspase-8]以及β-连环蛋白(β-catenin)、上皮性黏附蛋白(E-cadherin)及波形蛋白(Vimentin)表达。结果 选取体积分数10%的含药血清为最终剂量。与对照组比较,低、中、高剂量组细胞活力、克隆形成数、C-myc mRNA、CyclinD1 mRNA、Vimentin表达水平降低,处于S期细胞比例、Bax/Bcl-2比值、Caspase-3表达水平升高(P<0.05);低、高剂量组G1期细胞比例降低(P<0.05);中、高剂量组G2期细胞比例、β-catenin表达水平降低,Caspase-8和E-cadherin表达水平升高(P<0.05);高剂量组细胞凋亡率升高(P<0.05)。结论 复方藤梨汤含药血清可促使人脑胶质瘤U251细胞阻滞于S期,抑制细胞增殖,诱导细胞凋亡,通过调节β-catenin、E-cadherin和Vimentin表达抑制上皮间质转化。
关键词:神经胶质瘤;上皮-间质转化;细胞增殖;细胞凋亡;细胞增殖抑制药(中药);复方藤梨汤含药血清;人脑胶质瘤U251细胞
中图分类号:R739.41文献标志码:ADOI:10.11958/20221840
Effects of Fufang Tengli Decoction drug-containing serum on proliferation, apoptosis and epithelial-mesenchymal transition of human glioma U251 cells
WU Haibo, LIANG Yan, SHEN Lei, FAN Zhan, FU Guohui
Department of Neurology, Nanyang Central Hospital, Nanyang 473000, China
Corresponding Author E-mail: fgh377818@sina.com
Abstract: Objective To explore effects of Fufang Tengli Decoction drug-containing serum on the proliferation, apoptosis and epithelial-mesenchymal transition (EMT) of human glioma U251 cells. Methods A total of 24 male SD rats were divided into the control group, the low-dose, medium-dose and high-dose Fufang Tengli Decoction groups [6, 12, 24 g/(kg·d)], 6 rats in each group. After 10 d of continuous intragastric administration, blood samples was collected to prepare drug-containing serum, and human glioma U251 cells were treated for 24 h. The cells activity was detected by Cell Counting Kit-8. The cell cloning was detected by colony formation assay. The distribution of cells cycles and apoptosis were detected by flow cytometry. The expressions of proto-oncogene C-myc and cyclin D1 (CyclinD1) genes were detected by quantitative polymerase chain reaction. The expressions of B-cell lymphoma-2 (Bcl-2), Bcl-2 associated X protein (Bax), cysteine aspartase-3 (caspase-3), caspase-8, β-catenin, epithelial cadherin (E-cadherin) and vimentin (Vimentin) were detected by Western blot assay. Results The drug-containing serum with 10% volume fraction was selected as the final dose. Compared with the control group, cells activity, number of clone formation and expression levels of C-myc, CyclinD1 mRNA and Vimentin were decreased, while numbers of cells in S phase and expression levels of Bax/Bcl-2 and Caspase-3 were increased in the low-dose, medium-dose and high-dose Fufang Tengli Decoction groups (P<0.05). The proportion of cells in G2 phase and expression level of β-catenin were decreased, while expression levels of Caspase-8 and E-cadherin were increased in the medium-dose and high-dose Fufang Tengli Decoction groups (P<0.05). Cell apoptosis rate was increased in the high-dose Fufang Tengli Decoction group (P<0.05). Conclusion Fufang Tengli Decoction drug-containing serum can block human glioma U251 cells in S phase, inhibit cell proliferation, induce apoptosis, regulate expressions of β-catenin, E-cadherin and Vimentin, and inhibit EMT.
Key words: glioma; epithelial-mesenchymal transition; cell proliferation; apoptosis; cell proliferation inhibitors (TCD); Fufang Tengli Decoction; human glioma U251 cells
膠质母细胞瘤(glioblastoma,GBM)是最常见的神经系统原发性恶性肿瘤,发病部位呈多样性,会破坏功能区,致残、致死率高于其他脑部疾病,严重影响患者预后[1-2]。替莫唑胺、贝伐单抗等常用的抗胶质母细胞瘤药物毒副作用较大,会损伤正常脑组织,且长时间使用易形成耐药性[3]。因此,寻找新型抗GBM药物成为其治疗领域的研究热点。目前,中医药已广泛用于GBM的治疗,具有多靶点、多途径、多功效的优势[4]。中医认为,机体升降失衡,致清阳不升、浊阴不降,阻塞清窍,日久成积致瘤[5]。复方藤梨汤系用于GBM、胃癌、肝癌等恶性肿瘤治疗的经验方,全方具有燥湿化痰、软坚散结、益气通络的功效[6]。然而,目前有关其抗癌抑瘤的作用机制、治疗靶点等尚不明确。本研究采用复方藤梨汤含药血清体外干预人胶质瘤U251细胞,观察胶质瘤细胞增殖、凋亡及上皮间质转化能力的变化,以期为中医药抗GBM提供参考。
1 材料与方法
1.1 材料
SPF级雄性SD大鼠24只,体质量180~220 g,6~8周龄,购自湖南斯莱克景达实验动物公司,动物生产许可证号:SCXK(湘)2019-0004。人脑胶质瘤细胞株U251购自中国科学院分子细胞科学卓越创新中心。复方藤梨汤组分购自中国北京同仁堂(集团)有限公司;细胞计数试剂盒8(CCK-8)购自江苏凯基生物科技股份有限公司;Annexin V-FITC/PI细胞凋亡试剂盒、细胞周期染色试剂盒购自杭州联科生物技术股份有限公司;Trizol试剂、超纯总RNA提取试剂盒购自北京康为世纪生物科技有限公司;定量聚合酶链反应(qPCR)试剂盒购自南京诺唯赞生物科技有限公司;2×SYBR Green PCR Master Mix购自厦门生命互联科技有限公司;兔源抗B细胞淋巴瘤-2(Bcl-2)、Bcl-2相关X蛋白(Bax)、胱天蛋白酶(Caspase)-3、Caspase-8、β-连环蛋白(β-catenin)、上皮性黏附蛋白(E-cadherin)及波形蛋白(Vimentin)抗体购自英国Abcam公司;鼠源抗3-磷酸甘油醛脱氢酶(GAPDH)购自武汉博士德生物工程有限公司;辣根过氧化物酶标记山羊抗小鼠IgG(H+L)购自北京中杉金桥生物技术有限公司。NovoCyte?流式细胞仪(NovoCyte 2060R)购自艾森生物(杭州)有限公司;荧光PCR仪(CFX ConnectTM 实时)购自伯乐生命医学产品(上海)有限公司。
1.2 大鼠含药血清制备
藤梨根30 g、黄芪30 g、鳖甲20 g、冬凌20 g及当归20 g,加入600 mL水熬制复方藤梨汤,浓缩成含生药3 g/mL汤剂。参照文献[6],60 kg成人每日复方藤梨汤用药量120 g,即2 g/(kg·d),换算成大鼠用药剂量为12 g/(kg·d)[7],分别以0.5、1、2倍设定大鼠低、中、高剂量为6、12、24 g/(kg·d)。将大鼠于20~26 ℃、相对湿度50%~60%的条件下适应性喂养1周。采用随机数表法将大鼠分为对照组和低、中、高剂量组,每组6只。低、中、高剂量组分别给予6、12、24 g/(kg·d)复方藤梨汤灌胃,对照组大鼠给予15 mL/(kg·d)生理盐水灌胃,每次为标准计算剂量的一半,充分模拟人体服药习惯,不禁食,每日2次,连续灌胃10 d。于第10天灌胃后60 min腹腔注射10%水合氯醛(0.3 mL/100 g)麻醉处死大鼠,腹主动脉采血5 mL,3 000 r/min离心30 min后保留上层血清制备含药血清,合并同组血清置于56 ℃水浴30 min灭活补体,用0.22 μm微孔滤膜过滤除菌,置于-20 ℃冰箱备用。
1.3 细胞培养
配制含有10%胎牛血清、1%青霉素/链霉素的DMEM培养基,重悬U251细胞,置于5% CO2、37 ℃培养箱中培养,待细胞贴满瓶底后添加0.25%胰蛋白酶消化传代,取对数生长期细胞进行后续实验。
1.4 CCK-8法检测细胞活力
将细胞以5 000个/孔接种于96孔板,培养24 h后更换培养基体积分数为5%、10%、20%的各组含药血清,继续培养24 h,再添加10 μL/孔CCK-8试剂,避光培养2 h,于450 nm波长处检测各孔光密度(OD)值,细胞活力=实验孔OD值/对照孔OD值×100%。取细胞活力均在50%以上且差异最明显的给药体积分数进行后续克隆形成能力、细胞凋亡等实验。
1.5 集落形成实验
将细胞以100个/孔接种于6孔板,培养14 d,去除培养基,95%乙醇固定,滴加0.1%结晶紫并于4 ℃下静置染色过夜,次日取出复温45 min,光镜下计数克隆形成数(每个克隆数含有50个以上细胞,直径0.3~1.0 mm)。
1.6 流式细胞术检测细胞周期分布与细胞凋亡率
取各组细胞3×106个,以预冷PBS重悬,800 r/min离心5 min后留取底部细胞,并添加DNA Staining solution和Permeabilization solution染液涡旋混匀,37 ℃孵育40 min,800 r/min离心5 min后再添加PBS重悬细胞,上流式细胞仪检测细胞周期分布。取各组细胞3×106个,预冷1×Binding Buffer重悬细胞,再分别加入Annexin V-FITC和PI染料混匀,室温避光孵育10 min,再添加1×Binding Buffer至500 μL混匀,上流式细胞仪检测各组细胞凋亡率。
1.7 qPCR检测细胞中相关基因mRNA水平
收集各组细胞,添加Trizol提取RNA,根据逆转录试剂盒合成cDNA,以cDNA为模板,构建qPCR体系(20 μL):2×SYBR Green PCR Master Mix 10 μL,cDNA模板1 μL,上、下游引物各0.4 μL,去RNA酶水8.2 μL。反应条件:预变性95 ℃ 10 min;变性95 ℃ 10 s,退火52.3 ℃ 30 s,延伸72 ℃ 30 s,共40个循环。原癌基因C-myc:上游5'-GACAGCAGCTCGCCCAAGT-3',下游5'-CTCCAGCAGAAGGTGATCCAG-3',产物大小254 bp;细胞周期蛋白D1(CyclinD1):上游5'-CCCACTGGTACGATACGC-3',下游5'-AGCCTGGGAAACACCC-3',产物大小169 bp;GAPDH引物:上游5'-AAATCCCATCACCATCTTCCAG-3',下游5'-TGAGTCCTTCCAGGATACCAAA-3',产物大小320 bp。以GAPDH为内参基因,采用2-ΔΔCt法分析C-myc、CyclinD1 mRNA的相对表达水平。
1.8 Western blot法检测细胞中相关蛋白表达
收集各组细胞,于冰上裂解30 min,以12 000 r/min离心10 min后吸取上清液即为总蛋白。经BCA试剂盒测定浓度,置于100 ℃水浴变性5 min,各组取50 μg变形蛋白上样,行SDS-PAGE电泳1.5 h,湿法转膜至PVDF膜。5%脱脂奶粉室温封闭2 h,分别加入一抗Bcl-2、Bax、Caspase-3(均1∶1 500)和Caspase-8、β-catenin、E-cadherin、Vimentin、GAPDH(均1∶1 000),4 ℃孵育过夜,再置于二抗(1∶4 000)溶液室温孵育1 h,最后滴加ECL曝光液,曝光显影。应用Image J 1.7.0软件分析各蛋白条带,以目的蛋白灰度值与内参GAPDH灰度值比值为目的蛋白相对表达量。
1.9 统计学方法
采用SPSS 17.0软件进行数据分析。符合正态分布的计量资料以x±s表示,多组间比较采用单因素方差分析,组间多重比较采用LSD-t法。P<0.05为差异有统计学意义。
2 结果
2.1 各组细胞活力比较
5%体积分数低、中、高剂量组细胞活力分别为(89.79±3.44)%、(81.74±4.01)%、(79.93±3.73)%;10%体积分数低、中、高剂量组细胞活力分别为(80.81±6.51)%、(64.93±6.46)%、(59.78±3.05)%;20%体积分数低、中、高剂量组细胞活力分别为(59.07±6.68)%、(49.00±1.50)%、(38.19±5.03)%。10%体积分数低、中、高剂量组细胞活力均在50%以上,且差异明显,选择10%体积分数的含药血清作为最终剂量;与对照组细胞活力(100.00±0.00)%比较,低、中、高剂量组细胞活力依次降低(n=3,F=42.127,P<0.001)。
2.2 各组细胞克隆形成能力比较
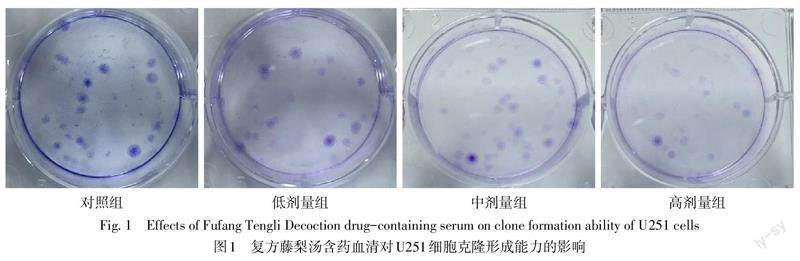
对照组和低、中、高剂量组细胞克隆形成数分别为(37.33±3.51)、(26.67±6.11)、(23.33±4.51)及(16.00±2.65)个,与对照组比较,低、中、高剂量组克隆形成数依次减少(n=3,F=12.254,P<0.05),见图1。
2.3 各组细胞周期分布情况和C-myc、CyclinD1 mRNA相对表达水平比较
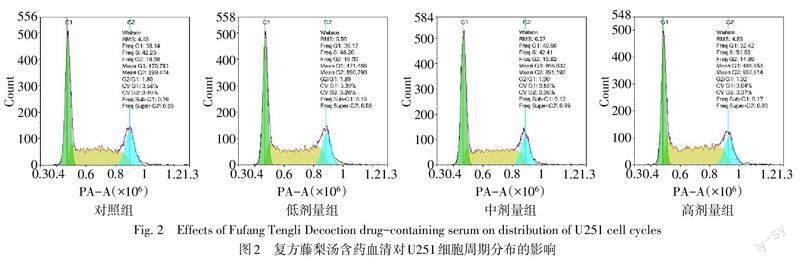
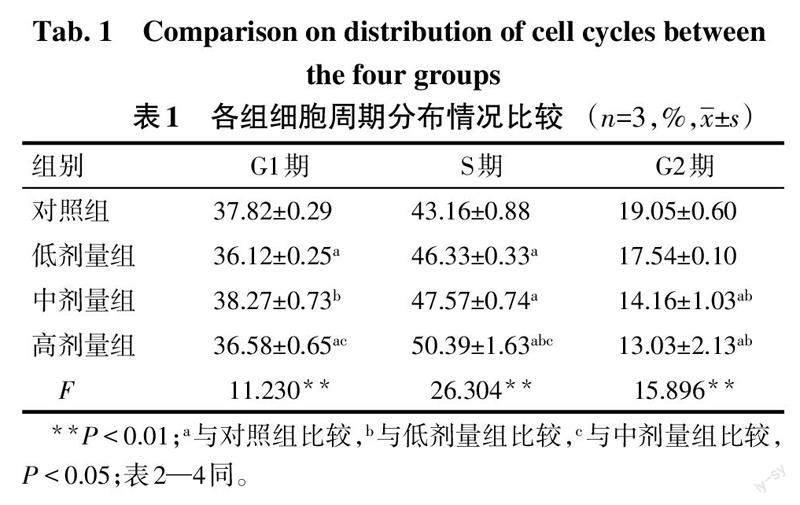
与对照组比较,低、中、高剂量组细胞处于S期比例增多,C-myc和CyclinD1 mRNA相对表达水平降低,低、高剂量组G1期比例降低,而中、高剂量组G2期细胞比例降低(P<0.05);与低剂量组比较,高剂量组处于S期细胞比例升高,C-myc mRNA相对表达水平降低,中、高剂量组G2期细胞比例和CyclinD1 mRNA相对表达水平均降低(P<0.05);与中剂量组比较,高剂量组S期细胞比例升高,G1期细胞比例降低(P<0.05),见图2,表1、2。
2.4 各组细胞凋亡率及凋亡相關蛋白表达水平比较
与对照组比较,高剂量组细胞凋亡率升高,低、中、高剂量组细胞中Bax/Bcl-2比值和Caspase-3表达水平升高,中、高剂量组Caspase-8表达水平升高(P<0.05);与低剂量组比较,高剂量组细胞凋亡率和Caspase-3、Caspase-8表达水平升高,中、高剂量组细胞中Bax/Bcl-2升高(P<0.05);与中剂量组比较,高剂量组细胞凋亡率和Caspase-3、Caspase-8表达水平升高,见表3,图3、4。
2.5 各组细胞上皮间质转化标记物表达水平比较
与对照组比较,中、高剂量组β-catenin表达水平均降低,E-cadherin表达水平均升高,低、中、高剂量组Vimentin表达水平均降低(P<0.05);低、中、高剂量组β-catenin表达水平依次降低,高剂量组E-cadherin表达水平较低、中剂量组升高(P<0.05);中、高剂量组Vimentin表达水平较低剂量组降低(P<0.05),见表4、图5。
3 讨论
复方藤梨汤方中黄芪、当归是气血双补的经典组合,鳖甲散结逐瘀,冬凌草、藤梨根清解热毒,全方攻补兼施,具有扶正祛邪,抗癌抑瘤的功效[8-9]。曹刘荐等[10]选取结直肠化疗患者为研究对象,在mFLFOX6化疗方案基础上加服复方藤梨汤治疗,发现患者生存质量明显提高,而且复方藤梨汤还可促进机体免疫功能提升,发挥减毒作用。本研究结果显示,复方藤梨汤含药血清处理后的U251细胞活力和克隆形成能力较对照组明显降低,表明复方藤梨汤含药血清可抑制U251细胞增殖。通过流式细胞术检测细胞周期分布显示,复方藤梨汤含药血清可诱导细胞大量停滞于S期,G2期细胞比例明显减少,提示复方藤梨汤阻滞了正常细胞周期发展。C-myc和CyclinD1在细胞周期中发挥重要调控作用,其中原癌基因C-myc在细胞周期紊乱细胞和大量肿瘤细胞中过表达,是细胞周期发展的必需信号;CyclinD1作为细胞周期蛋白,主要调控G1/S期,促进细胞生长[11-12]。本研究发现,复方藤梨汤含药血清处理后的细胞中C-myc、CyclinD1 mRNA相对表达水平较对照组降低,提示复方藤梨汤含药血清可能通过下调C-myc、CyclinD1基因表达,阻断细胞进入G2期,降低细胞增殖能力。
细胞凋亡机制缺陷是肿瘤细胞异常增殖的主要原因,将凋亡调节分子作为抗肿瘤药物筛选靶点已应用于临床,如酪氨酸激酶抑制剂伊马替尼可靶向凋亡信号转导的Bcl-2家族成员,发挥杀伤慢性髓系白血病细胞的作用[13-14]。细胞凋亡主要涉及Bcl-2和Caspase这2个进化保守的蛋白家族。细胞应激状态下,抗凋亡因子Bcl-2被拮抗,解除对促凋亡因子Bax的抑制,促进细胞色素C释放入胞浆,形成凋亡复合体,活化Caspase-9,进一步激活下游Caspase-3、Caspase-8,促进细胞凋亡[15-16]。藤梨根是复方藤梨汤的抗癌主药。杨誉佳等[17]研究显示,藤梨根提取物可增强Bax、Caspase-3表达,促进人宫颈癌Hela细胞的凋亡。本研究发现,与对照组比较,低、中、高剂量组细胞中Bax/Bcl-2比值和Caspase-3表达水平升高,中、高剂量组Caspase-8表达水平升高,提示复方藤梨汤含药血清可能通过促进Bax/Bcl-2、Caspase-3、Caspase-8表达,诱导细胞凋亡。
脑实质内浸润生长是弥漫性神经胶质瘤的典型特征,上皮-间质细胞转化在此过程中起关键作用,肿瘤细胞通过降低细胞间黏附作用,获得间质细胞表型,增强细胞侵袭、迁移能力,促进新生血管的生成,以应对微环境信号[18-20]。E-cadherin是细胞黏附分子,可结合多功能蛋白β-catenin,参与黏合带的形成,导致Wnt/β-catenin信号通路活性降低,抑制肿瘤细胞的侵袭与迁移[21]。Vimentin则是间质细胞标志物,其表达升高是上皮间质转化发生的重要信号[22]。吴幸冬等[23]研究表明,黄芪可调节上皮标志物E-cadherin的表达,影响肿瘤细胞迁移。本研究发现,复方藤梨汤含药血清可上调E-cadherin,下调β-catenin、Vimentin表达,从而抑制细胞上皮间质转化的发生。
综上所述,复方藤梨汤含药血清可促使人脑胶质瘤U251细胞阻滞于S期,抑制细胞增殖,诱导细胞凋亡,并调节β-catenin、E-cadherin和Vimentin表达,抑制上皮间质转化。本研究为复方藤梨汤应用于人脑胶质瘤的治疗提供了参考依据,但该复方汤剂的抗癌作用机制仍有待深入分析,各指标间的剂量作用效果并不完全一致,考虑为含药血清干预时间尚短所致,后续将延长实验时间深入分析不同剂量含药血清对细胞增殖、凋亡及上皮间质转化相关基因表达的影响。
参考文献
[1] BAGLEY S J,KOTHARI S,RAHMAN R,et al. Glioblastoma clinical trials:current landscape and opportunities for improvement[J]. Clin Cancer Res,2022,28(4):594-602. doi:10.1158/1078-0432.CCR-21-2750.
[2] DE BIASE G,GARCIA D P,BOHNEN A,et al. Perioperative management of patients with glioblastoma[J]. Neurosurg Clin N Am,2021,32(1):1-8. doi:10.1016/j.nec.2020.09.005.
[3] LE RHUN E,PREUSSER M,ROTH P,et al. Molecular targeted therapy of glioblastoma[J]. Cancer Treat Rev,2019,80:101896. doi:10.1016/j.ctrv.2019.101896.
[4] 张悦,刘爱迪,范旭东,等. 中药靶向递送系统治疗脑胶质瘤研究进展[J]. 中草药,2021,52(17):5358-5368. ZHANG Y,LIU A D,FAN X D,et al. Research progress of Chinese materia medica targeted delivery system in the treatment of glioma[J]. Chin Tradit Herb Drugs,2021,52(17):5358-5368. doi:10.7501/j.issn.0253-2670.2021.17.028.
[5] 滕舒慧,周梦婕,于冰清,等. 中药活性成分抗脑胶质瘤的作用机制及相应新剂型研究进展[J]. 中国药房,2021,32(23):2934-2940. TENG S H,ZHOU M J,YU B Q,et al. Action mechanism of TCM active components against glioma and research progress of the corresponding new formulation[J]. China Pharm,2021,32(23):2934-2940. doi:10.6039/j.issn.1001-0408.2021.23.21.
[6] 何本求,劉莉,张芳,等. 复方藤梨汤对结直肠癌术后化疗不良反应及临床疗效的观察[J]. 中医临床研究,2021,13(19):13-15. HE B Q,LIU L,ZHANG F,et al. Observation on clinical effcacy of the Fufang Tengli decoction on postoperative chemotherapy for colorectal cancer and adverse reaction[J]. Clin J Chin Med,2021,13(19):13-15. doi:10.3969/j.issn.1674-7860.2021.19.003.
[7] 陈奇. 中药药理研究方法学[M]. 3版. 北京:人民卫生出版社,2011:1261-1264. CHEN Q. Research methodology of TCM pharmacology[M]. 3rd ed. Beijing:People's Medical Publishing House,2011:1261-1264.
[8] 李军,唐东昕,王镜辉,等. 基于数据挖掘分析国医大师刘尚义治疗卵巢癌用药特点与规律[J]. 辽宁中医杂志,2020,47(4):42-46. LI J,TANG D X,WANG J H,et al. Medication characteristics and rules in the treatment of ovarian cancer based on data mining analysis by TCM master Liu Shangyi[J]. Liaoning J Tradit Chin Med,2020,47(4):42-46. doi:10.13192/j.issn.1000-1719.2020.04.011.
[9] 甘椿椿,金湛,魏晓鹏,等. 藤梨根化学成分及其体外抗肿瘤转移活性[J]. 中成药,2021,43(2):403-407. GAN C C,JIN Z,WEI X P,et al.Chemical constituents from Actinidia chinensis and their antitumor metastatic activity in vitro[J]. Chin Tradit Pat Med,2021,43(2):403-407. doi:10.3969/j.issn.1001-1528.2021.02.020.
[10] 曹劉荐,赖象权,何本求,等. 复方藤梨汤对结直肠癌术后化疗患者生存质量及免疫功能的影响[J]. 中华肿瘤防治杂志,2020,27(S1):104-105. CAO L J,LAI X Q,HE B Q,et al. Effects of Fufang Tengli decoction on quality of life and immune function in patients with colorectal cancer undergoing postoperative chemotherappy[J]. Chin J Cancer Prev Treat,2020,27(S1):104-105.
[11] ZHANG G,ZHU Q,FU G,et al. TRIP13 promotes the cell proliferation,migration and invasion of glioblastoma through the FBXW7/c-MYC axis[J]. Br J Cancer,2019,21(12):1069-1078. doi:10.1038/s41416-019-0633-0.
[12] DEHGHANI-SOLTANI S,EFTEKHAR-VAGHEFI S H,BABAEE A,et al. Pulsed and discontinuous electromagnetic field exposure decreases temozolomide resistance in glioblastoma by modulating the expression of O6-methylguanine-DNA methyltransferase,Cyclin-D1,and p53[J]. Cancer Biother Radiopharm,2021,36(7):579-587. doi:10.1089/cbr.2020.3851.
[13] SIGHEL D,NOTARANGELO M,AIBARA S,et al. Inhibition of mitochondrial translation suppresses glioblastoma stem cell growth[J]. Cell Rep,2021,35(4):109024. doi:10.1016/j.celrep.2021.109024.
[14] KANTARJIAN H M,HUGHES T P,LARSON R A,et al. Long-term outcomes with frontline nilotinib versus imatinib in newly diagnosed chronic myeloid leukemia in chronic phase:ENESTnd 10-year analysis[J]. Leukemia,2021,35(2):440-453. doi:10.1038/s41375-020-01111-2.
[15] GOLLA C,BILAL M,DWUCET A,et al. Photodynamic therapy combined with Bcl-2/Bcl-xL inhibition increases the Noxa/Mcl-1 ratio independent of Usp9X and synergistically enhances apoptosis in glioblastoma[J]. Cancers (Basel),2021,13(16):4123. doi:10.3390/cancers13164123.
[16] ASHFAQUE A,HANIF F,SIMJEE S U,et al. Opuntiol inhibits growth and induces apoptosis in human glioblastoma cells by upregulating active Caspase 3 expression[J]. Asian Pac J Cancer Prev,2021,22(11):3607-3613. doi:10.31557/APJCP.2021.22.11.3607.
[17] 杨誉佳,陆远富,安强,等. 藤梨根提取物对宫颈癌的抑制作用[J]. 中华中医药学刊,2019,37(7):1710-1714. YANG Y J,LU Y F,AN Q,et al. Inhibition of Actinidia Arguta extract on cervical cancer[J]. Chin Arch Tradit Chin Med,2019,37(7):1710-1714.
[18] SU X,YANG Y,GUO C,et al. NOX4-derived ROS mediates TGF-β1-Induced metabolic reprogramming during epithelial-mesenchymal transition through the PI3K/AKT/HIF-1α pathway in glioblastoma[J]. Oxid Med Cell Longev,2021,2021:5549047. doi:10.1155/2021/5549047.
[19] 詹雯静,梁铭杰,刘媛,等. STAT3抑制剂及烟酰胺联合用药对肝癌HepG2细胞增殖的抑制作用及机制研究[J]. 天津医药,2022,50(7):686-692. ZHAN W J,LIANG M J,LIU Y,et al. Effects and mechanism of STAT3 inhibitor and nicotinamide combination on the inhibiting proliferation of hepatocarcinoma HepG2 cells[J]. Tianjin Med J,2022,50(7):686-692. doi:10.11958/20212609.
[20] DJEDIAI S,GONZALEZ SUAREZ N,EL CHEIKH-HUSSEIN L,et al. MT1-MMP cooperates with TGF-β receptor-mediated signaling to trigger SNAIL and induce epithelial-to-mesenchymal-like transition in U87 glioblastoma cell[J]. Int J Mol Sci,2021,22(23):13006. doi:10.3390/ijms222313006.
[21] BABU D,MUDIRAJ A,YADAV N,et al. Rabeprazole has efficacy per se and reduces resistance to temozolomide in glioma via EMT inhibition[J]. Cell Oncol (Dordr),2021,44(4):889-905. doi:10.1007/s13402-021-00609-w.
[22] LIU F,XU X H,LI C Y,et al. Rapid tumor recurrence in a novel murine GBM surgical model is associated with Akt/PD-L1/vimentin signaling[J]. Biochem Biophys Res Commun,2021,569:1-9. doi:10.1016/j.bbrc.2021.06.072.
[23] 吳幸冬,唐德才. 黄芪配伍莪术对小鼠结肠癌细胞CT26黏附和迁移能力的影响[J]. 中医杂志,2020,61(13):1176-1183. WU X D,TANG D C. Effects of compatibility of Radix Astragali seu Hedysa and Rhizoma Curcumae on adhesion and migration ability of colon cancer cell CT26 in mice[J]. J Tradit Chin Med,2020,61(13):1176-1183. doi:10.13288/j.11-2166/r.2020.13.014.
(2022-11-09收稿 2023-02-05修回)
(本文编辑 陆荣展)
