NETO2介导的ERK通路表达与口腔鳞状细胞癌转移和预后的关系*
2023-11-08陆珣珣韦曙平韦富贵
陆珣珣, 韦曙平, 韦富贵
广西科技大学第二附属医院耳鼻咽喉头颈外科(广西柳州 545006)
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是最具侵袭性和致死性的恶性肿瘤之一[1]。晚期患者的5年内的存活率仅为30%,超过20%的患者已经出现区域淋巴结转移和晚期局部疾病,这是OSCC相关死亡的主要原因[2-3]。最近,许多研究人员已经确定了OSCC增殖和转移的预后标志物,如RACK1、NLRC3、HAX-1,并确定了一些驱动事件[2-4]。然而,OSCC患者的预后仍然很差。因此,阐明OSCC的潜在分子机制将有助于开发更多创新和有效的方法来降低患有这种疾病的患者的死亡率。神经纤毛及唾样蛋白2(neuropilin and tolloid-like 2,NETO2)属于CUB结构域和含有LDLa的独特亚家族的跨膜蛋白,它们通过减慢或加速脱敏恢复来调节神经元红藻氨酸受体[5-6]。虽然NETO2最初被认为是一种神经元特异性蛋白,但越来越多的证据表明NETO2的表达可在几种癌症中检测到[7-9]。最近的一项研究发现,NETO2在胰腺癌的肿瘤进展中起重要作用[8]。此外,高水平的NETO2与结直肠癌的临床病理学特征和较差的生存率相关[9]。然而,关于NETO2的表达模式及其在OSCC进展中的临床意义的报道很少。在本研究中,我们检查了NETO2的临床意义,并进一步分析了NETO2高表达与预后不良与患者生存率之间的相关性。此外,研究在体外实验中考察NETO2敲低对OSCC细胞增殖、迁移和侵袭的影响。
1 资料与方法
1.1 GEPIA数据库分析 从癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库中获得519个OSCC组织和44个非OSCC组织的mRNA表达谱并进行分析。利用基因表达谱交互分析(Gene Expression Profiling Interactive Analysis,GEPIA)计算OSCC患者的总生存率。
1.2 临床标本 组织样本取自2020年11月至2022年1月本院接受手术治疗且术前未进行化疗或放疗的OSCC患者124份癌标本及配对正常组织(距肿瘤边缘5 cm)。没有患者术前接受局部或全身化疗、放疗或靶向治疗,所有组织均由两名病理学家进行组织学鉴定。切除的标本立即处理并储存在-80 ℃。所有OSCC参与者都获得了知情同意患者和样本,研究方案经本院伦理委员会批准同意(伦审2019-042)。
1.3 免疫组化 厚度为5 μm的石蜡切片在65 ℃下烘烤1 h。在免疫染色之前,石蜡切片在酒精系列中进行脱蜡和再水合,然后在柠檬酸盐抗原修复溶液中通过微波加热进行抗原修复。切片用5%正常山羊血清封闭,并与NETO2的一抗在4 ℃下孵育过夜。然后用UltraSensitive S-P Ultrasensitive试剂盒(辣根过氧化物酶[HRP],抗兔)检测免疫反应,并用3, 3′-二氨基联苯胺底物观察。在显微镜下观察图像。通过半定量免疫反应性评分系统评估蛋白质表达水平。染色强度为0(无)、1(弱)、2(中)、3(强),阳性染色细胞比例为无、<10%、10%~50%和>50%分别计为1、2、3、4。将以上两个分数相乘得到最终分数如下:0~2,(-);3~4,(+);5-8,(++);和9~12,(+++)。其中(-)和(++)定义为NETO2低表达,(++)和(+++)定义为NETO2高表达。
1.4 细胞培养 人口腔鳞癌细胞系HSC-4细胞(美国ATCC)接种在含有10%胎牛血清(美国Gibco公司)和1%双抗生素(青霉素/链霉素)(美国Thermo Fisher Scientific公司)的Dulbecco改良Eagle培养基(DMEM)中培养。实验1为了考察NETO2对HSC-4细胞的增殖、迁移和侵袭影响。将HSC-4细胞分为NETO2敲低(sh1、sh2)组和相应对照(NC)组;其中NC组和sh1、sh2组分别使用Lipofectamine2000将NC、sh1或sh2转染细胞48 h。实验2考察ERK信号通路是否是OSCC中NETO2的关键下游靶标,将HSC-4细胞分为NETO2敲低(sh1、sh1+EGF)组和相应对照(NC)组;其中NC组和sh1组、sh1+EGF组分别使用Lipofectamine2000将NC或sh1转染细胞48 h,sh1+EGF组在转染后加入ERK激动剂(表皮生长因子[Epidermal growth factor,EGF,纯度≥99%,美国Med Chem Express公司],用DMSO稀释成40 ng/mL)处理24 h。NC组和sh1组加入DMSO处理24 h。
1.5 慢病毒制备 表达靶向NETO2的pLKO.1 shRNA的慢病毒载体获自美国Open Biosystems公司。使用Lipofectamine 2000试剂(美国Invitrogen公司)将慢病毒载体与包装载体pCMVΔR8.9和包膜载体pCMV-VSVG共转染到293T细胞中用于慢病毒生产。收集病毒以用8 μg/mL聚凝胺(北京Solarbio公司)感染HSC-4细胞。用嘌呤霉素(Solarbio)(3 μg/mL)选择稳定的感染细胞48 h。本研究中使用的shRNA序列如下:非特异性对照(NC),5′-CCGGTTCTCCGAACGTGTCACGTTTCAAGAG-AACGTTGACACGTTCGGAGAATTTTTTG-3′;shRNA1 NETO2(sh1),5′-CCGGGCTGCACTTCAGA-CGAATTCTCAAGAGAAATTCGTCTGAAGTGCAGC-TTTTTTG-3′;shRNA2 NETO2(sh2),5′-CCGG-GCAAGAATICTGTGACTATCCTCAAGAGAATAGTC-ACAGAATTCTTGCTTTTTTG-3′。
1.6 Western blot分析 通过放射免疫沉淀测定缓冲液制备OSCC组织或细胞蛋白质,并通过BCA蛋白质测定试剂盒(上海Beyotime公司)进行定量。对样品进行10% SDS-PAGE分离,然后转移到聚偏二氟乙烯膜(美国Millipore公司)。将膜用5%脱脂牛奶封闭,用一抗在4℃下孵育过夜,并与相应的HRP偶联二抗孵育1 h,通过ECL Plus(美国Thermo Scientific公司)检测印迹带。使用的抗体包括针对NETO2(美国Abcam公司),ERK(ERK1/2,美国CST公司),Nrf2(美国CST公司)和GAPDH(甘油醛-3-磷酸脱氢酶,作为阴性对照,美国Abcam公司)的一抗(均购自美国Proteintech公司)。
1.7 细胞增殖试验 通过Cell Counting Kit-8(CCK-8,日本Dojindo公司)评估细胞活力。对于CCK-8测定,将总共1×103个细胞接种到96孔板中并孵育过夜。然后,在指定时间点(2、4和6 d)向每个孔中加入10 μL CCK-8溶液试剂,并将细胞在黑暗中孵育2 h。随后,通过Bio-Tek Elx 800酶标仪(美国Bio-Tek Instruments公司)测量450 nm波长处的吸光度。
1.8 克隆形成测定 将500个细胞接种在含有2 mL新鲜培养基的6孔板中,并生长2周。可见菌落用0.1%结晶紫染色,计算集落数。
1.9 细胞迁移、侵袭测定 使用具有8 μm孔径的24孔Transwell插入物(美国Corning公司)进行迁移测定。将 200 μL不含FBS的培养基中的1×104个细胞接种在上室中,并在每个下室中加入600 μL含有20% FBS的培养基。37 ℃孵育24 h后,迁移的细胞用100%甲醇固定20 min,室温下用0.1%结晶紫溶液染色15 min。在显微镜下对迁移的细胞进行计数和记录。
Transwell Matrigel侵袭试验使用孔径为8 μm的24孔Transwell插入物(美国Corning公司)进行。用200 μg/mL Corning Matrigel基质(美国Corning公司)包被24孔可渗透支撑板,然后在37 ℃下孵育5 h以固化基质凝胶基质。从接种细胞开始的以下步骤同细胞迁移测定。
1.10 RNA免疫沉淀(RIP-seq)分析 总RNA使用ZnCl2进行片段化,并与抗NETO2多克隆抗体(美国Abcam公司)在4℃下孵育2 h,然后处理与蛋白 A/G 磁珠在4℃下再作用 2 h。纯化结合的RNA,然后用于测序文库构建和qRT-PCR。使用Illumina Next-Seq 500测序仪对该文库进行测序,参照文献方法进行基因本体论(GO)的基因集富集分析(GSEA)分析[10]。使用ToppGene Suite (https://toppgene.cchmc.org/enrichment.jsp)的ToppFun模块对HSC-4细胞中降低的基因进行GO-GSEA分析。Benjamini-Hochberg调整后的P值(错误发现率[FDR])<0.05的本体术语被认为是显著丰富。使用pidpathway的GSEA工具包进行通路分析。
1.11 统计学方法 所有数据均使用SPSS 21.0进行处理。所有数据均以至少三个独立实验的平均值±标准差的形式呈现。两组独立样本的比较采用双样本t检验。使用重复测量方差分析分析细胞增殖和细胞迁移实验的结果。使用2检验分析临床组织切片的蛋白质表达数据。P<0.05表示差异有统计学意义。
2 结果
2.1 NETO2在OSCC组织中异常表达,与OSCC患者预后不良呈正相关 为了探索NETO2在OSCC进展中的表型表达和临床意义,我们首先分析了GEPIA数据库,发现NETO2在OSCC组织中的表达显著增加(图1-A)。随后检测了癌标本中NETO2的蛋白水平,并与配对的正常组织进行了比较。Western blot结果显示NETO2蛋白(1.00±0.03vs. 3.88±0.42,t=5.903,P<0.001,图1-B)表达在OSCC标本升高。此外,通过IHC分析评估了OSCC患者中NETO2高表达与临床病理特征之间的相关性(图1-C、D),并在124份癌标本中确定98例NETO2高表达和26例NETO2低表达。如表1所示,NETO2高表达与OSCC的TNM分期(P=0.045)、分化中等和差(P=0.021)、淋巴结转移(P=0.019)和复发(P=0.016)有关。使用GEPIA中Kaplan-Meier数据库分析了NETO2的表达水平与OSCC患者的总生存期(OS)之间的相关性,发现NETO2低表达患者具有更好的生存预期(图1-E)。
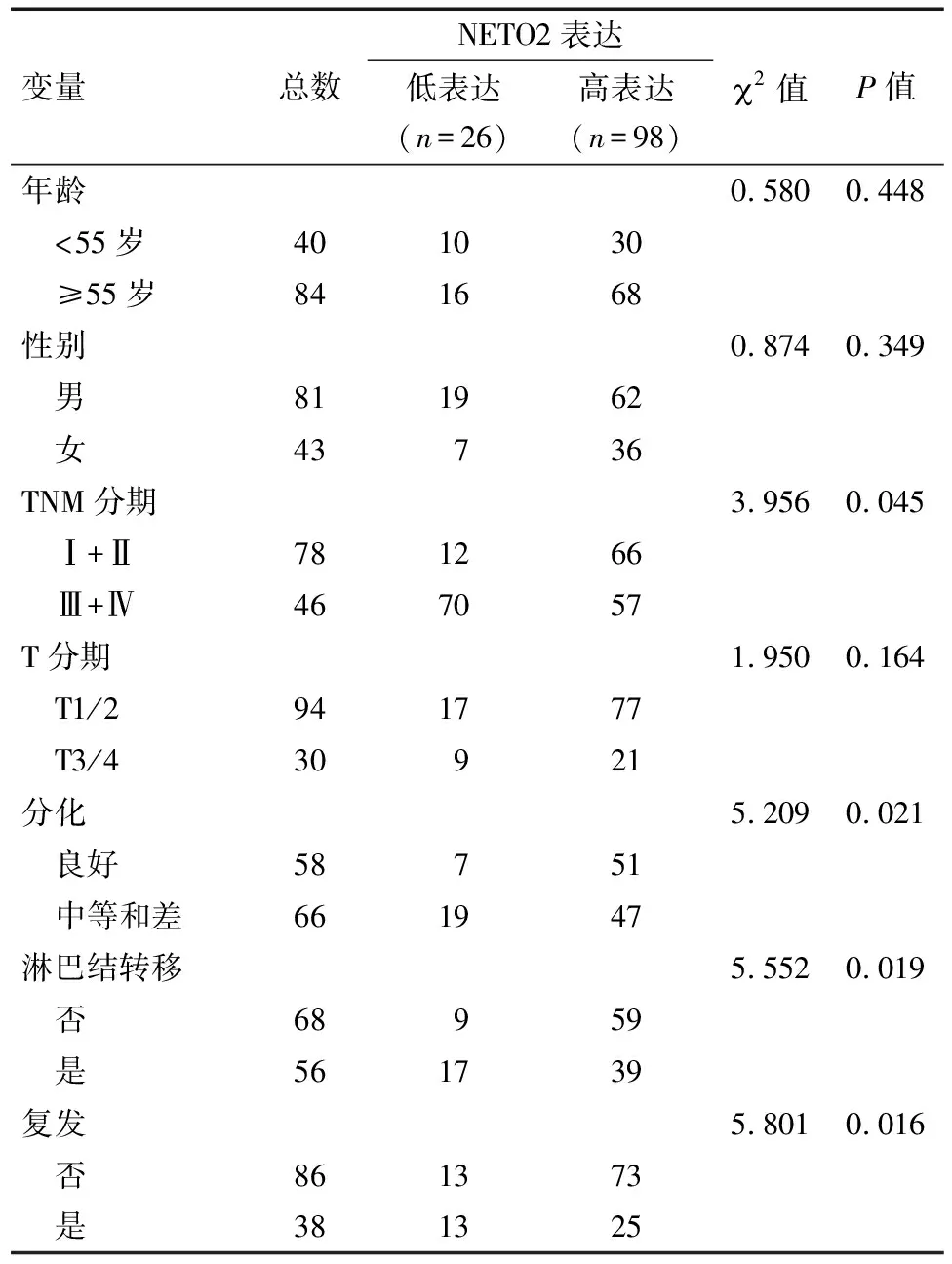
表1 临床病理特征和NETO2表达的单因素分析 例
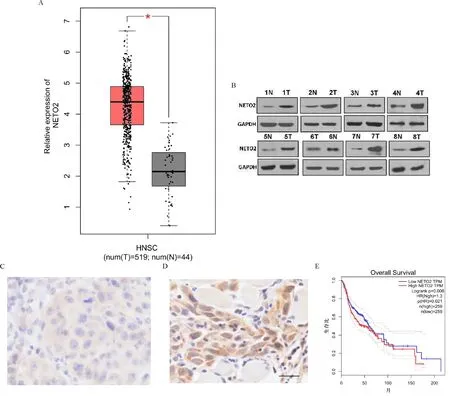
注:A:通过GEPIA数据库评估OSCC组织和正常对照组织中的NETO2表达;*P<0.05;B:通过蛋白质印迹检查OSCC和非OSCC组织中的相对NETO2表达水平(N=非OSCC组织,T=OSCC组织);C、D:通过IHC分析评估了OSCC组织中NETO2低表达(C)和高表达(D)代表图(比例尺=50 μm);E:使用GEPIA中Kaplan-Meier数据库分析了NETO2的表达水平与OSCC患者的总生存期(OS)之间的相关性
2.2 靶向NETO2表达对OSCC进展的影响 为了研究NETO2调控OSCC的潜在分子机制,我们使用两种不同的短发夹RNA(shRNA1和shRNA2;以下统称为sh1和sh2)敲低了HSC-4细胞中NETO2的表达。与非特异性对照(NC)相比,sh1组和sh2组均显著降低了NETO2蛋白的表达(图2-A)。NETO2敲低抑制了OSCC细胞的增殖(图2-B)和集落形成(图2-C和2-D),表明NETO2对OSCC生长至关重要。我们进一步进行了细胞迁移试验,发现NETO2敲低显著降低了OSCC细胞的迁移(图2-E和2-F)。此外,细胞侵袭试验显示,NETO2敲低会降低HSC-4细胞的侵袭能力(图2-G和2-H)。总的来说,我们的体外结果揭示了NETO2在调节OSCC进展中的关键作用。

注:A:蛋白质印迹确认HSC-4细胞中NETO2敲低;B:CCK8评估的NC或sh-NETO2细胞的生长;C、D:HSC-4细胞的集落形成测定(C)和量化数据(D);E、F:HSC-4细胞的迁移试验(E)和定量数据(F);G、H:HSC-4细胞的侵袭测定(G)和定量数据(H)。*与NC组比较P<0.001
2.3 NETO2调节ERK信号通路 我们接下来进行了RNA免疫沉淀测序以确定NETO2在调节OSCC中的下游靶标和潜在分子机制。基因本体论(GO)的基因集富集分析(GSEA)揭示了OSCC细胞中NETO2的敲低导致ERK信号通路基因表达的显著变化(图3-A),表明NETO2在调节OSCC细胞中ERK信号通路的潜在功能。ERK信号通路是癌症中重要的致癌通路,因此,我们进一步研究了NETO2在OSCC中ERK通路调控中的作用。蛋白质印分析显示,NETO2敲低导致NETO2、ERK及其下游Nrf2蛋白表达降低(P<0.05)(图3-B、C)。

注: A:GO-GSEA确定了与731个基因相关的富集基因本体过程,并确定ERK信号通路基因表达的显著变化。B、C:蛋白质印迹检测HSC-4细胞中NETO2和ERK信号通路蛋白水平。与NC组比较,*P<0.05, **P<0.01
2.4 ERK通路激活可挽救NETO2敲低OSCC细胞中的OSCC进展 为了确定ERK信号通路是否是OSCC中NETO2的关键下游靶标,我们通过在NETO2敲低的细胞中加入ERK激动剂(EGF)激活ERK进一步进行了拯救测定。如图4-A和4-B所示,与sh1组相比,sh1+EGF组增加了NETO2敲低细胞中ERK的表达(P<0.05),表明ERK信号通路激活。此外,sh1+EGF组的NETO2敲低OSCC细胞的生长、集落形成能力、迁移和侵袭均显著高于sh1组(P<0.05),见图4-C、D、E、F、G。这些数据支持ERK信号通路是NETO2的重要下游靶点,对其促进OSCC进展的功能至关重要。

注:A、B: NETO2敲低的OSCC细胞中ERK表达的蛋白质印迹图和定量分析。C:CCK8测定ERK通路激活对NETO2敲低OSCC细胞生长的影响。D、E:ERK通路激活对NETO2敲低OSCC细胞集落形成测定(D)和量化数据(E)。F、G:ERK通路激活对NETO2敲低OSCC细胞侵袭、迁移分析(F)和量化数据(G)。与NC组比较,*P<0.05,**P<0.01,***P<0.001
3 讨论
尽管目前已在阐明OSCC分子机制方面取得了进展,但OSCC仍然具有高死亡率、高转移率和较差的预后。由于肿瘤发生进展复杂且缺乏靶向治疗,手术已成为OSCC的主要治疗方法。以前对NETO2的研究表明该基因与神经元特异性过程有关,例如脑兴奋性突触传导[11]。最近的研究将NETO2与各种癌症中的致癌基因联系起来,并证实NETO2表达可作为肾癌和结直肠癌早期诊断和预测晚期肿瘤进展的工具[9, 12]。还有研究发现,NETO2与胃癌的临床病理学特征密切相关,并促进胃癌的转移[13]。然而,NETO2在OSCC中的作用和临床相关性知之甚少。本研究中,我们发现NETO2在OSCC中显著上调,并与OSCC的TNM分期(P=0.045)、分化中等和差(P=0.021)、淋巴结转移(P=0.019)和复发(P=0.016)有关。此外,生存分析显示,NETO2高表达与患者预后不良有关。多项研究报道,NETO2可促进肿瘤转移,其表达与淋巴结转移有关,并且NETO2蛋白升高与肺癌、结直肠癌和乳腺癌的预后不良有关[9, 13]。这些结果表明,NETO2上调在OSCC进展中起重要作用。
在体外研究中,我们发现NETO2敲低降低了OSCC细胞的增殖、侵袭和迁移能力。先前的研究发现,NETO2刺激食管癌细胞增殖,同时在体外抑制细胞凋亡并在体内增强肿瘤生长。此外,NETO2的敲低与上皮间质转化相关标志物的调节相结合,显著抑制了食管癌细胞迁移和侵袭[7]。Liu等[13]研究证实,NETO2是一种重要的癌蛋白,可能激活TNFRSF12A/PI3K/AKT/NF-κB/Snail轴以诱导上皮间质转化,从而促进胃癌细胞的侵袭和转移。结合这些研究,我们的工作提供了强有力的体外证据,支持NETO2在调节OSCC肿瘤发生和进展中的重要功能。
从机制上讲,我们发现ERK信号通路是一个关键的NETO2靶标,它介导NETO2促进OSCC进展的功能。ERK信号通路是一个高度保守的通路,它调节癌症生物学的许多方面[14]。ERK在OSCC中显著上调,ERK通路的错误调节促进了OSCC的起始和进展[15]。因此,靶向ERK通路是治疗OSCC的一种很有前景的治疗策略。先前的研究发现,NETO2介导的m6A修饰可以调节下游mRNA的剪接、转运、稳定性和翻译[7]。我们的数据显示,NETO2敲低降低了ERK的表达水平,表明NETO2可能参与调节ERK的稳定性。然而,NETO2是否通过介导m6A修饰调节ERK mRNA的稳定性值得进一步研究。此外,我们发现使用EGF激活ERK通路可以挽救NETO2敲低细胞的生长、迁移和侵袭能力,表明NETO2通过调节ERK信号通路促进OSCC进展。
总之,目前的研究表明,OSCC组织中高水平的 NETO2表达与患者的不良预后相关。 NETO2是一种重要的癌蛋白,可能激活ERK信号通路以促进OSCC细胞的增殖、侵袭和转移。因此,NETO2可能作为OSCC新的预后指标和潜在治疗靶点。
利益相关声明:所有作者声明不存在利益冲突。
作者贡献说明:陆珣珣负责负责论文撰写和实验设计,韦曙平负责论文研究, 韦富贵负责论文修改。
