强蓝光照射诱发大鼠视网膜组织结构及功能变化的实验研究
2023-11-08王文晶任建涛黄旭东
王文晶,盛 帅,任建涛,黄旭东
0 引言
研究表明,波段为400~500nm的蓝光是导致视网膜光损伤的主要危险因素[1-3],低照度蓝光可诱发慢性视网膜光损伤,高照度(>1000lx)蓝光亦可致急性视网膜光损伤,最终导致视网膜组织病理学改变[4-6]和血-视网膜屏障功能破坏[7]。目前针对视网膜光损伤[8]的研究主要集中于分子机制[6, 9-11]及组织细胞学改变,但对于较为直观的影像、功能及活体形态学的检查研究较少,本研究采用眼底荧光素血管造影(fundus fluorescein angiography,FFA)、光学相干断层扫描(optical coherence tomography,OCT)和石蜡病理组织切片苏木素-伊红(HE)染色法对不同时长强蓝光照射导致的大鼠视网膜损伤进行分析。
1 材料和方法
1.1材料
1.1.1实验动物选择8周龄健康无特定病原体(SPF)级SD雄性大鼠48只,购自济南朋悦实验动物繁育有限公司(合格证号:37072610100978471),实验前大鼠进行眼底筛查,排除原有眼部疾病,实验动物的饲养和使用均遵循国家科学技术委员会《实验动物管理条例》的相关规定,本研究经潍坊眼科医院动物实验伦理委员会审批(批文号:2020-院内伦审-01-01)。
1.1.2主要试剂及仪器主要试剂:苏木素-伊红(HE)染色试剂盒(北京索莱宝科技有限公司);复方托吡卡胺滴眼液(参天制药有限公司);历设得荧光素钠注射液(Cardinal Health Manufacturing Services B.V.公司);玻璃酸钠滴眼液(URSAPHARM Arzneimittel GmbH,德国);无水乙醇(江苏强盛功能化学股份有限公司)。主要仪器:多聚赖氨酸黏附载玻片(江苏世泰实验器械有限公司);病理组织包埋盒(江苏世泰实验器械有限公司);10%中性福尔马林组织固定液(江苏世泰实验器械有限公司);FFA(海德堡同步共焦激光眼底荧光造影仪,德国);OCT(海德堡SPECTRALIS光学相干断层扫描仪,德国);465nm LED蓝光灯板(徐州爱佳电子科技有限公司);石蜡病理切片机、石蜡病理包埋机、摊片机(德国Leica公司)。
1.2方法
1.2.1实验设备的制作采用545mm×395mm×200mm的PP塑料饲养笼,饲养笼四周内侧壁安装反光面板,定制波长为465±5nm可调节功率的面阵式LED灯蓝光发光板[12],将发光板置于饲养笼上方,调节LED灯亮度与高度,根据预实验中不同蓝光光照度下大鼠眼底改变情况,且考虑到本实验研究因素为强蓝光,将1000±100lx作为本研究的光照度值。
1.2.2实验分组选取8周龄SPF级健康SD雄性大鼠48只,随机分为对照组(n=12)和实验组(n=36),其中对照组大鼠每日接受自然光照;实验组大鼠根据光照时间不同分为3个组,每组12只,每日分别接受波长465±5nm、光照度1000±100lx的蓝光照射3、6、12h,照射过程中每隔3h人为搅动大鼠,使之处于活动状态,以尽量保证大鼠眼睛接受足够时长的光照。本研究采取标准饲养方法,连续光照8wk,采用OCT、FFA和石蜡病理组织切片观察不同方位及不同分层视网膜厚度、视网膜组织结构和功能变化。
1.2.3OCT检查对照组和实验组大鼠采用复方托吡卡胺滴眼液充分散瞳,2%戊巴比妥钠麻醉剂(2mL/kg)腹腔注射麻醉,玻璃酸钠滴眼液湿润角膜,OCT扫描测量大鼠视盘上方、下方、鼻侧、颞侧距视盘边缘约2mm处的视网膜总厚度,使用系统自带软件手动测量各方位视网膜总厚度,即视网膜内界膜(internal limiting membrane,ILM)至视网膜色素上皮(retinal pigment epithelium,RPE)层的厚度,取各方位视网膜总厚度的平均值作为平均视网膜总厚度(mean total retinal thickness,mTRT)。为进一步分析大鼠视网膜不同分层厚度的变化,分别于上述相同位置测量视网膜ILM-内核层(inner nuclear layer,INL)、外丛状层(outer plexiform layer,OPL)-光感受器外节段(outer segment,OS)和RPE层厚度,取4个方位视网膜各层厚度的平均值作为该层视网膜最终厚度值。
1.2.4FFA检查对照组和实验组大鼠快速腹腔注射10%荧光素钠注射液(0.8mL/kg)后,立即拍摄眼底视盘及其余各方位视网膜血管造影图像,保存图片进行影像学分析。
1.2.5视网膜石蜡病理组织切片制备对照组和实验组大鼠腹腔注射过量戊巴比妥钠麻醉剂麻醉致死,快速摘取眼球,剪除多余组织,生理盐水冲洗眼球后置于10%中性福尔马林组织固定液中24~48h。取出眼球于1×PBS中性缓冲液中浸泡约1h,沿角膜缘剪除角膜,摘除晶状体,将眼球剩余组织依次浸入由低浓度到高浓度的梯度乙醇溶液及二甲苯溶液中脱水,60℃浸蜡2h,将眼球矢状面平行于包埋盒进行石蜡包埋。将石蜡标本垂直固定于切片机,调整切片厚度4μm,平行于视神经进行切片,于45℃温水中将切片展平,铺于多聚赖氨酸黏附性载玻片后标记,置于60℃温箱中烘干1.5h。取出载玻片,再依次置于二甲苯溶液、由高浓度到低浓度的梯度乙醇溶液内脱蜡、复水,HE染色,脱水、透明,中性树胶封片,电子显微镜下观察视网膜各层组织形态学改变。

2 结果
2.1各组大鼠OCT检查结果采用OCT扫描检查各组大鼠视网膜,对照组和3h实验组大鼠视网膜各层结构信号清晰,神经纤维层和RPE层为高反射信号,内丛状层、外丛状层为中等反射信号,内核层、外核层和感光细胞层为低反射信号(图1A、B);6h和12h实验组大鼠外核层厚度明显变薄,光感受器内外段(inner segment/outer segment,IS/OS)表现为不规则高反射信号,局部RPE层信号减弱(图1C、D)。
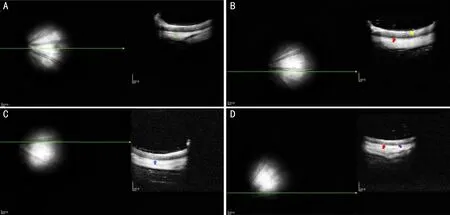
图1 各组大鼠视网膜OCT检查结果 A:对照组大鼠视网膜各层结构清晰,RPE层呈均匀高反射信号(绿箭头),可清晰分辨脉络膜层;B:3h实验组大鼠视网膜各层结构清晰,外核层(红箭头)厚度明显大于内核层(黄箭头),RPE层信号连续;C:6h实验组大鼠视网膜外核层厚度明显变薄,IS/OS界限模糊(蓝箭头),RPE层信号模糊;D:12h实验组大鼠视网膜内核层见多个点团状高反射信号(紫箭头),外核层(红箭头)厚度明显小于内核层,IS/OS和RPE层明显萎缩,视网膜与脉络膜界限模糊。
各组大鼠组内4个方位视网膜厚度差异均无统计学意义(P>0.05),但各组大鼠组间4个方位视网膜厚度差异均有统计学意义(P<0.05),且对照组和3h实验组大鼠上方视网膜厚度差异无统计学意义(P=0.071),其余各方位视网膜厚度组间两两比较,差异均有统计学意义(P<0.05),见表1。各组大鼠平均视网膜总厚度差异有统计学意义(P<0.05),且各组间两两比较差异均有统计学意义(P<0.05);各组大鼠ILM-INL厚度差异有统计学意义(P<0.05),且对照组与3h和12h实验组大鼠ILM-INL厚度差异均有统计学意义(P<0.05),其余各组间两两比较,差异均无统计学意义(P>0.05);各组大鼠OPL-OS厚度差异有统计学意义(P<0.05),且各组间两两比较,差异均有统计学意义(P<0.05);各组大鼠RPE层厚度差异有统计学意义(P<0.05),且对照组与3h和6h实验组、3h与6h实验组大鼠RPE层厚度差异均无统计学意义(P>0.05),12h实验组与其余各组比较差异均有统计学意义(P<0.05),见表2。

表1 各组大鼠不同方位视网膜厚度比较
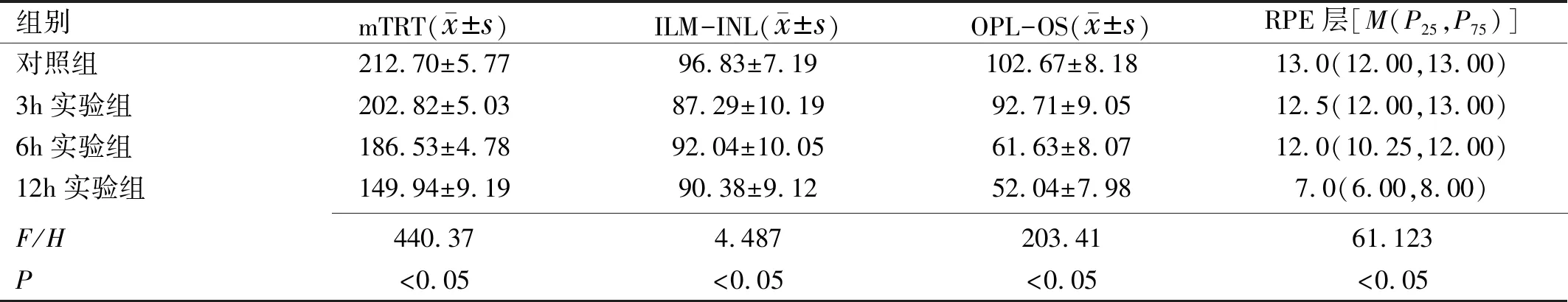
表2 各组大鼠各层视网膜厚度比较 μm
2.2各组大鼠FFA检查结果FFA检查结果显示,所有大鼠视盘均位于视网膜后极部正中央,视网膜血管走行呈放射状,对照组(图2A~C)和3h实验组(图2D~F)大鼠视网膜动静脉血管粗细均匀且连续,动静脉管径比值为1∶2~2∶3,视盘及视网膜未见明显荧光渗漏;6h实验组大鼠视网膜血管充盈,动静脉粗细均匀,走行正常,视盘无荧光渗漏,中周部视网膜可见点片状荧光渗漏(图2G~I);12h实验组大鼠视网膜动静脉血管变细,毛细血管走行紊乱,全视网膜散在荧光渗漏、弥漫点团状低荧光及透见荧光,脉络膜背景荧光增强(图2J~L)。
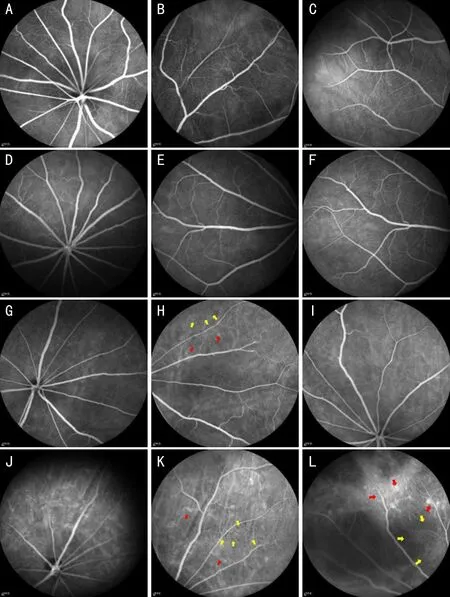
图2 各组大鼠FFA检查结果 A~F:对照组(图A~C)和3h实验组(图D~F)大鼠视网膜血管充盈、走行正常,无明显荧光渗漏;G~I:6h实验组大鼠视网膜视盘处无荧光渗漏,中周部视网膜可见点片状荧光渗漏(红箭头)及少量点团状低荧光区(黄箭头);J~L:12h实验组大鼠全视网膜散在点团状低荧光(黄箭头)、斑片状透见荧光及大面积荧光渗漏(红箭头),脉络膜背景荧光增强。
2.3各组大鼠视网膜组织形态变化HE染色观察各组大鼠视网膜及脉络膜组织形态学变化情况,对照组大鼠视网膜组织结构正常,层次分明(图3A);3h实验组大鼠视网膜视细胞排列约8~9层,细胞数目较对照组稍减少,间隙增大,排列紊乱,未见其他明显病理组织学改变(图3B);6h实验组大鼠视网膜与3h实验组相比,视细胞层细胞排列明显紊乱,细胞间隙增大,层数减少至5~6层,部分细胞核染色欠均匀,出现核固缩、核碎裂病理学表现,RPE层局部萎缩变薄,细胞排列稀疏,脉络膜纤维结缔组织疏松水肿(图3C);12h实验组大鼠视网膜结构紊乱,神经节细胞层可见少量细胞核淡染,视细胞层细胞数目明显减少,局部视细胞消失,RPE层细胞排列稀疏紊乱,可见脉络膜结缔组织疏松、水肿,节细胞及双极细胞层未见明显病理改变(图3D)。
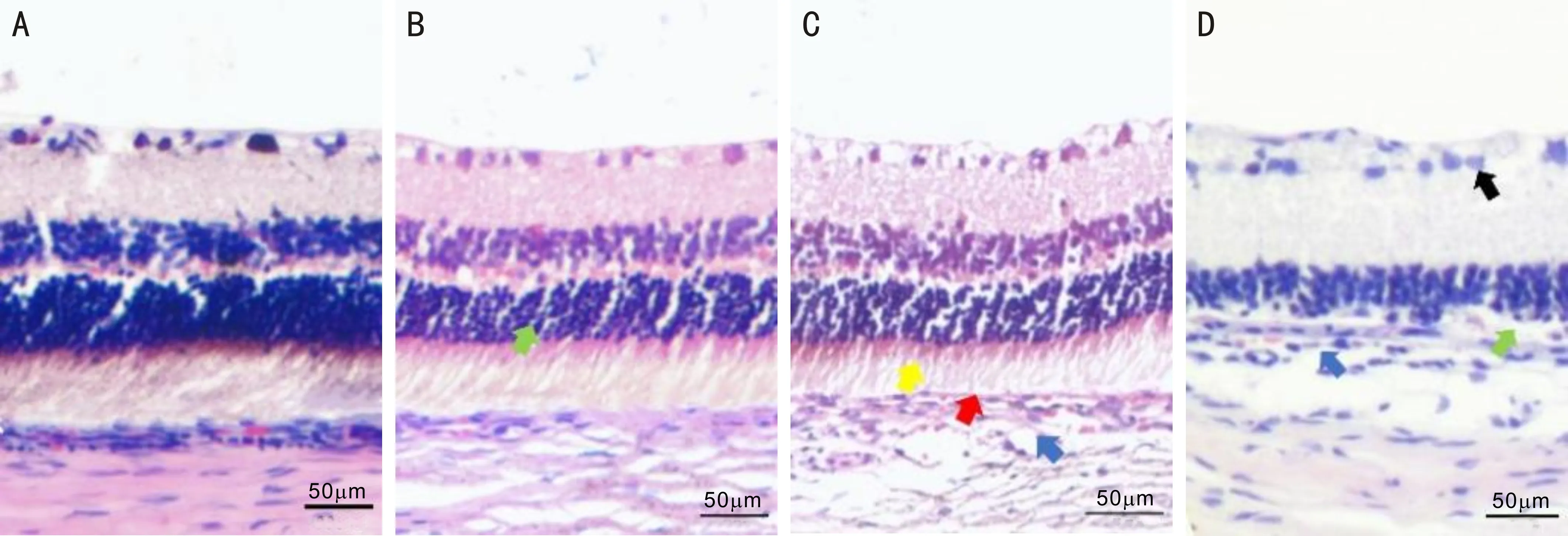
图3 HE染色观察各组大鼠视网膜组织形态变化 A:对照组大鼠视细胞层排列紧密,细胞排列整齐,视网膜RPE层连续,脉络膜为富含血管的疏松结缔组织;B:3h实验组大鼠视网膜视细胞层细胞排列稍紊乱,核间隙增大(绿箭头);C:6h实验组大鼠视网膜视细胞排列明显紊乱,细胞间隙增大,可见细胞核固缩、核碎裂,感光细胞层内外段排列稀疏(黄箭头),部分RPE层萎缩变薄(红箭头),脉络膜结缔组织疏松水肿(蓝箭头);D:12h实验组大鼠视网膜结构明显紊乱,神经节细胞层部分细胞核淡染(黑箭头),视细胞数量明显减少,局部视细胞消失(绿箭头),局部RPE层萎缩变薄,脉络膜纤维结缔组织疏松水肿(蓝箭头)。
每组随机选取10张带有视盘组织的视网膜组织切片,利用Image Pro Plus 6.0图像分析软件测量距离视盘边缘约2mm处视网膜视细胞数目,以50μm为1个单位长度,计算单位长度内视细胞数目,结果显示对照组、3h实验组、6h实验组、12h实验组视网膜单位长度内视细胞数目分别为189.30±17.67、107.20±13.83、84.90±8.48、50.40±11.91个,差异有统计学意义(F=194.49,P<0.05),且各组间两两比较,差异均有统计学意义(P<0.05)。
3 讨论
蓝光导致的视网膜光损伤是目前研究的热点。既往研究发现,长期低强度蓝光(<100lx)照射可引起慢性视网膜组织结构损伤,损伤程度随累积的光照时间延长而加重[13];急性光损伤可导致不可逆的视功能急剧下降伴视网膜局灶性损伤,这种损伤在光照停止后随着时间推移继续发展,可持续数周之久,但与损伤相关的致病因子则逐渐减少[14-15]。以往研究多主要集中于分子机制及组织细胞学改变[16-19],但对于较为直观的影像、功能及活体形态学的检查研究少有报道。
本实验除了通过石蜡病理组织切片HE染色观察大鼠视网膜组织形态学改变,还比较了单位长度视网膜视细胞数,发现实验组大鼠视网膜RPE层萎缩变薄,视细胞数目减少、排列紊乱,出现细胞核固缩、核碎裂,12h实验组内核层也出现局部细胞核淡染和较少数细胞核固缩、核碎裂,神经节细胞层部分细胞核淡染。既往研究多集中于对视网膜感光细胞层及RPE层的损伤和分子机制的研究[20-25],近年来针对蓝光照射导致神经节细胞损伤的研究越来越受关注,多项研究发现蓝光可诱发视网膜神经节细胞不可逆的损伤[26-27]。Ziókowska等[26]研究发现强蓝光诱导有色素大鼠内在光敏性视网膜神经节细胞(intrinsically photoreceptive retinal ganglion cells,ipRGCs)中视黑素的免疫反应性降低,ipRGCs数量显著减少,神经纤维层轴突和内丛状层树突损伤,正常神经节细胞亦出现轻微损伤。Guo等[27]研究也发现蓝光照射后视网膜神经节细胞轴突结构破坏,细胞活力下降,出现了明显的细胞凋亡和坏死。本研究发现,强蓝光可诱导RPE层、光感受器细胞层、外核层、内核层和神经节细胞层出现细胞凋亡、坏死的病理学表现,但病变轻重程度不同,与上述研究结果一致。此外,本研究通过比较各组视网膜视细胞数目更直观地体现了蓝光照射对视网膜感光细胞造成的损伤,且视细胞数目呈时间依赖性减少。Nakamura等[24]研究证实在高照度蓝光致视网膜损伤中,RPE层病理变化早于外核层,本研究中12h实验组与3、6h实验组相比,RPE层萎缩明显,相对应的视细胞层也出现明显的病理学改变,视细胞数目减少甚至消失,也体现了RPE层损伤对视细胞凋亡的影响。
既往关于光损伤致视网膜厚度变化的研究多集中于对视网膜病理切片的测量,本研究采用OCT测量大鼠视网膜厚度及分层测量视网膜厚度,相对于离体的病理组织切片,对不同方位视网膜厚度的变化进行了活体实时观察,其准确性更高,观察更细致。本研究发现,蓝光照射至第8wk,对照组与3h实验组大鼠上方视网膜厚度比较无差异,但各组大鼠下方、鼻侧、颞侧视网膜厚度比较均具有显著差异,故推测光照对不同方位视网膜厚度的影响不一致,但需要更多的数据支持。本研究还发现,各实验组大鼠ILM-INL层厚度变化不明显,即ILM-INL层厚度受光照时间影响较小,而各实验组大鼠OPL-OS层厚度组间两两比较均有显著差异,表明光照对视网膜损伤主要集中于OPL-OS层,此结果与视网膜病理组织切片观察的视细胞数目减少结果一致。此外,本研究发现,与3、6h实验组相比,12h实验组大鼠RPE层厚度明显变薄,相对应的外核层和光感受器内外段也出现更明显的病理学改变,提示视网膜损伤程度呈时间依赖性加重。
本研究中,FFA检查结果示,6、12h实验组大鼠视网膜出现荧光渗漏和透见荧光,结合OCT和HE染色结果,3h实验组大鼠在强蓝光照射第8wk时视网膜组织已出现病理学改变,且厚度变薄,但FFA检查结果无明显异常,提示3h实验组视网膜发生了组织形态学改变,而血管通透性未改变,随着蓝光照射时间的延长,6、12h实验组大鼠视网膜及小血管功能逐渐受损。
综上所述,强蓝光照射可导致视网膜视细胞萎缩、凋亡及RPE层萎缩,视网膜厚度变薄,血管屏障功能破坏,其变化程度受光照时间影响。本研究不足之处在于未对光照导致的视网膜变薄进行动态的测量研究,下一步研究将会扩大样本量,研究早期视网膜变薄的具体过程,并对光照后损伤的视网膜修复过程进行研究。
