紫杉醇对视网膜Müller细胞的影响
2023-11-08席懿璇叶亚婷窦国睿常天芳牛亚丽1周子义储昭节
席懿璇,叶亚婷,窦国睿,常天芳,牛亚丽1,,周子义,储昭节
0 引言
紫杉醇(Paclitaxel,PTX)是20世纪90年代从红豆杉中分离提纯出的四环二萜类天然抗肿瘤药物,具有聚合和稳定微管的作用,致使快速分裂的肿瘤细胞在有丝分裂阶段被牢牢固定,使癌细胞复制受阻断而死亡[1]。PTX对于食道癌、乳腺癌、卵巢癌和白血病等多种疾病具有一定的疗效,但随着临床的不断深入研究,发现PTX在肿瘤疾病的治疗过程中可导致一系列不良反应,骨髓抑制、神经毒性、消化道反应、过敏反应和肌肉疼痛、关节疼痛等均为常见不良反应[2]。近年来关于PTX化疗导致的黄斑水肿病例偶有报道[3-4],但并未对其具体发生机制进行阐述。而推测集中于PTX干扰Müller细胞所维持的视网膜神经感觉渗透梯度,对Müller细胞具有潜在毒性[5]。为明确PTX对Müller细胞的影响,本研究将体外培养的Müller细胞作为实验对象,观察PTX对Müller细胞增殖、细胞周期、形态及屏障功能的影响,为阐明PTX导致黄斑水肿的具体机制奠定基础。
1 材料和方法
1.1材料鼠Müller原代细胞为自行提取。DMEM 培养基(高糖)购于Gibco公司(美国)。PTX购于MedChemExpress(MCE)公司(美国)。流式细胞仪及配套试剂盒购自Invitrogen(美国)。Cell Counting Kit-8(CCK8)试剂盒购自武汉华美公司(美国)。IL-6(ab259341)、TNF-α(ab307164)、碳酸酐酶十四(CA XIV,ab184180)、MCP-1 (ab308522)、VEGF (ab32152)、鬼笔环肽(ab176753)抗体购自Abcam公司(英国)。β-actin(81115-1-RR)抗体及其二抗购自武汉三鹰公司。酶标仪(ELX800,Bio-Teck,美国)。
1.2方法
1.2.1细胞的提取及分组将新生第6~8d C57BL/6J小鼠腹腔麻醉后,摘取眼球浸泡在10% DMEM中2h左右。在37℃下消化45min(消化液:DMEM 0.5mL,0.25%胰蛋白酶1mL,胶原蛋白酶Ⅰ 1mL)。消化完成后剥取视网膜并制成细胞悬液,500g离心5min,用10% DMEM重悬后通过100μm筛,密度按每6~9只眼接种在100mm培养皿中孵育。当细胞融合至70%左右,进行后续传代培养或后续实验。使用免疫荧光鉴定小鼠视网膜中提取的Müller细胞。免疫荧光结果显示Müller细胞特异性标记物AQP4和GS呈阳性(图1A)。将Müller细胞分为两组:对照组(正常培养)、PTX药物处理组,药物处理浓度依次为0.005、0.05、0.5、5mg/L。
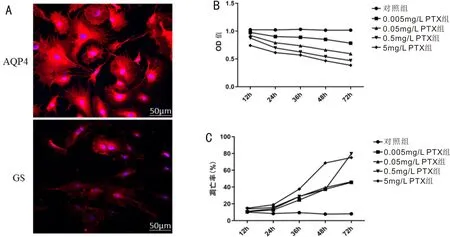
图1 PTX药物刺激后对Müller细胞增殖和凋亡的影响 A:Müller细胞鉴定图;B:各浓度细胞不同时间点增殖图;C:各浓度细胞不同时间点凋亡图。
1.2.2CCK8法检测细胞增殖情况100μL的Müller细胞以每毫升7×104个接种于96孔板中,将96孔板放置于37℃、5% CO2细胞培养箱中进行培养,培养至细胞贴壁后,更换培养基培养12h,按照对照组、0.005、0.05、0.5、5mg/L药物浓度梯度分别培养12、24、36、48、72h,每个孔中加入CCK-8溶液10μL继续孵育3h;酶标仪测定450nm处吸光度(OD)值。
1.2.3流式细胞术检测细胞凋亡情况将对数生长期的Müller细胞以每毫升7×104个接种于96孔板中,将其放置37℃、5% CO2细胞培养箱中培养,细胞贴壁后更换无血清培养基继续培养12h,按照对照组、0.005、0.05、0.5、5mg/L药物浓度梯度分别培养12、24、36、48、72h,0.1%胰蛋白酶消化Müller细胞,1000r/min离心5min;加入Annexin V-FITC,室温下避光孵育20min,加入碘化丙啶(PI)染色液混匀,冰浴避光孵育5min。使用流式细胞仪检测荧光染色后的细胞,并使用BD FACSuite软件进行分析,绿色荧光为Annexin V-FITC,红色荧光为PI。
1.2.4流式细胞术检测细胞周期细胞培养方法与1.2.3相同,细胞贴壁后更换无血清培养基培养12h,然后按照对照组、0.05mg/L药物浓度培养24h,0.1%胰蛋白酶消化,加入预冷70%乙醇并固定24h,固定后加入Trition X-100、RNA酶,37℃水浴30min,PI染色。流式细胞仪检测以标准程序进行测定,测定结果计数,对测定结果进行整理与分析。
1.2.5免疫荧光观察细胞形态将Müller细胞以每毫升2×105个的接种密度接种到细胞共聚焦培养皿中培养,细胞培养至70%时更换培养基培养12h,将对照组、0.05mg/L PTX的培养基以换液方式加入共聚焦培养皿中培养24h;4% PFA室温固定20~30min,然后在1%牛血清白蛋白(albumin from bovine serum,BSA)和0.5% Trition X-100[磷酸缓冲盐溶液(phosphate buffer saline,PBS)稀释]的封闭溶液中封闭30min。加入鬼笔环肽(Phalloidin)染料(1∶200),并用上述封闭液稀释, 4℃湿盒中孵育24h。PBS洗涤共聚焦培养皿,用含4,6-二氨基-2-苯基吲哚(4,6-diamino-2-phenyl indole,DAPI)封片液进行染色密封,在激光共聚焦显微镜下观察并拍照。
1.2.6Westernblot检测蛋白表达水平分别收集对照组、0.05mg/L PTX处理24h后的细胞至Ep管,加入适量的RIPA细胞裂解液和PMSF蛋白酶抑制剂(100∶1)进行离心,吸取上清为细胞总蛋白;加入30μg蛋白进行电泳分离,将蛋白转至PVDF膜上,转膜时间根据蛋白自身分子量决定;转膜后放置在TBST配制的5%脱脂牛奶中,常温条件下封闭2h;将封闭完成的PVDF膜与IL-6、TNF-α、CA XIV、MCP-1、VEGF抗体(1∶1000)4℃下孵育24h,孵育后用TBST洗膜;孵育完成的PVDF膜与同源二抗(1∶10000)进行共同孵育,常温条件下共同孵育2h,孵育后用TBST洗膜。在PVDF膜上淋洒适量ECL化学发光液,在暗室中进行扫膜与成像。利用Image J Program扫描和测量条带的相对光密度(内参β-actin)。
1.2.7qRT-PCR检测mRNA表达水平收集对照组、0.05mg/L PTX处理24h后的细胞至Ep管(经DEPC处理)中,加入适量的Trizol溶液使其完全裂解;加入1/5总体积的氯仿,充分混合并离心;将上层水相移至新管并加入同体积的异丙醇溶液低温离心,移除上清液后加入无水乙醇再次低温离心,倒出上清液,使Ep管干燥并加入DEPC水,而后使用TaKaRa试剂盒进行RNA反转录,反转录体系为2μL 5×PrimeScript RT Master Mix、2.5μL Total RNA、5.5μL RNase Free dH2O,37℃下反应15min。采用TaKaRa PrimeScritTMRT(Perfect Real Time)试剂盒进行qRT-PCR实验,采用β-actin为作为内参对照,qRT-PCR体系为10μL TB Green Premix Ex Taq Ⅱ、0.8μL PCR Reverse Primer(10μmol/L)、0.8μL PCR Forward Primer(10μmol/L)、0.4μL ROX Reference Dye、6μL RNase Free ddH2O和2μL cDNA。反应程序为95℃变性10s、60℃退火20s、72℃延伸20s。
统计学分析:使用软件GraphPad Prism v9.1.0.221.进行统计学结果分析,所有的数据均使用均数±标准差表示,两组间比较采用独立样本t检验,P<0.05表示差异具有统计学意义。
2 结果
2.1PTX对细胞增殖的影响CCK8法检测细胞增殖结果显示,PTX组在处理细胞后不同时间点细胞增殖率较对照组均下降(图1B)。低浓度(0.005、0.05mg/L)PTX处理细胞12h后细胞增殖未受到抑制,细胞存活率为93.1%,高浓度(5mg/L)PTX刺激细胞72h后细胞存活率为37.9%,说明PTX抑制Müller细胞增殖,且与时间和药物浓度呈依赖性。
2.2PTX对细胞凋亡的影响流式细胞术检测细胞凋亡结果显示,PTX组在刺激细胞后不同时间点细胞凋亡率较对照组均升高(图1C)。在PTX组不同处理条件中,对照组、0.005、0.05、0.5、5mg/L PTX刺激细胞12h,细胞凋亡率无明显差异。不同浓度PTX处理细胞48h时,细胞凋亡率较对照组均升高(图1C)。PTX组处理细胞72h时,细胞坏死。在PTX不同处理条件中,0.05mg/L PTX处理24h细胞凋亡率最低,因此在后续实验中选择该药物浓度和作用时间。
2.3PTX对细胞周期的影响流式细胞仪检测细胞周期结果显示,0.05mg/L PTX药物处理细胞24h后,细胞周期较对照组发生改变(图2),PTX药物将细胞阻滞于G2-M期。
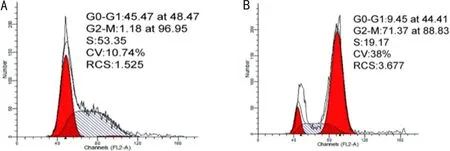
图2 流式细胞仪检测细胞周期 A:对照组;B:0.05mg/L PTX组。
2.4PTX对细胞形态的影响0.05mg/L PTX药物处理细胞24h后,细胞形态发生明显变化(图3)。正常细胞呈现细长纤维状,细胞形态比较清晰、成簇或平行排列。而在PTX药物的刺激下,细胞数量明显减少且细胞皱缩趋于圆形。
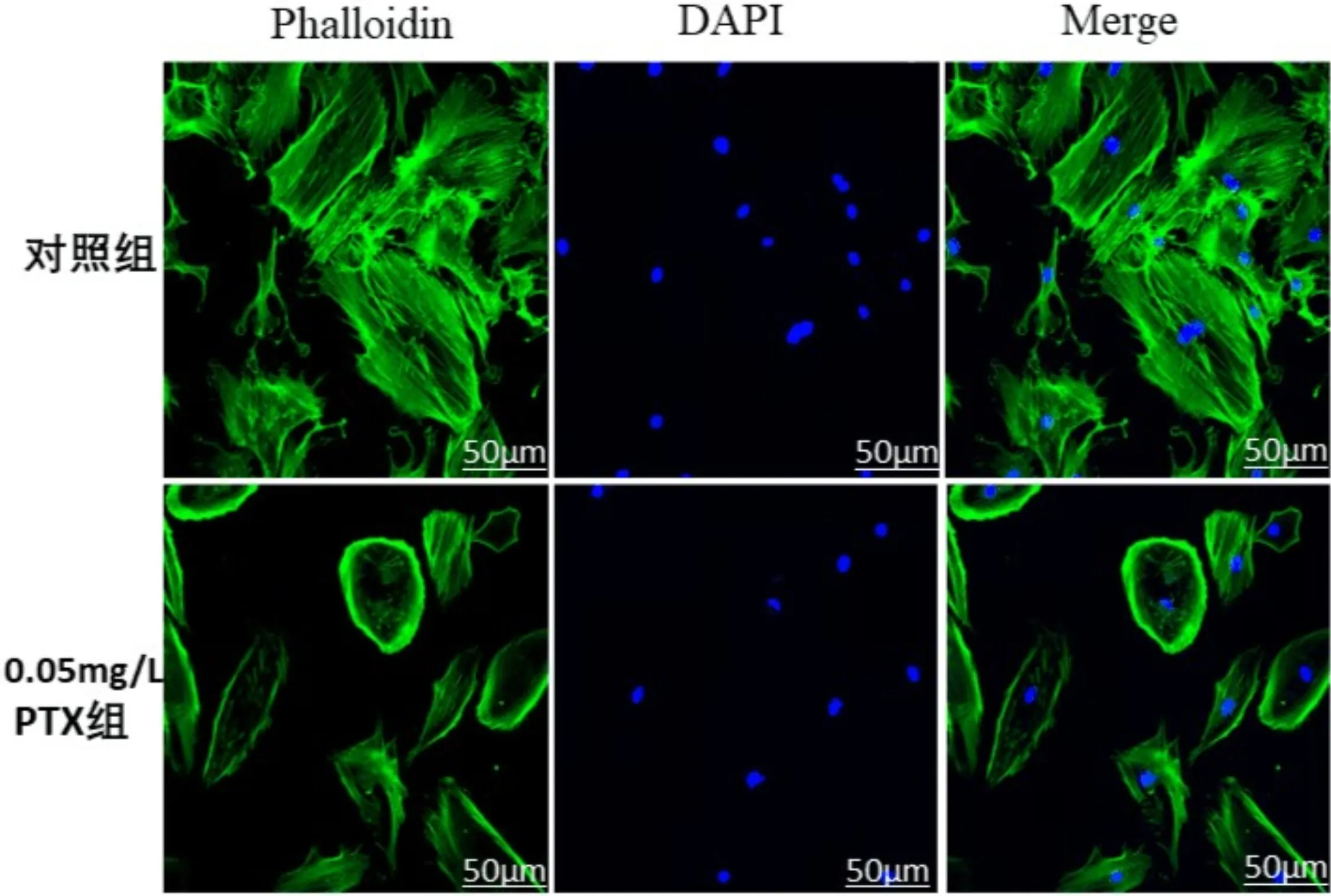
图3 免疫荧光观察细胞形态。
2.5Westernblot和qRT-PCR检测相关因子表达结果Western blot实验结果表明,0.05mg/L PTX处理细胞24h后与对照组相比Bcl-2表达降低;Bax表达较对照组升高(图4A、B,表1),差异均有统计学意义(P<0.01),CA XIV较对照组表达升高,VEGF较对照组表达降低(图4C、D,表1),差异均有统计学意义(P<0.05)。

表1 两组细胞间相关蛋白表达情况比较
Western blot与qRT-PCR实验结果表明,0.05mg/L PTX处理细胞24h后细胞炎症因子IL-6、TNF-α及趋化因子MCP-1蛋白相对表达较对照组均升高(图5),差异具有统计学意义(均P<0.05)。当PTX停止处理24~72h后,Western blot结果显示炎症因子IL-6、TNF-α及细胞趋化因子MCP-1蛋白相对表达较0.05mg/L PTX药物组均降低(图6),差异均有统计学意义(FTNF-α=3.712,FIL-6=9.341,FMCP-1=5.142,均P<0.05)。
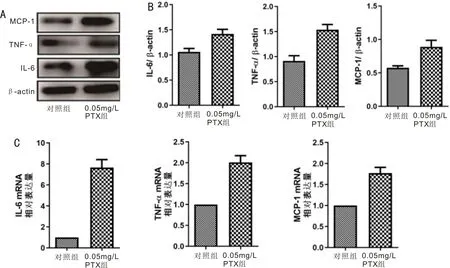
图5 PTX刺激Müller细胞后MCP-1、TNF-α、IL-6蛋白表达水平与mRNA表达水平示意图 A:蛋白电泳图;B:IL-6、MCP-1、TNF-α蛋白表达统计图;C:IL-6、MCP-1、TNF-α mRNA相对表达统计图。
3 讨论
紫杉醇是在紫衫中提取出的具有抗肿瘤作用的物质[6],Wani等[7]明确了提取物关键成份的结构组成,紫杉醇具有较强的疏水性,在体内释放后可在释放位置有效保留[8],紫杉醇也具有抑制平滑肌细胞增殖的作用[9-10]。紫杉醇的这些特性使得其在肿瘤方面的疗效显著,但临床应用时也会引起较多不良反应,黄斑水肿是不良反应之一,可对视力造成威胁,发病率约在0.5%[11]。
黄斑水肿是指血-视网膜屏障(blood-rentinal barrier,BRB)破坏后液体在黄斑区视网膜内积聚[12],机制可能是视网膜血管内皮细胞屏障或色素上皮细胞外屏障的功能缺陷而导致细胞外液外漏,在黄斑区外丛状层Henle纤维之间积存而形成黄斑水肿[13]。而Müller细胞作为连接视网膜血管与神经元,维持水与K+稳态的重要分子,当Müller细胞出现功能障碍时便会造成液体积聚造成黄斑水肿[14]。PTX导致黄斑水肿的机制并不明确,没有明确推荐的治疗方案。在lvarez-Fernández等[15]研究中90%以上的病例的治疗方案是停止使用紫杉醇。也有其他的药物治疗手段如碳酸酐酶抑制剂[16]、贝伐单抗[17]和地塞米松玻璃体植入物[18]等,但治疗效果欠佳。
黄斑水肿种类多样,常见的黄斑水肿如糖尿病性黄斑水肿(diabetic macular edema,DME)、视网膜静脉阻塞继发黄斑水肿(retinal vein occlusion-macular edema,RVO-ME),但紫杉烷类药物即PTX所致黄斑水肿临床特点与上述常见黄斑水肿不同,具有黄斑囊样水肿(CME)特征;光学相干断层扫描(optical coherence tomography,OCT)检查结果显示黄斑中心凹厚度增加,黄斑囊样改变,但荧光素眼底血管造影(fundus fluorescein angiography,FFA)检查结果显示无荧光渗漏或渗漏极小[19-20]。PTX引起黄斑水肿的具体机制并不明确,目前已经提出了几种假说:(1) Kanakis等[21]提出的PTX导致的黄斑水肿的潜在原因可能是发生在中层和深层神经丛水平的水通道蛋白被影响,水通道蛋白在细胞中取决于微管的功能,而微管的功能会因为PTX的作用而改变,最终由于这种水运输的途径被阻塞而出现水肿;(2)有学者认为眼底血管造影中的无渗漏或极少渗漏,可能是由于PTX对视网膜血管内皮损伤较轻,导致的黄斑水肿可能是PTX对Müller细胞的毒性作用[5],Müller细胞功能出现障碍造成黄斑部分液体积聚[14]。黄斑水肿的发生机制到底是PTX影响微管功能从而影响水通道蛋白导致黄斑水肿,还是PTX对于Müller细胞的潜在毒性,亦或是二者均参与仍需进一步研究阐明。
而本实验结果表明,PTX可以抑制体外培养的Müller细胞,且与时间和药物浓度呈依赖性。0.05mg/L PTX处理细胞24h,细胞增殖受到明显抑制,且促进了细胞凋亡。PTX处理Müller细胞后,细胞周期被阻滞于G2-M期,细胞形态也由形态清晰、细长纤维状的正常形态趋于圆形,细胞数量显著减少。长时间使用药物PTX刺激Müller细胞后,Müller细胞基本坏死,且短时间高浓度的药物处理Müller细胞使细胞凋亡加快。不同浓度PTX刺激细胞时的炎症因子如IL-6、TNF-α、MCP-1的表达升高,但这种高表达可通过停止药物刺激缓解,提示PTX致使黄斑水肿的具体机制可能与细胞炎症关系不显著。目前我们的研究结果表明PTX对Müller细胞的潜在毒性导致Müller细胞功能出现障碍、视网膜屏障被破坏,造成黄斑部分液体积聚,引起了此类黄斑水肿的发生。
综上,紫杉烷类药物对视网膜存在潜在毒性,其通过抑制Müller细胞的增殖、促进其凋亡、阻滞细胞周期、改变细胞形态等造成视网膜屏障破坏,可能参与引发黄斑水肿,具体机制有待进一步研究。
