两种结核分枝杆菌氟喹诺酮类药物耐药性检测方法比较及不一致原因初探
2023-11-08詹建游国庆何霞孔珏颖刘文果冯鑫胡彦
詹建 游国庆 何霞 孔珏颖 刘文果 冯鑫 胡彦
【Fundprogram】 Sichuan Provine Medical Scientific Research Project (19PJ155); Chongqing Tuberculosis Control Institute Medical Scientific Research Project (2022CQJFS03, 2022CQJFS05)
耐药结核病是全球公共卫生的严重威胁。据世界卫生组织(WHO)[1]估算,2021年全球新发耐多药/利福平耐药结核病(multidrug-resistant/rifampicin-resistant tuberculosis,MDR/RR-TB)患者约45万例,MDR/RR-TB治疗成功率仅为60%。氟喹诺酮类药物[fluoroquinolones,FQs;左氧氟沙星(levofloxacin,Lfx)和莫西沙星(moxifloxacin,Mfx)]是治疗MDR-TB的核心药物[2-3],若结核分枝杆菌对FQs耐药,就会成为准广泛耐药结核病(pre-extensive drug-resistant tuberculosis,pre-XDR-TB)甚至广泛耐药结核病(extensive drug-resistant tuberculosis,XDR-TB),治疗更加困难。因此,FQs耐药性检测对pre-XDR-TB和XDR-TB的早期诊断及合理用药至关重要。
目前,结核病耐药性检测方法主要有两大类,表型药物敏感性(简称“药敏”)试验和分子药敏试验。相比一线抗结核药物,FQs等二线抗结核药物的表型药敏试验开展情况并不理想,其耗时长、操作繁琐且需要专门的生物安全实验室。分子药敏试验由于具有简便、快速及自动化的特点而受到青睐。笔者拟探讨荧光PCR熔解曲线法(简称“熔解曲线法”)对FQs(Lfx和Mfx)耐药性的诊断价值,并与表型药敏试验结果进行比较,对不一致结果的原因进行分析。
资料和方法
一、一般资料
1.标本来源:采用简单随机抽样的方法,随机选取2019年1月至2020年6月期间来自重庆市39个区(县)结核病防治机构经菌种鉴定和比例法药敏试验确定为MDR-TB的126例患者的临床分离株。本研究得到重庆市结核病防治所伦理委员会的批准(编号:KY202203)。
2.主要仪器及试剂:SLAN-96S型实时荧光定量PCR仪(购自上海宏石医疗科技有限公司)、结核分枝杆菌氟喹诺酮类药物耐药突变检测试剂盒(购自厦门致善生物科技股份有限公司)、微量肉汤稀释法药敏试剂盒及中性罗氏培养基(均购自珠海贝索生物技术有限公司)。
二、研究方法
1.菌株传代复苏:选取冻存的126株耐多药结核分枝杆菌临床分离株进行复苏传代,将冻存菌株放置室温液化后,用无菌吸管吸取2滴(0.1 ml)接种至中性罗氏培养基中,在36 ℃条件下培养4周,复苏成功率为100.0%(126/126)。
2.表型药敏试验:采用微量肉汤稀释法进行表型药敏试验,使用7H9液体培养基(7H9∶OADC营养添加剂=9∶1),药物浓度梯度设置为0.031、0.063、0.125、0.25、0.5、1、2、4、8、16、32 μg/ml。刮取中性罗氏培养基中生长良好的新鲜菌落进行磨菌和比浊,制备成1 mg/ml(1.0麦氏浊度)的菌悬液,通过100倍稀释后接种到不同药物浓度梯度的96孔药敏板孔内,每孔100 μl,于36 ℃孵育7 d后判读结果,肉眼观察无菌落生长孔对应的药物浓度为其最低抑菌浓度(minimal inhibitory concentration,MIC)。设2孔不加菌悬液的无药培养孔为阴性对照,2孔加入菌悬液的无药培养孔为阳性对照,若阴性对照孔无菌生长,阳性对照孔生长良好,则可判读结果。若阳性对照孔生长欠佳,则继续培养并每天观察,至14 d。每批试验以结核分枝杆菌标准株(H37Rv;ATCC27294)为敏感参考菌株进行质量控制。该方法已通过中国疾病预防控制中心国家结核病参比实验室药敏试验熟练度测试。Lfx耐药临界浓度为1.0 μg/ml,Mfx耐药临界浓度为0.25 μg/ml[4]。
3.熔解曲线法:通过单管单色体系,以gyrA为靶基因序列进行PCR扩增,根据靶序列熔点的变化检测gyrA基因88~94位密码子是否含有突变,获得FQs的耐药信息。按照试剂盒说明书进行DNA的提取、扩增和熔解曲线分析。DNA提取:用22SWG标准接种环刮取菌体1环,悬于250 μl TB-DNA 提取液中,以99 ℃加热20 min,14 000×g离心10 min,吸取上清即为DNA模板。PCR反应体系为25 μl,包括FQs PCR Mix 19.6 μl、TB酶混合液a 0.4 μl,DNA模板5 μl。PCR反应程序:尿嘧啶-N-糖基化酶处理50 ℃ 2 min;预变性95 ℃ 10 min;降落循环:95 ℃ 10 s,65 ℃ 20 s(每个循环下降1 ℃),78 ℃ 25 s;PCR循环:变性95 ℃ 10 s,退火55 ℃ 20 s,延伸78 ℃ 25 s,共40个循环。熔解分析程序:95 ℃ 2 min,40 ℃ 2 min,45~85 ℃熔解曲线分析,每1 ℃采集FAM通道荧光信号。结果判断:样品的熔点与阳性对照的熔点一致(误差不超过 1 ℃)时判定为野生型,对FQs敏感;样品的熔点低于阳性对照2 ℃及以上时(△Tm≥2 ℃)判定为突变型,对FQs耐药。
4.全基因组测序(WGS):对熔解曲线法和表型药敏试验检测结果不一致的菌株进行WGS。对菌液样本以85 ℃金属浴30 min灭活后送至安诺优达基因科技(北京)有限公司进行WGS。使用Illumina Hiseq 2500测序平台进行双端测序,基因组平均测序深度100×,10×覆盖度≥97.0%。利用结核分枝杆菌全基因组序列分析平台(SAM-TB;https://samtb.uni-medica.com/index)将测序数据与结核分枝杆菌标准株H37Rv全基因组序列(GenBank ID NC_00962.3)进行比较,获得全基因组单核苷酸变异(SNP)、插入和缺失(Indel)突变类型及突变频率,通过与耐药基因突变数据库比对获得菌株的耐药突变谱。
5.WGS数据质量控制:本研究所有测序数据均通过质量控制。SAM-TB“数据质控”页会自动给出含接头序列的reads比例、低质量reads比例等数据质量指标及是否通过质量控制,根据基因组平均深度和10×覆盖度判断数据质量是否满足耐药性和敏感性预测要求。
三、统计学处理
采用SPSS 19.0统计学软件进行统计分析。计数资料以“频数”和“百分率/构成比(%)”描述。以表型药敏试验结果为标准,计算熔解曲线法检测的敏感度、特异度、阳性预测值、阴性预测值及一致率。诊断试验可靠性评价采用Kappa一致性检验,Kappa值介于0~0.20为一致性较差,介于0.21~0.40为一致性一般,介于0.41~0.60为一致性中等,介于0.61~0.80为一致性良好,介于0.81~1.00为一致性非常好。
结 果
一、126株临床分离株的基本情况
126株临床分离株中,87株(69.0%)来自男性患者,39株(31.0%)来自女性患者;来自初治患者45例(35.7%),来自复治患者81例(64.3%);患者年龄21~70岁,平均年龄(44.5±22.0)岁。
二、FQs表型药敏试验结果
126株临床分离株的MIC分布如图1所示。H37Rv标准株对Lfx和Mfx的MIC分别为0.125 μg/ml 和0.031 μg/ml。在126株临床分离株中,对FQs敏感35株(27.8%),对FQs耐药(对Lfx和Mfx任一药物表型耐药均视为FQs耐药)91株(72.2%),其中对Lfx和Mfx均耐药82株(90.1%,82/91),仅耐Lfx 5株(5.5%,5/91),仅耐Mfx 4株(4.4%,4/91)。
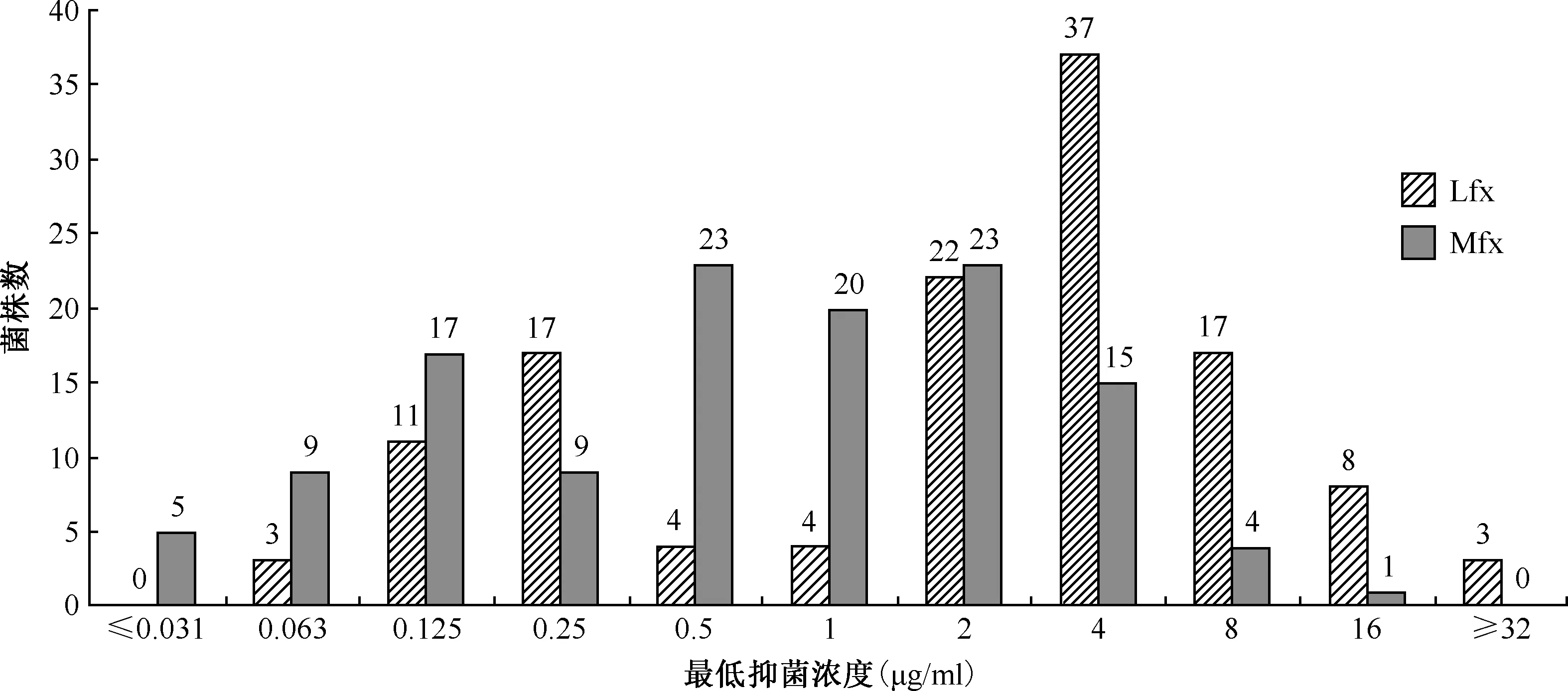
图1 126株耐多药结核分枝杆菌临床分离株Lfx和Mfx的最低抑菌浓度分布
三、熔解曲线法对FQs耐药的检测效能
熔解曲线法共检测到gyrA突变86株,FQs耐药检出率为68.3%(86/126),耐药突变率为94.5%(86/91)。以表型药敏试验结果为标准,熔解曲线法对FQs耐药检测的敏感度、特异度、阳性预测值、阴性预测值及一致率见表1。
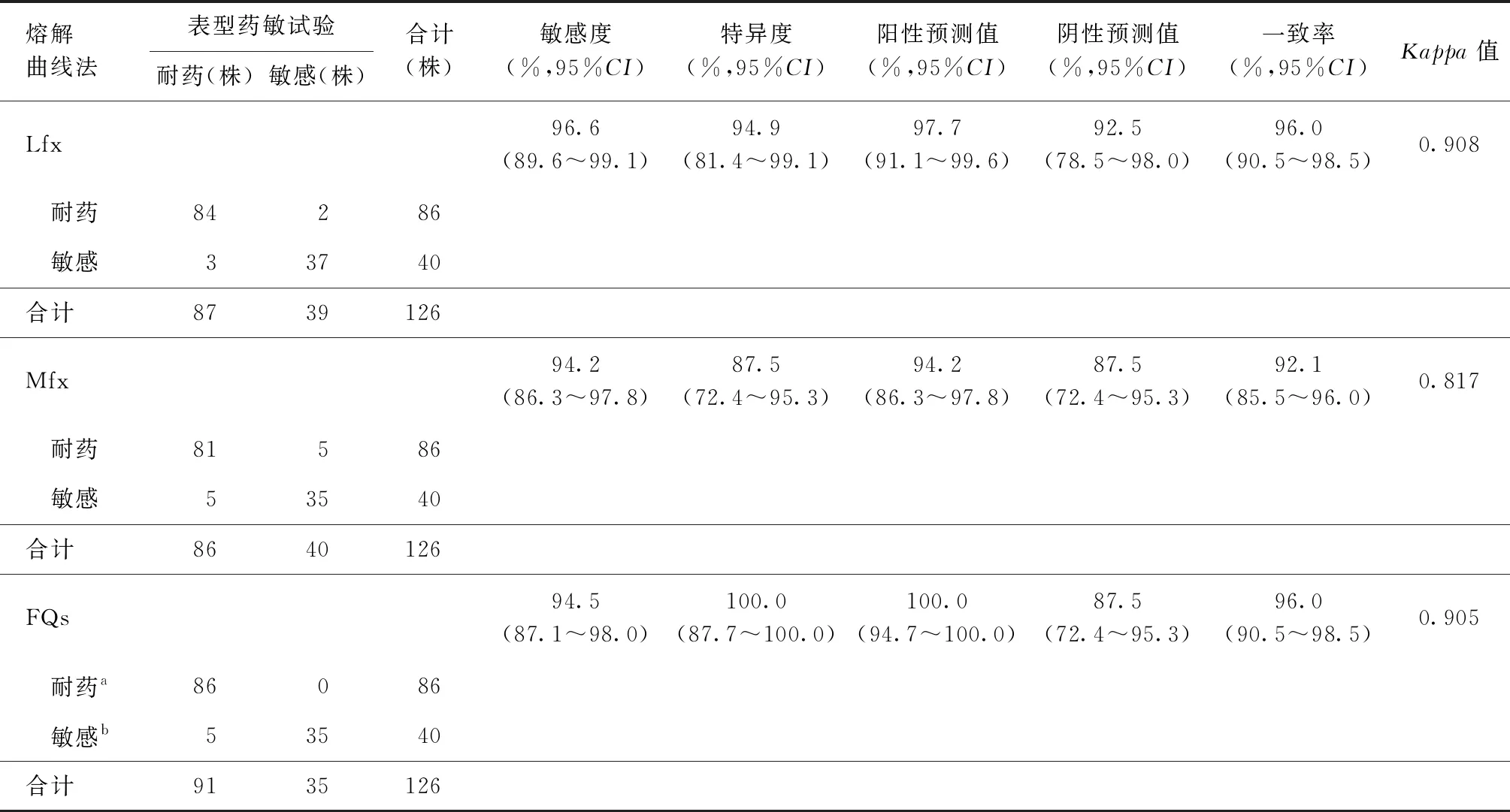
表1 熔解曲线法对氟喹诺酮类药物耐药性的检测效能
四、熔解曲线法与表型药敏试验结果不一致的情况
熔解曲线法与表型药敏试验结果不一致的有12株,不一致率为9.5%(12/126)。在Lfx和(或)Mfx表型药敏试验耐药而熔解曲线法敏感的5株菌中,2株WGS未见gyrA基因突变;2株WGS发现gyrB基因突变,在WHO耐药突变目录中,gyrB_Arg446Leu与FQs耐药的相关性不明确,gyrB_Asp461Asn与FQs耐药中等相关;1株WGS发现gyrA基因Asp94Ala发生突变,但突变频率仅为15.3%。
在Lfx和(或)Mfx表型药敏试验检测结果为敏感而熔解曲线法检测结果为耐药的7株菌中,经WGS发现,5株存在gyrA基因Ala90Val突变,1株存在gyrA基因Asp94Ala突变,1株存在gyrA基因Asp94Asn突变。具体见表2。
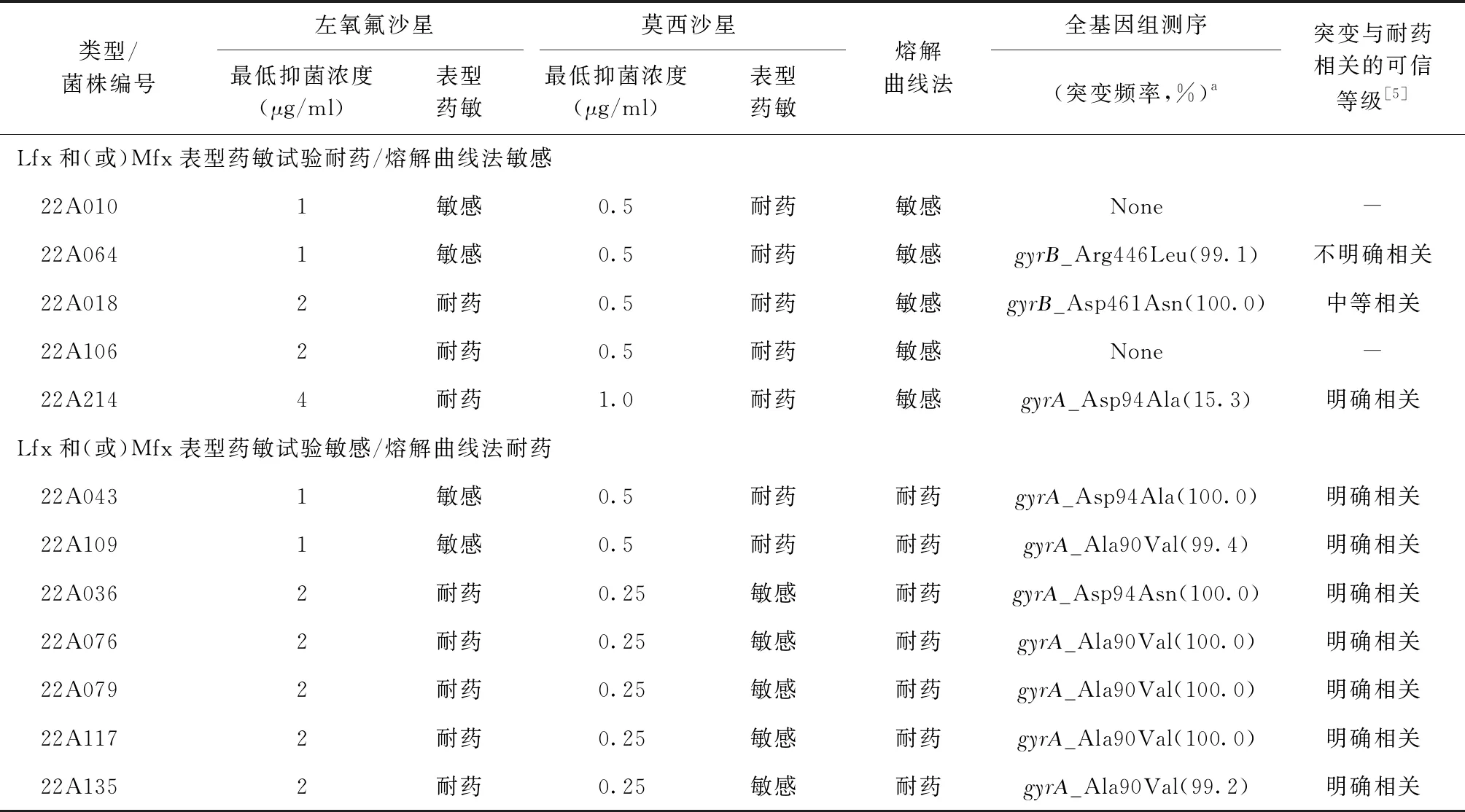
表2 氟喹诺酮类药物表型药敏试验和熔解曲线法检测结果不一致的情况
讨 论
根据《耐药肺结核全口服化学治疗方案中国专家共识(2021年版)》[3],我国MDR/RR-TB患者治疗方案分短程和长程治疗方案,如患者适合短程治疗方案,应优先选择含FQs的短程治疗方案。FQs也为长程治疗方案A组核心药物,在MDR/RR-TB的基础上对任意FQs耐药即为pre-XDR-TB,根据FQs耐药与否,长程方案用药又有所不同。对FQs耐药性的检测,传统表型药敏试验需要近2个月的时间,因此,采用分子药敏的方法检测FQs耐药性,对于早期快速诊断pre-XDR-TB并进行合理选药和尽早治疗非常关键。
本研究数据表明,熔解曲线法检测Lfx和Mfx的一致率分别为96.0%和92.1%,Kappa值分别为0.908和0.817,对Lfx的检测效能略优于Mfx。其检测总的FQs的敏感度和特异度分别为94.5%和100.0%,一致率达到96.0%,Kappa值为0.905,与表型药敏试验的一致性非常高,说明采用熔解曲线法可以早期识别由gyrA喹诺酮耐药决定区(quinolone resistance-determining region,QRDR)突变引起的耐药。在重庆地区流行的FQs耐药株(即pre-XDR-TB株)中,通过熔解曲线法检出的gyrA突变频率高达94.5%,略低于Sirgel等[6]报道的98%,高于西安的87.1%[7],明显高于北京的79.0%[8],这些研究结果的差异反映了不同地区FQs耐药株gyrA突变流行的多样性。此外,不同地区临床分离株耐药类型的不同可能是另一个合理的解释。在北京地区,研究材料仅1/4为MDR-TB临床分离株[8],而本研究均为MDR-TB临床分离株,由于MDR-TB患者通常比药物敏感者接受了更多的FQs暴露,更易积累与FQs耐药相关的基因突变[9]。
本研究结果显示,熔解曲线法与表型药敏试验结果不一致者共12株,文献报道其在对利福平和异烟肼的耐药性检测中也出现了类似的不一致情况[10-12],分子药敏试验并不能检出所有表型耐药菌株,且某些突变的基因位点不一定会引起表型特征改变[11,13],也可能与微孔板法自身缺陷有关,如耐药菌株在液体培养基中生长过缓导致试验结果判断产生假阴性等[10]。本研究两种检测方法结果不一致菌株经WGS分析,在Lfx和(或)Mfx表型药敏耐药而熔解曲线法敏感的5株菌中:2株WGS未见gyrA基因突变,可能存在除gyrA基因突变外的其他机制引起的耐药;2株WGS发现gyrB基因突变,在WHO突变目录里[5],gyrB_Arg446Leu突变与FQs耐药的相关性不明确,所以该Mfx低水平耐药突变株实际可能对Mfx敏感,gyrB_Asp461Asn突变与FQs耐药仅中等相关,其引起的低水平耐药也需更多临床数据支持,而熔解曲线法因未包含gyrB相关探针而显示为敏感;1株WGSgyrA基因发生Asp94Ala耐药突变,突变频率仅为15.3%,为异质性耐药,不同方法对异质性耐药的检出限差异是导致该株菌分子药敏与表型药敏不一致的重要原因。异质性耐药现象是指患者体内同时存在敏感菌和耐药菌,以及不同耐药谱菌群共存的现象,其产生机制可能包括多重感染及微进化等[14]。表型药敏试验可以检测出1%比例的耐药菌[15],深度测序也可以发现突变频率为1%的耐药突变[16],但由于成本和技术可及性方面的限制,WGS在资源有限地区难以推广应用,熔解曲线法可以检测约20%的耐药突变亚群[17],结合本研究,该方法检测FQs耐药性的敏感度高达94.5%,故其可作为FQs异质性耐药检测的替代方法。
在Lfx和(或)Mfx表型药敏试验检测敏感而熔解曲线法检测耐药的7株菌株中,经WGS发现,5株有gyrA基因Ala90Val突变,1株发现gyrA基因Asp94Ala突变,1株发现gyrA基因Asp94Asn突变,在WHO突变目录里,该3种gyrA基因突变与FQs耐药均明确相关[5],由于该7株菌株FQs的MIC值均处于临界浓度或略高,证明结核分枝杆菌低水平耐药者表型药敏试验有可能显示为敏感,导致表型药敏试验和分子药敏试验结果不一致。WHO报告也指出,FQsgyrA某些突变(如Ala90Val和Asp94Ala等)的MIC分布接近临界浓度,即低水平耐药gyrA突变株的MIC分布与野生型临床分离株之间存在一些重叠,可能导致假敏感的结果,具有此类突变的菌株表型药敏试验结果的可重复性差,与基因型药敏试验结果的一致性较低[4]。同时,结核分枝杆菌gyrA低水平耐药相关突变凸显了熔解曲线法等分子药敏试验方法在FQs耐药性诊断中的价值。
综上所述,熔解曲线法可以正确识别由gyrA基因QRDR区突变引起的FQs耐药,是一种有前途的FQs耐药结核病诊断方法。具有gyrA基因突变的FQs异质性耐药菌的比例及FQs低水平耐药相关突变是影响熔解曲线法检测效能及导致其与表型药敏试验结果不一致的主要原因。此外,本研究尚存在以下不足:一是研究对象为MDR-TB患者临床分离株,未包含非MDR-TB患者临床分离株,研究对象选择的偏倚可能对研究结论产生影响;二是本研究无MDR-TB患者临床治疗结果的数据,可能影响对处于耐药临界值附近临床分离株表型药敏试验与熔解曲线法检测结果不一致的解释;三是本研究两种检测方法不一致结果的数量较少,对研究结论的解释可能存在偏倚。
利益冲突所有作者均声明不存在利益冲突
作者贡献詹建:实施研究、数据采集、文章撰写;游国庆:实施研究、数据采集分析、经费支持;何霞:实验设计、文章修改、经费支持;孔珏颖:实施研究、统计分析;刘文果:样本收集、实施研究;冯鑫:实施研究、数据分析;胡彦:研究设计、实验指导、文章审阅
