巨噬细胞糖代谢重编程在结核分枝杆菌感染中的研究进展
2023-11-08南岳龙美贞董玉慧王元智周向梅
南岳 龙美贞 董玉慧 王元智 周向梅
【Fundprogram】 National Key Research and Development Plan Project for the 14th Five-Year Plan (2022YFD1800703)
巨噬细胞是构成先天性免疫的重要细胞,在维持机体稳态,组织完整及调节炎症等方面发挥作用[1-2]。巨噬细胞也是应对结核分枝杆菌(Mycobacteriumtuberculosis,MTB)感染的首要细胞,同时,MTB可利用巨噬细胞的异质性和可塑性实现长期存活及感染的扩散[3-4]。代谢途径和氧化还原反应是细胞活动的核心,免疫细胞不仅参与特定的代谢途径,而且还会调整其氧化还原反应促进代谢途径的重编程,改变其免疫功能[5]。糖代谢是免疫细胞重要的代谢途径,大量研究表明,巨噬细胞糖代谢与多种感染性疾病的发生发展密切相关[6],其中,MTB感染引起的巨噬细胞糖代谢重编程也是研究热点。因此,笔者对MTB感染引起巨噬细胞糖代谢重编程的相关研究进行总结,旨在为后续相关研究提供参考。
巨噬细胞糖代谢重编程
一、糖代谢重编程
糖代谢位于物质代谢的中心地位,包括合成代谢和分解代谢两大方面,为细胞的各种生命活动提供能源和碳源。细胞中葡萄糖有两条代谢途径:无氧分解(anaerobicoxidation)和有氧分解(aerobicoxidation)。无氧分解又称糖酵解(glycolysis),在无氧或缺氧条件下,由葡萄糖(glucose)降解为乳酸(lactate),并产生少量三磷酸腺苷(adenosine triphosphate,ATP)。而在有氧条件下,葡萄糖可彻底氧化分解,生成CO2和H2O,产生大量ATP。无氧分解和有氧分解都会历经由葡萄糖到丙酮酸(pyruvate)这一阶段,但在有氧分解途径,丙酮酸在丙酮酸脱氢酶复合体(pyruvate dehydrogenase complex,PDHC)的催化下,在线粒体中发生脱羧反应生成乙酰辅酶A(acetyl-CoA),后者进入三羧酸循环(tricarboxylic acid cycle,TCA cycle)发生氧化磷酸化(oxidative phosphorylation,OXPHOS),见图1。
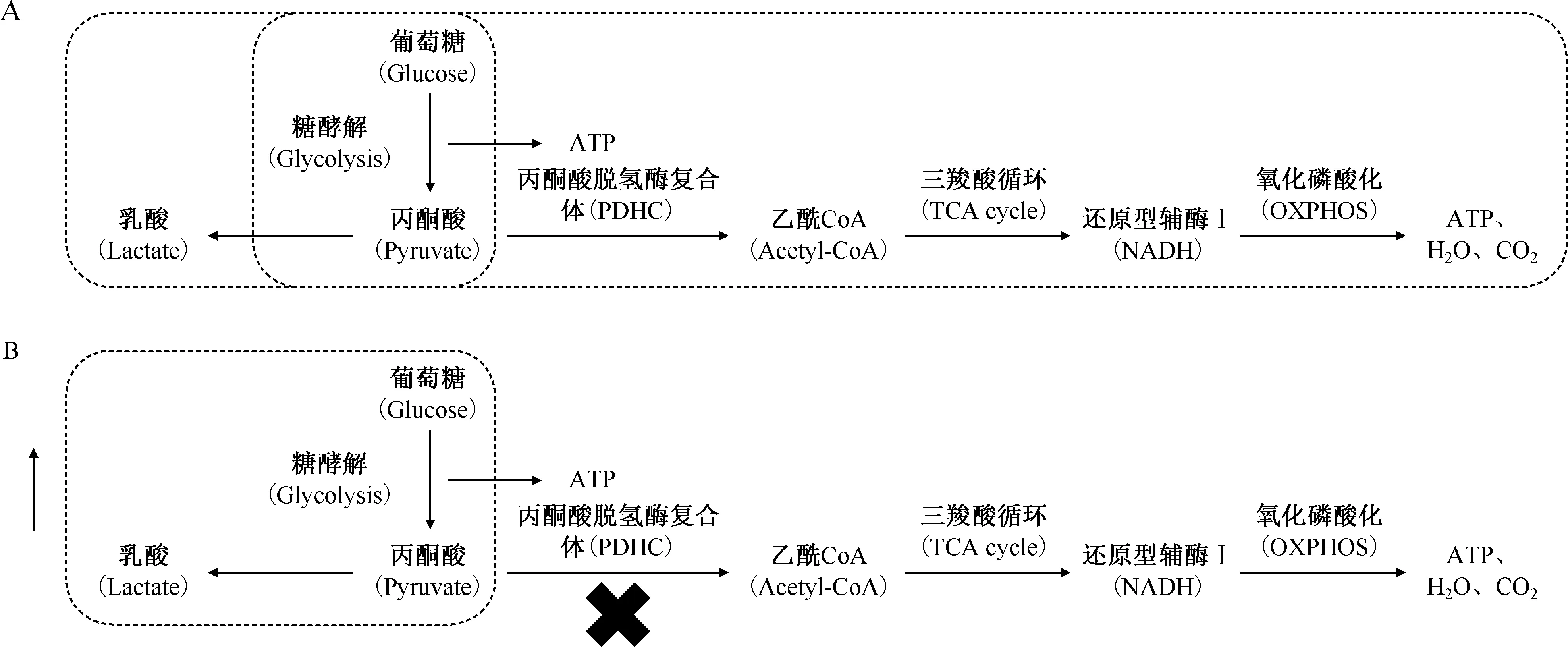
注 图A:葡萄糖在无氧环境下进行无氧分解(左侧方框),生成乳酸和少量三磷酸腺苷(ATP);在有氧环境下,进入三羧酸循环发生氧化磷酸化;图B:在肿瘤细胞或受刺激的巨噬细胞中,糖代谢重编程,糖酵解增强,氧化磷酸化减弱(左侧方框)
有学者发现,即使在氧气存在的条件下,肿瘤细胞也会发生糖代谢的重编程,通过糖酵解来产生能量,这一现象被称为Warburg效应或有氧糖酵解(aerobic glycolysis)[7-8]。随着对巨噬细胞研究的不断深入,大量结果表明糖代谢重编程在免疫防御和炎症反应中起着关键作用。
二、糖代谢重编程与巨噬细胞极化
巨噬细胞极化(macrophage polarization)是指巨噬细胞不同的活化状态,目前通常将其分为M1型和M2型两类。M1型巨噬细胞又称经典活化巨噬细胞(classically activated macrophages),具有促炎表型;M2型巨噬细胞又称替代活化巨噬细胞(alternatively activated macrophages),具有抗炎表型[9-10]。除活化方式不同外,两类巨噬细胞的糖代谢也有较大差异,越来越多的研究证明正是糖代谢决定了两类巨噬细胞功能的差异[11-12]。
在巨噬细胞受到内源性促炎因子如γ-干扰素和革兰阴性菌细胞壁外壁组成成分脂多糖的刺激后发生经典活化,转化为M1型巨噬细胞。M1型巨噬细胞可大量合成并分泌促炎因子,例如白细胞介素-1β(interleukin-1β,IL-1β)、IL-6、肿瘤坏死因子-α和诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)。在这一过程中,巨噬细胞糖代谢重编程,糖酵解通量增加,产生ATP和多种代谢中间产物以维持其强大的分泌和吞噬功能[11]。与糖酵解相关的酶则起到连接糖代谢重编程和巨噬细胞功能的桥梁作用。其中,较为重要的包括己糖激酶Ⅰ(Hexokinase Ⅰ)、果糖-2,6-二磷酸酶3(fructose-2,6-biphosphatase 3,PFKFB3)、甘油醛-3-磷酸脱氢酶、烯醇化酶、丙酮酸激酶(pyruvate kinase,PKM2)和丙酮酸脱氢酶(pyruvate dehydrogenase,PDH)。这些酶通过促进炎性小体的激活、肿瘤坏死因子转录后翻译、STAT3通路磷酸化及衣康酸生成等多种方式使得巨噬细胞发挥抗菌抗病毒功能[11,13-17]。伴随着糖酵解通量的增加,糖酵解产物葡萄糖-6-磷酸(glucose-6-phosphate) 累积,同时磷酸戊糖途径(pentose phosphate pathway,PPP)的限速酶葡萄糖-6-磷酸脱氢酶(glucose-6-phosphatedehydeogenase)活性增强,引起PPP增加[18-19]。PPP产生大量核糖-5-磷酸(ribulose-5-phosphate),分解后为细胞提供氨基酸、核糖,以及还原型辅酶Ⅱ(NADPH),用于蛋白质、核苷酸、活性氧(reactive oxygen species, ROS)的合成。
此外,值得关注的是,在M1型巨噬细胞中,TCA循环过程中存在2次中断,第1次中断出现在异柠檬酸盐(isocitrate) 转变为α-酮戊二酸(α-ketoglutarate),第2次出现在琥珀酸(succinate)转变为延胡索酸(又称富马酸,fumarate)[20-21]。TCA循环发生第1次中断后,代谢产物柠檬酸盐大量积累,随后进入糖代谢旁路生成衣康酸(itaconate),衣康酸可以通过抑制异柠檬酸裂解酶(isocitrate lyase,ICL)发挥抗菌作用[22]。在发生第2次中断后,琥珀酸呈现一定程度的累积。琥珀酸作为一种炎症信号可以通过多种方式驱动炎症,包括稳定缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α) 从而促进IL-1β的生成、自身氧化诱导线粒体ROS的产生、分泌至巨噬细胞胞外再经琥珀酸受体回收,反馈性的稳定HIF-1α[21,23]。总而言之,糖代谢的重编程是M1型巨噬细胞炎症启动和维持的核心事件。
与M1型巨噬细胞不同,M2型巨噬细胞具有抗炎、组织修复和组织重建等功能。一般认为M2型巨噬细胞经IL-4和IL-13激活,主要分泌IL-10、精氨酸酶-1(arginase-1)、CCL24、CCL22等抗炎因子[24]。在M2型巨噬细胞中,葡萄糖形成丙酮酸后进入完整的TCA循环,通过线粒体氧化磷酸化持续产生ATP,而有氧糖酵解基本不存在。
MTB感染期间巨噬细胞发生糖代谢重编程
一、MTB感染引起巨噬细胞糖代谢重编程
Rodríguez-Prados等[25]率先揭示了巨噬细胞代谢和免疫功能的联系,随后有关病原体感染期间巨噬细胞代谢与宿主防御机制的研究不断深入。MTB感染期间,在Toll样受体(Toll-like receptors,TLR)如TLR4刺激下,巨噬细胞发生糖代谢重编程并向M1型极化[26-27]。尽管TLR与糖代谢重编程间的具体机制尚未完全阐明,但Akt及mTORC1扮演着重要角色[28-29]。Shi等[30]也通过转录组学分析证明,在MTB感染早期,巨噬细胞代谢特征为有氧糖酵解增强,氧化磷酸化减弱,类似于肿瘤细胞中的Warburg效应。在这一过程中,多种蛋白和酶出现不同程度的上调,包括调控Warburg效应的关键蛋白HIF-1α,增加细胞糖酵解通量的必须酶磷酸果糖激酶2,与乳酸转运相关的单羧酸转运蛋白4(monocarboxylate transporter 4),以及参与Warburg效应的葡萄糖转运蛋白1和葡萄糖转运蛋白6(GLUT6)、己糖激酶Ⅰ和己糖激酶Ⅱ、肝型磷酸果糖激酶、PFKFB3[30-31]。与之相对应,与线粒体氧化磷酸化相关的酶如PDH、顺乌头酸酶(aconitase)、异柠檬酸脱氢酶2(isocitratedehydrogenase 2,IDH2)、琥珀酸脱氢酶(succinatedehydrogenase,SDH),以及参与ATP转运的相关酶则表达减少[32]。一些酶或代谢产物与巨噬细胞糖代谢重编程之间的关系已被阐述,具体的机制如下所述。
果糖-2,6-二磷酸(fructose-2,6-bisphosphate,F-2,6-BP)由果糖-6-磷酸(fructose-6-phosphate)经PFKFB3磷酸化形成,F-2,6-BP 作为一种关键的代谢调节分子在MTB感染过程中发挥重要作用。F-2,6-BP不仅是糖酵解过程中磷酸果糖激酶1的激活剂,还是糖异生途径F-1,6-BP磷酸酶的抑制剂[33]。在小鼠巨噬细胞感染MTB的早期阶段,PFKFB3表达量增加,促进了F-2,6-BP的生成,一方面推动糖酵解,另一方面抑制糖异生途径[30]。
丙酮酸脱氢酶复合体(PDH complex,PDC)是连接糖酵解和TAC循环的桥梁,PDC活性的调节主要依赖于丙酮酸脱氢酶激酶(pyruvate dehydrogenase kinase,PDK)和丙酮酸脱氢酶磷酸酶(pyruvate dehydrogenase phosphatase,PDP),前者使PDC发生磷酸化失活,后者使PDC去磷酸化激活[32]。在MTB感染的早期阶段,PDK表达量增加使PDC失活,而PDP则表达减少,抑制PDC通过去磷酸化激活。在这两种机制的共同调节下,糖酵解产物丙酮酸发生氧化磷酸化的过程受到抑制,从而引起糖酵解通量的增加。
衣康酸由TCA循环中间产物柠檬酸盐经免疫调节基因1(immune responsive gene 1,IRG1)催化产生。乙醛酸循环(glyoxylic acid cycle,GAC)是MTB在特定条件下维持生长的必需代谢途径[20],ICL是调控GAC的关键酶,衣康酸则可以抑制ICL的活性。转录组学显示,在MTB感染的小鼠巨噬细胞和肺组织中IRG1表达量高度上调[30,34]。同时,MTB感染的小鼠巨噬细胞中IDH2的表达量减少,使更多的柠檬酸盐转向衣康酸的合成[20]。这两种因素的共同作用可能有助于巨噬细胞在感染早期对MTB的控制。
SDH是催化琥珀酸转化为富马酸的关键酶。在MTB感染的巨噬细胞中,SDH表达量减少,有助于琥珀酸盐的累积[30]。一方面,琥珀酸盐通过抑制脯氨酰羟化酶结构域蛋白(prolyl hydroxylase domain protein)稳定HIF-1α[35];另一方面,引起TCA循环出现第二次中断,导致糖酵解通量的增加和促炎反应。HIF-1α已被证明在MTB感染的小鼠和斑马鱼模型中发挥重要的保护作用[36],HIF-1α不仅可上调多种糖酵解相关的酶,还可以与IL-1β基因序列的保守位点结合,诱导IL-1β及IL-1β前体的表达[37]。
综上所述,在MTB感染早期阶段,糖代谢重编程是M1型巨噬细胞产生抗菌和促炎细胞因子的先决条件,这也解释了为什么在MTB感染早期小鼠巨噬细胞细菌载量相对较低[38],且与M2型巨噬细胞极化相关的基因表达不变或减少[39]。
但随着感染进入后期,巨噬细胞的糖代谢发生转变,发生M2型极化。M2型巨噬细胞中,IL-4和IL-13抑制哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)的活化[40],抑制葡萄糖摄取及糖酵解,并导致HIF-1α水平降低[41],同时,恢复线粒体氧化磷酸化。这种糖代谢的转变标志着巨噬细胞由抵抗感染到适应感染的变化,与之相对,在感染后期,小鼠巨噬细胞中细菌载量开始上升[38]。但关于感染后期巨噬细胞糖代谢的研究相对较少,在该过程中具体哪些酶或蛋白发挥着关键作用仍需探索。
二、糖代谢重编程作为结核病治疗的潜在靶点
目前结核病的治疗仍以化学药物为主,但在治疗过程中存在个体差异、细菌耐药、药物耐受等问题,而宿主定向疗法(host directed therapy,HDT)有望解决这一困境。HDT是指通过调节宿主本身免疫细胞功能,以达到减轻或治疗结核病的目的。如上所述,糖代谢重编程决定着巨噬细胞的功能,并调控机体的免疫微环境。因此,使用或开发针对巨噬细胞糖代谢的HDT药物具有良好的前景。但值得注意的是,糖代谢重编程虽然是抵抗MTB感染的重要组成部分,但长期的慢性炎症会对宿主细胞和组织产生损害。当前HDT治疗结核病的焦点集中在抑制糖酵解。除此之外,mTOR和AMP活化蛋白激酶(AMP-activated protein kinase,AMPK)途径也是目前结核病潜在治疗靶点的研究重点。自噬是细胞抵抗MTB感染的潜在手段,mTOR激酶不仅对自噬具有负调节作用,还会稳定HIF-1α,增强炎症反应。一些研究显示,mTOR激酶抑制剂如雷帕霉素,可限制MTB感染的巨噬细胞中的乳酸水平[42]。笔者参照已有研究,对相关药物进行了总结[43],见表1。
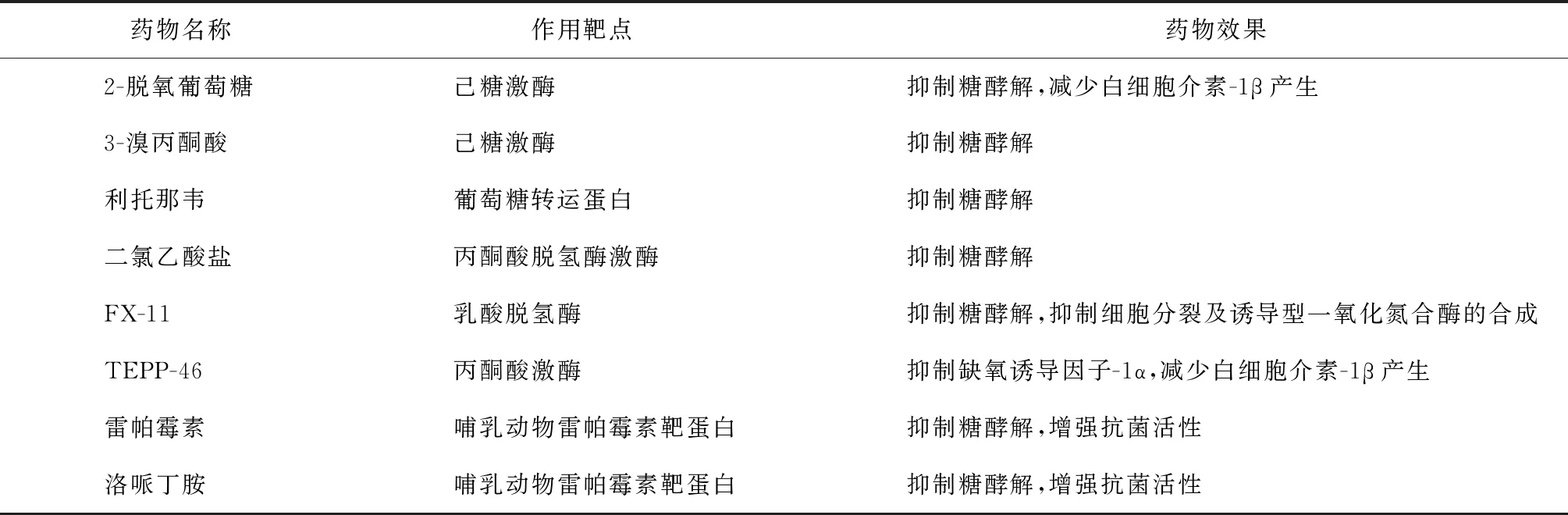
表1 目前针对结核分枝杆菌的宿主导向疗法的药物
由于分枝杆菌的感染是一个复杂的动态过程,也有一些研究表明上述的HDT药物并不利于对MTB的控制。例如,使用2-脱氧-D-葡萄糖治疗MTB感染的小鼠,炎性灶周围的高糖酵解亚群巨噬细胞显著减少,对小鼠疾病的转归带来不良影响[44]。这些结果相反的研究并不完全矛盾,因为在不同感染阶段巨噬细胞对糖代谢的需求不同。若在感染早期促进有氧糖酵解则有利于MTB的控制,而在感染后期抑制有氧糖酵解则有望减轻炎症反应,避免免疫损伤的发生,因此,上述的HDT药物的使用时机及用药周期仍需大量研究佐证[45-46]。
总结与展望
为了抵抗MTB的感染,巨噬细胞会发生M1型极化,以发挥促炎和抗菌作用。在这一过程中,巨噬细胞发生糖代谢重编程,HIF-1α介导的葡萄糖摄取及有氧酵解可迅速产生能量和代谢产物。需要注意的是,巨噬细胞糖代谢重编程并不是完全独立的生物学现象,而是复杂的代谢重编程中的一个环节。Jiang等[47]发现,在巨噬细胞M1型极化过程中,除葡萄糖代谢发生重编程外,氨基酸代谢也会发生变化,且具有重要的生物学意义。谷氨酰胺的分解代谢可以回补TCA循环,促进多种信号分子的合成,同时,谷氨酰胺也是合成天冬氨酸和衣康酸盐的生物学前体[47]。综上,巨噬细胞糖代谢重编程反映了宿主与MTB之间复杂的互作关系。深入了解这种相互作用对结核病的防治具有重要意义。MTB感染后巨噬细胞从线粒体氧化磷酸化到糖酵解的代谢重编程引起多种促炎细胞因子和抗菌效应分子的表达增多,因此,可以开发针对巨噬细胞糖代谢重编程的HDT药物,通过调节病变部位炎症,增强对MTB的杀灭或减轻疾病后期的病理性炎症。另一方面,一些研究表明MTB可以通过调节巨噬细胞代谢的进程,降低巨噬细胞ATP的生成速率以达到免疫逃逸及胞内存活的目的[48]。但当前这种菌体与宿主的代谢互作研究相对较少,具体的机制还需进一步探索,这也可能为结核病的治疗提供新策略。
利益冲突所有作者均声明不存在利益冲突
作者贡献南岳:采集数据、分析/解释数据、起草文章;龙美贞、董玉慧和王元智:实施研究、采集数据;周向梅:对文章的知识性内容作批评性审阅、获取研究经费、材料支持、技术指导
