基于生物信息学分析铁死亡调控基因与牙周炎的关系
2023-11-07罗晓洁王德续陈晓涛
罗晓洁 王德续 陈晓涛
1.新疆医科大学口腔医学系 乌鲁木齐 830000;
2.新疆维吾尔自治区人民医院口腔科 乌鲁木齐 830000
牙周组织发生的感染性疾病称为牙周炎(periodontitis),是全球第六大常见疾病[1],也是一种多因素炎性疾病,牙周组织的破坏为其主要特征,包括软组织炎症(牙龈炎症)和硬组织的破坏(牙槽骨吸收),最终会造成牙齿的丧失[2]。异常免疫炎症反应、结缔组织破坏以及成骨细胞/破骨细胞分化失衡是促进牙周炎持续发展的主要因素,通过了解这些发病机制,展开抗炎治疗是必要的。铁死亡(ferroptosis)是一种新型的细胞程序性死亡,与细胞坏死、凋亡和自噬的机制有所不同。细胞铁死亡的发生与谷胱甘肽(glutathione,GSH)和铁代谢异常导致有毒脂质型活性氧(reactive oxygen species,ROS)的铁依赖性积累有关[3]。目前,已证明铁死亡与炎症的发生有密切的关系[4],但关于牙周炎与铁死亡的研究目前较少,两者之间作用机制尚未明确。
生物信息学(bioinformatics)通过获取相关生物信息,进行加工、存储、分析和解释,阐明生物学意义。在分子水平探索铁死亡与牙周炎微环境的关系,对改善牙周炎患者炎症甚至牙槽骨骨改建可能具有重要意义。本研究经生物信息分析发现铁死亡调控基因在牙周炎中存在差异表达,如铁死亡抑制基因SLC7A11、SLC40A1、FTH等在牙周炎中表达上调,在牙周炎患者牙龈中的表达量高于健康人群,推测可能是由于牙周炎微环境下,炎症细胞铁死亡被明显抑制,炎症因子分泌增加,加重了炎症反应。本研究借助基因表达数据库(Gene Expression Omnibus,GEO)和R语言探讨了铁死亡调控基因对牙周炎的影响,为研究铁死亡与牙周炎之间的关系及可能的机制提供理论基础,以期为牙周炎治疗策略的发展贡献一份力量。
1 材料和方法
1.1 数据收集
从GEO 数据库中下载GSE16134[5]数据集(GPL570,Affymetrix Human Genome U133 Plus 2.0 Array)。
纳入标准:有探诊后出血(bleeding on probing,BOP),邻间探诊深度(probing depth,PD)≥4 mm,伴随附着丧失(attachment loss,AL)≥3 mm为牙周炎位点,没有BOP,PD<4 mm,AL≤2 mm为健康位点;年龄>13岁,且口内留存牙齿超过24颗,至少包含1个符合标准的患病牙间乳头。该数据集纳入了120名中度至重度牙周炎受试者。每名患者的6个区段中至少采集2颗患牙周炎部位的牙龈乳头数据(包括邻间牙周袋的上皮衬里和下面的结缔组织),并从相邻健康位点获取健康的组织样本。
本试验共包括310个样本,其中69个健康样本和241个牙周炎样本,51名患者没有取得健康样本。从FerrDb数据库中获取铁死亡驱动基因和抑制基因。
1.2 筛选差异基因
通过R软件(版本4.1.1)进行数据分析,在GSE16134中筛选出铁死亡驱动基因和抑制基因,共157个铁死亡调控基因。将结果进行标准化处理,以P<0.05,│logFC│>0.2作为差异基因筛选标准,用“limma”包[6]筛选出铁死亡调控基因在牙周炎样本存在差异表达的基因,通过R语言中的“pheatmap”包和“Volcano”包[7]将差异分析结果可视化。
1.3 枢纽基因的功能富集和通路分析
为了找出差异基因主要的功能和其所在通路,使用“clusterprofile”包进行基因本体(gene ontology,GO)功能富集分析以及京都基因和基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析,以P<0.05差异有统计学意义。
1.4 构建蛋白质相互作用网络(protein-protein interaction network,PPⅠ)
使用STRⅠNG 和Cytoscape (http://cytoscape.org/)完成PPⅠ网络的构建,并通过MCODE进行聚类分析,将相互关联评分最高的一组确定为关键基因。
2 结果
2.1 差异基因的筛选
矫正并标准化GSE16134数据集,共筛选出与铁死亡相关的调控基因50个,其中包括24个炎症中表达上调的基因和26个表达下调的基因。为了使筛选出的调控基因分布情况可视化,绘制了热图(图1A)和火山图(图1B)展示铁死亡调控基因在炎症样本和健康样本中的差异表达。

图1 铁死亡调控基因在炎症样本和健康样本中的差异表达Fig 1 Differential expression of iron death regulatory genes in inflammatory and healthy samples
2.2 差异表达基因功能分析和通路分析
基于GO对差异表达基因进行功能分析,将本研究筛选得到的50个差异表达基因分别从生物过程(biological process,BP)、分子功能(molecular function,MF)和细胞成分(cell component,CC)3个层面进行功能注释,经显著性富集(P<0.05)分析后,将每个层面前10个显著富集的条目列出(图2),从图中可以看出:差异基因主要涉及氧化应激这一生物过程,氧化应激增加以及抗氧化能力的下降与牙周组织的炎症反应息息相关。这可以证明这些差异基因,如花生四烯酸-5-脂加氧酶(recombinant arachidonate-5-lipoxygenase,ALOX5)、溶质载体家族7成员11(recombinant solute carrier family 7, member 11,SLC7A11)、Toll样受体4(Toll-likereceptor 4,TLR4)、人红细胞衍生核因子2样蛋白2(recombinant nuclear factor, erythroid derived 2 like protein 2,NFE2L2)等,与牙周炎的发生有关(表1)。

表1 差异表达基因结果Tab 1 Results of differentially expressed genes
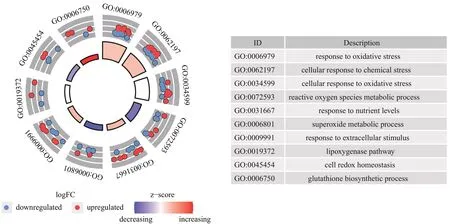
图2 差异表达基因GO分析结果Fig 2 GO analysis results of differentially expressed genes
对牙周炎中存在差异表达的铁死亡调控基因进行KEGG通路分析,显著富集的前20个通路如图3所示。由图3可知:差异基因主要涉及铁死亡、免疫应答和自噬等过程(表2),铁死亡通路上主要包括重肽铁蛋白(ferritin heavy chain,FTH1)、SLC7A11、酰基辅酶A (acyl-CoA synthetase 4,ACSL4)、溶质载体家族40 成员1 (recombinant solute carrier family 40, member 1,SLC40A1)等。通过KEGG官网得到差异基因在铁死亡中的通路图,明确差异基因在铁死亡通路上的作用。

表2 差异表达基因通路分析结果Tab 2 Pathway analysis results of differentially expressed genes
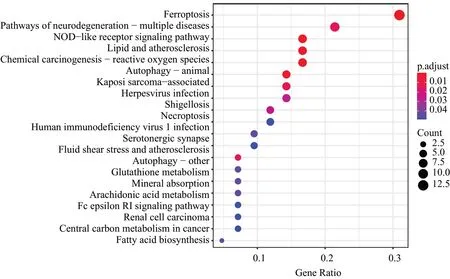
图3 差异表达基因KEGG通路分析结果Fig 3 KEGG pathway analysis results of differentially expressed genes
2.3 构建PPⅠ网络以及确定关键基因
利用STRⅠNG 和Cytoscape (http://cytoscape.org/) 构建PPⅠ网络(图4),通过Cytoscape 的MCODE插件进行聚类分析,共筛出3个模块,选取相关性得分最高的模块作为关键基因(图5、6)。这些关键基因主要参与氧化应激、自噬和铁代谢反应,例如,半胱氨酸连接酶催化亚基(glutamate-cysteine ligase catalytic,GCLC)、SLC7A11与GSH的合成有关,70 kDa热休克蛋白5(recombinant heat shock 70 kDa protein 5,HSPA5)与谷胱甘肽过氧化物酶4 (glutathione peroxidases 4,GPX4)结合,能防止GPX4蛋白降解和随后的脂质过氧化;自噬启动蛋白(autophagy-related protein 1 homolog,ULK1)作为被发现的自噬相关的基因,在自噬通路中起着关键作用;FTH1参与了铁蛋白(transferrin,TF)的合成。
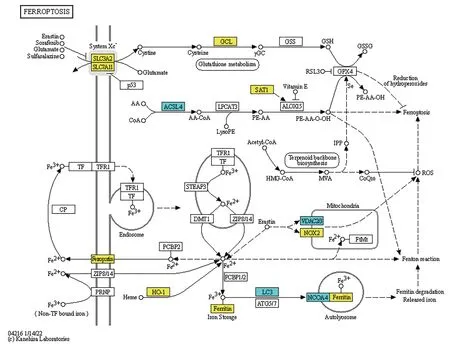
图4 KEGG铁死亡通路中部分差异基因的主要作用Fig 4 Main roles of some differential genes in KEGG iron death pathway
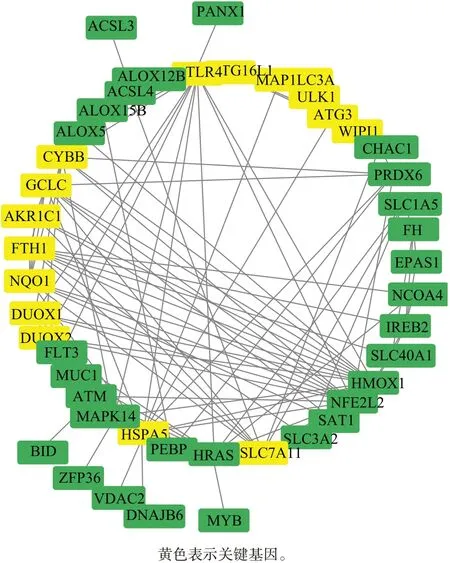
图5 Cytoscape构建差异表达基因的PPⅠ网络Fig 5 PPⅠ network of differentially expressed genes constructed by Cytoscape

图6 通过Cytoscape中的ECODE插件获取到的15个关键基因Fig 6 15 key genes obtained through the ECODE plugin in Cytoscape
3 讨论
牙周炎是以牙周软组织慢性炎症、牙周膜丧失和牙槽骨吸收为特征的最常见的口腔疾病之一[2]。牙菌斑在牙周炎的发展中起致病作用,其他因素在牙周炎患者患病后的发展中起着同等甚至更重要的作用[8]。自由基清除的动态平衡失调会造成牙周组织损伤[9],牙周炎患者的龈沟液中氧化应激标志物水平与PD、BOP以及AL呈正相关,牙周治疗后机体氧化应激水平得到改善[10]。铁死亡作为目前国内外的研究热点,其发生与氧化应激有着密切的关系,在炎性疾病发展过程中的作用正在逐步被揭示[4]。因此,笔者推测铁死亡可能通过氧化应激反应参与了牙周炎发生发展的过程。
细胞铁死亡的发生主要与GSH以及铁代谢密切相关的ROS积累有关[11]。据功能分析结果显示:参与氧化应激反应是差异基因的主要作用,与牙周炎进展是由氧化应激促进相符的。据KEGG通路图显示:差异基因主要在铁死亡通路中的Xc-系统(system Xc-)通路和铁代谢通路上发挥作用。本研究重点关注了在铁死亡通路上的基因兼PPⅠ图中的关键基因,包括:FTH1、SLC7A11、细胞色素b-245 β 链 (cytochrome b-245 beta chain,CYBB)、GCLC、微管相关蛋白1A/1B 轻链3A(microtubule-associated proteins 1A/1B light chain 3A, MAP1LC3A)。 分析结果显示: FTH1、SLC7A11、GCLC、CYBB在牙周炎牙龈组织中表达上调,MAP1LC3A在牙周炎组织中表达下调。
SLC7A11由SLC7A11 mRNA编码,通过组成Xc-系统,介导胞外胱氨酸与胞内谷氨酸的交换,消耗还原型烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH),经GCLC编码合成谷氨酰半胱氨酸连接酶(glutamate cysteine ligase,GCL),促进GPX4的主要底物GSH生成[12-13]。GPX4能降低细胞内ROS的水平,抑制细胞发生铁死亡[14]。CYBB是促炎基因,其编码的GP91PHOX能与P22PHOX组成NADPH,负责产生超氧化物和ROS[15-16]。笔者分析:牙周炎组织中,SLC7A11、GCLC在炎症牙龈组织中表达上调,可能是由于炎症细胞铁死亡被抑制,增加了炎症因子的分泌,从而加重了炎症反应。炎症细胞CYBB基因表达上调,这与其促炎功能相符。
铁是人体必需的营养元素,作为催化剂参与氧化还原反应[17]。细胞内铁稳态的维持主要依靠TF/转铁蛋白受体(transferrin receptor,TFR)系统摄取细胞外铁,以及膜铁转运蛋白(ferroportin,FPN)介导的铁的输出[18-19]。FTH1参与TF合成,TF降解产生大量ROS导致细胞铁死亡[20]。临床研究[21]发现:TF/核受体共激活因子4(nuclear receptor coactivator 4,NCOA4)复合体介导的TF降解,促进了人牙周膜成纤维细胞中ROS的生成,导致人牙周膜成纤维细胞铁死亡,揭示了铁死亡在牙周炎的发病机制中发挥了重要的作用。MAP1LC3A作为自噬体标志物和自噬通量的衡量指标,可能涉及选择性自噬降解TF,即TF吞噬,并将铁释放到细胞中以激活铁死亡[22]。据本实验的分析结果显示:牙周炎组FTH表达量上调,NCOA4的表达下调。牙周炎属于低氧性炎性疾病,Ni等[23]的研究发现:缺氧抑制了NCOA4介导的TF吞噬,使破骨细胞免于铁死亡。因此,缺氧条件下FTH的表达会增加,FTH的降解受到抑制。这与本实验的分析结果一致。由此大胆推测:牙周炎低氧环境下破骨细胞铁死亡被抑制,进而促进了牙槽骨的吸收。而MAP1LC3在牙周炎中的作用目前未见相关报道,可能通过与其他基因共同作用,参与了牙周炎的发生发展。
牙槽骨对于牙周炎患者的预后以及患牙的保留至关重要。由此作为启发,笔者关注了上述基因对牙槽骨的影响。Jin等[24]的研究显示:下调SLC7A11在体外能显著增强间充质干细胞(mesenchymal stem cell,MSC)的成骨分化能力,促进体内骨的形成;并且,SLC7A11的抑制剂Sulfasalazine(SAS)能有效地提高成骨潜能。笔者还发现GSH在破骨细胞炎性骨破坏机制中起着重要作用。GSH一直被认为是一种破骨细胞生成抑制剂,通过降低细胞内ROS的生成,抑制核因子κB(nuclear factor kappa-B,NF-κB)的激活,进而抑制介导破骨细胞分化的RANKL-RANK信号通路[25]。但有研究[26]发现:在小鼠骨髓巨噬细胞(bone marrow-derived macrophage,BMM)分化为破骨细胞过程中,GSH能促进破骨细胞形成。被注射脂多糖的小鼠颅骨经GSH处理后,溶骨性病变面积增加了5倍,GSH加速了破骨细胞形成和炎症性骨破坏,是破骨细胞炎症性骨破坏机制中的重要分子[27]。牙周炎主要是通过刺激静止的破骨细胞前体分化为破骨细胞,加重骨吸收[28]。而Agidigbi等[29]的实验显示:GSH在炎症条件下,有助于破骨细胞前体(RAW264.70)向破骨细胞分化和骨破坏。骨骼对全身铁水平的波动特别敏感,缺铁和超负荷都与低骨矿物质密度和脆弱性有关,而牙槽骨作为全身骨改建最活跃的部位,铁代谢异常可能会影响牙槽骨的改建[30]。以上研究表明:SLC7A11、GSH和铁代谢异常对调节炎症和牙槽骨的破坏可能存在着潜在作用,需后期经实验进一步验证。
总之,铁死亡与炎症的发生发展密切相关,在牙周炎发病过程中,铁死亡的作用正在逐渐被揭示。基于生物信息学方法分析铁死亡调控基因在牙周炎软组织样本和健康软组织样本中表达的差异,对关键差异基因进行分析,寻找铁死亡调控基因与牙周炎之间的关联以及主要作用的通路。本研究仅基于数据分析,后续仍需结合分子生物学实验来确认铁死亡调控基因中与牙周炎相关的关键基因及其在牙周炎发生发展中的具体作用。本研究旨在丰富牙周炎致病作用机制,为治疗和早期干预牙周炎提供新的思路。
利益冲突声明:作者声明本文无利益冲突。
