口腔扁平苔藓患者血清血管生成素-2水平与叉头翼状螺旋转录因子阳性调节性T细胞及疾病活动度的相关性分析
2023-11-07王素杰谭芹韦渊王洁范杰岳二丽
王素杰 谭芹 韦渊 王洁 范杰 岳二丽
郑州市第一人民医院口腔科 郑州 450000
口腔扁平苔藓(oral lichen planus,OLP)是一种发病率仅次于复发性阿弗他溃疡的口腔疾病,患病率为0.1%~4%,多发生于中年女性[1]。目前,临床上关于OLP确切的发病机制尚不明确,但多数学者认为其发病机制与免疫反应、高遗传易感性及血管生成等因素相关[2-4]。CD4+CD25+调节性T细胞(regulatory T cells,Treg)主要参与机体的免疫反应,抑制效应性细胞的增殖;叉头翼状螺旋转录因子(forkhead/winged helix transcription factor p3,Foxp3)是参与Treg发育及功能的特异性标志物[5]。白杨等[6]研究显示Foxp3+Treg的表达异常与OLP的发生及临床分型密切相关。近年来相关研究[7]显示:异常激活的血管生成素(angiopoietin,Ang)信号传导失调在OLP的发生发展中发挥了重要作用。血清Ang-2可通过拮抗内皮细胞特异性酪氨酸激酶受体(tyrosine kinase receptor 2,Tie2)受体与Ang-1的相互作用来调节血管生成的转变,可能参与OLP的病情进展[8]。笔者在前期研究中发现:OLP患者外周血Ang-2的检测水平明显高于正常人。为了更全面地探索血清Ang-2在OLP中的变化,寻找血清Ang-2水平与临床体征及疾病活动性的相关性,本研究以OLP患者为研究对象,分析血清Ang-2水平与Foxp3+Treg及疾病活动性的相关性。
1 材料和方法
1.1 一般资料
选取郑州市第一人民医院2019年5月—2022年5月收治的113例不同分型OLP患者为研究对象,设为试验组。113例患者根据OLP分型分为网纹型组(45例),充血型组(36例),糜烂型组(32例);其中男36例,女77例;年龄35~75岁,平均(47.51±3.92)岁;病程0.51~2.14年,平均(0.78±0.27)年。另选取来郑州市第一人民医院体检的健康志愿者76例为对照组,其中男26例,女50例;年龄32~73岁,平均(47.38±3.81)岁。两组性别、年龄等的差异无统计学意义(P>0.05)。纳入标准:1)观察组均符合OLP的诊断标准及分型标准[9],经病理及临床症状检查确诊;2)年龄≥18岁;3)能配合完成本研究;4)知情同意。排除标准:1)合并免疫性疾病或糖尿病者;2)合并心脑血管疾病或感染性疾病;3)合并恶性肿瘤;4)合并有牙周炎或复发性阿弗他溃疡;5)由药物、金属等引起的苔藓样反应;6)近期服用抗炎、免疫抑制剂等药物者。本研究经郑州市第一人民医院伦理委员会批准(编号:2023-zzsyky-005)。
1.2 方法
1.2.1样本采集 收集所有受试者肘静脉血4 mL,分装两管,一管用于检测血清Ang-2水平,另一管(含肝素钠抗凝)用于检测Foxp3+Treg水平。
1.2.2血清Ang-2、Foxp3+Treg 水平检测 血清Ang-2水平检测采用酶联免疫吸附法检测,具体操作:将获取的血液样本置于离心机中,离心,获取血清,将血清置于全自动生化分析仪(济南程腾生物技术有限公司,型号:BK-200)中进行检测。Foxp3+Treg水平的检测采用流式细胞仪(青岛佳鼎分析仪器有限公司,型号:DxP Athena)检测,从获得的全血样本中取100 μL,CD4-FTTC、抗人CD25-APC均加入20 μL,混匀,孵育30 min,加入红细胞裂解液,混匀,孵育10 min,置于离心机中,离心,留取沉淀物;加入磷酸缓冲盐溶液(phosphate buffered saline,PBS)2 mL,离心5 min,留沉淀物;重复上一步骤,加入事先配制好的固定/破膜工作液,孵育40 min(避光),加入FBS 2 mL,离心5 min,留沉淀物;重复上一步骤,加入Foxp3-PE,孵育40 min(避光),加入FBS 2 mL,离心5 min,留沉淀物;重复上一步骤;加入FBS重悬细胞,上机检测。
1.2.3 临床体征评分、OLP 网纹-萎缩-糜烂(reticular-atrophic-erosive,RAE)病损评分、疾病活动评分 评估临床体征评分[10]采用六级评分法:0 分为无病损,正常黏膜;1分为轻微白色条纹,无充血、萎缩或糜烂面;2分为白色条纹伴充血或萎缩面<1 cm2;3分为白色条纹伴充血或萎缩面≥1 cm2;4 分为白色条纹伴糜烂面<1 cm2;5 分为白色条纹伴糜烂面≥1 cm2。采用RAE 病损评分[11]评估病损程度。糜烂型评分:0 分为无糜烂病损,1 分为糜烂面<1 cm2,2分为糜烂面1~3 cm2,3分为糜烂面>3 cm2;充血萎缩型评分:0分为无病损,1分为充血萎缩面<1 cm2,2 分为充血萎缩面1~3 cm2,3 分为充血萎缩面>3 cm2;网纹型评分:0 分为无白色条纹,1 分为有条纹或丘疹。总分为病损分布在舌、颊、牙龈、口底、唇等位置之和。采用OLP网纹-糜烂-溃疡(reticulum-erosion-ulcer,REU)疾病活动评分[12]评估患者的疾病活动程度,根据患者口腔各部位的白纹区、充血红斑区、糜烂溃疡区的严重程度进行评价。白纹区评分:0分为无白色条纹,1分为有白色条纹或角化丘疹;充血红斑区评分:0 分为无病损,1 分为病损面积<1 cm2,2 分为病损面积1~3 cm2,3 分为病损面积>3 cm2;糜烂溃疡区评分:0分为无病损,1分为病损面积<1 cm2,2 分为病损面积1~3 cm2,3 分为病损面积>3 cm2。总分=∑白纹区+∑(充血红斑区×1.5)+∑(糜烂溃疡区×2.0)。
1.3 观察指标
比较不同分型OLP患者与对照组患者血清Ang-2、Foxp3+Treg水平,对比不同分型OLP患者临床体征评分、RAE病损评分、疾病活动评分,血清Ang-2水平与Foxp3+Treg及各评分的相关性。
1.4 统计学方法
应用SPSS 26.0统计软件处理数据,计数资料比较采用χ2检验,两组间计量资料比较采用t检验,多组间计量资料比较采用方差分析;采用Pearson相关性分析明确血清Ang-2水平与Foxp3+Treg及各评分的相关性,检验水准为α=0.05。
2 结果
2.1 血清Ang-2、Foxp3+Treg水平比较
不同分型OLP患者血清Ang-2、Foxp3+Treg水平均高于对照组(P<0.05);糜烂型组和充血型组患者血清Ang-2、Foxp3+Treg水平均高于网纹型组(P<0.05);糜烂型组患者血清Ang-2、Foxp3+Treg水平均高于充血型组(P<0.05),结果见表1。
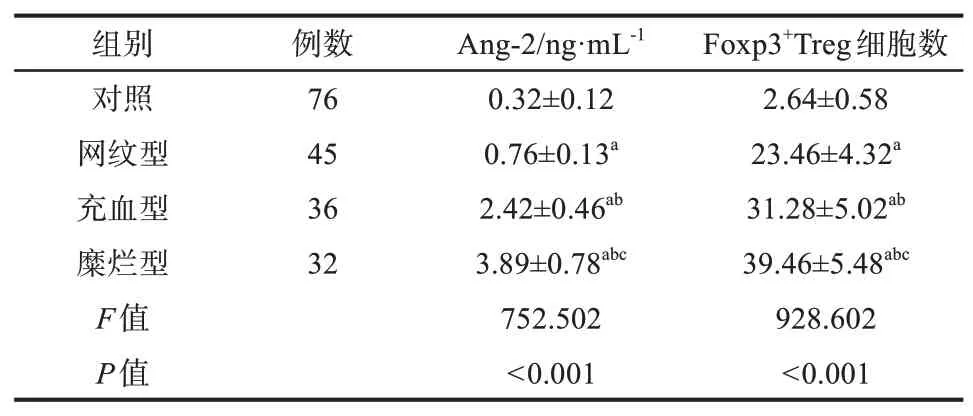
表1 血清Ang-2、Foxp3+Treg水平比较Tab 1 Comparison of serum Ang-2 and Foxp3+Treg levels
2.2 各评分水平比较
糜烂型组和充血型组患者临床体征评分、RAE病损评分、疾病活动评分均高于网纹型组(P<0.05),与充血型组患者相比,糜烂型组患者上述指标水平更高(P<0.05),结果见表2。
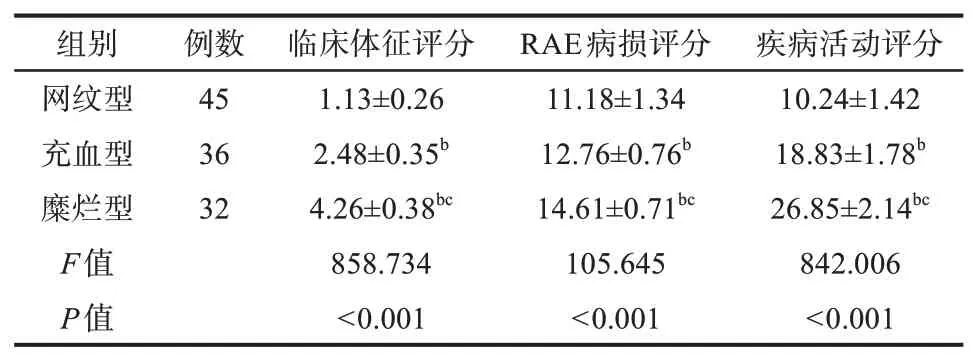
表2 各评分水平比较Tab 2 Comparison of each score level
2.3 血清Ang-2 水平与Foxp3+Treg、临床体征评
分、病损RAE评分、疾病活动评分的相关性OLP患者血清Ang-2水平与Foxp3+Treg、临床体征评分、病损RAE评分、疾病活动评分均呈正相关(P<0.001),结果见表3。
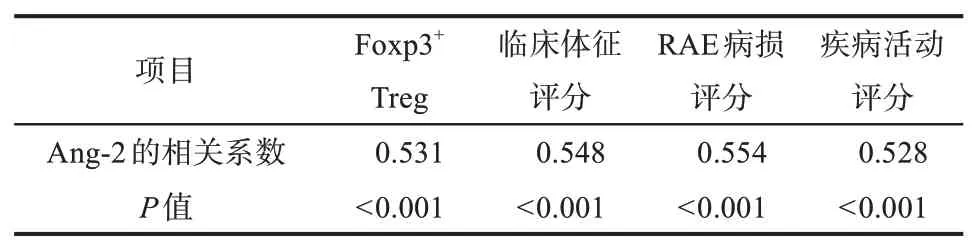
表3 血清Ang-2 水平与Foxp3+Treg、临床体征评分、RAE病损评分、疾病活动评分的相关性Tab 3 Correlation between serum Ang-2 level and Foxp3+ Treg, clinical sign score, RAE score and disease activity score
3 讨论
OLP是发生于口腔黏膜的慢性炎症疾病,表现为刺激痛,粗糙不适,由小丘疹连成的树枝状、网状、线状白色条纹,溃疡、充血及糜烂等症状,具有反复发作、迁延难愈等特点[13]。相关研究[14]显示:OLP的糜烂病损区域若经久不愈,不仅影响患者的口腔功能,还可导致局部纤维增生,甚至可能引起恶性病变,严重影响患者的日常生活和工作。目前,多数学者[15]认为免疫介导的炎症反应是OLP发生的主要病理机制,亦有学者[16]认为血管生成的调控失调是影响OLP发生发展的潜在标志。病理状态下炎症可诱导病损区域局部血管的生成,而不断新生的毛细血管可促进炎症细胞迁移,产生恶性循环,不利于炎症部位恢复[17]。这表明OLP炎症反应过程中伴随着血管的异常增生,但近年来临床上关于OLP血管生成的调控及其与炎症反应的相关性研究还较少。
Ang-2作为Ang家族中的一员,主要表达于血管内皮细胞,储存在Weibel-Palade小体,当机体受到炎症刺激时可被大量释放,与细胞膜上酪氨酸激酶受体Tie2结合,发挥生物学效应[18]。此外,Ang-2可诱导血管渗漏并可增加内皮细胞对分子信号传导的敏感性,且对骨髓细胞具有旁分泌作用,导致单核细胞迁移以及中性粒细胞和巨噬细胞的上/下细胞因子调节[19]。Wu等[20]研究显示:Ang-2表达异常在炎症性自身免疫性疾病中发挥着至关重要的作用。Bessar等[8]认为:Ang-2参与OLP的发生与发展,可用于评估OLP患者疾病的严重程度。Foxp3+Treg是反映机体免疫炎症反应程度的有效标志物,在OLP病情进展中起着主要作用。本研究首先观察了健康志愿者与不同分型OLP患者血清Ang-2、Foxp3+Treg的表达水平,结果显示:不同分型OLP患者血清Ang-2、Foxp3+Treg表达水平均高于对照组;糜烂型和充血型患者的表达水平均高于网纹型,而糜烂型患者的表达水平高于充血型。该结果表明OLP患者血清Ang-2与Foxp3+Treg水平均表现异常升高,提示OLP患者血管生成及免疫炎症反应均存在异常。
本研究对各分型OLP患者的临床体征评分、病损RAE评分、疾病活动评分进行评估,结果显示:糜烂型和充血型患者的临床体征评分、RAE病损评分、疾病活动评分均高于网纹型,与充血型患者相比,糜烂型患者的上述指标水平更高。这表明充血型、糜烂型患者病情更为严重。为进一步探究OLP患者血清Ang-2水平对机体免疫炎症反应程度及疾病进展的影响,本研究采用Pearson相关性分析明确血清Ang-2水平与Foxp3+Treg及各评分的相关性,结果显示:OLP患者血清Ang-2水平与Foxp3+Treg、临床体征评分、RAE病损评分、疾病活动评分均呈正相关。这表明血清Ang-2水平异常升高可促进OLP患者血管及T淋巴细胞的调节失控,从而加重患者疾病免疫炎症反应程度,促进新生血管的形成,导致疾病的进一步发展。分析原因,Ang-2可能通过刺激Tie2的单核细胞/巨噬细胞释放白细胞介素-10,抑制T细胞的增殖,增加CD4+T 细胞与CD8+T 细胞的比例,促进CD4+CD25(high)Foxp3+Treg的扩增,从而加重机体的炎症反应,促使患者病情发展。
综上所述,血清Ang-2水平在OLP患者体内存在异常升高的表现,且其升高程度与患者Foxp3+Treg水平、临床体征、病损程度及疾病活动程度呈正相关。
利益冲突声明:作者声明本文无利益冲突。
