棘孢木霉天冬氨酸蛋白酶基因的克隆表达及其对大豆分离蛋白的水解
2023-11-07邱小娴胡秋怡
周 迪,邱小娴,柯 野,胡秋怡
(韶关学院英东生物与农业学院,广东 韶关 512005)
大豆中蛋白氨基酸组成合理,且无饱和脂肪酸和胆固醇,具有良好的功能特性,是食品和饲料加工领域应用广泛的优质植物蛋白资源[1-2]。近年来,我国大豆以进口为主,2020年进口超过1亿 t,2021年进口量9652万 t,豆粕饲用需求是拉动大豆进口量的主要因素之一。但大豆中存在多种致敏原,它们通过干扰营养物质的消化和吸收,以及改变正常的新陈代谢,引起不良的生理反应,影响动物尤其是幼龄动物的健康,从而限制了其推广应用[3-4]。因此,在目前大豆蛋白资源短缺的情况下,降低或消除大豆蛋白致敏性的研究对提高大豆营养价值、提升大豆利用率和产业发展具有重要意义。
大豆球蛋白(11S)和β-伴大豆球蛋白(7S)是大豆中致敏性最强的两种蛋白。目前,常采用热处理法、酸碱化学法和生物酶解法降低或消除大豆蛋白的致敏性。其中,生物酶解法特异性强、反应条件温和、效率高,采用的蛋白酶能水解切断大豆蛋白分子的氨基酸序列,部分或完全破坏其线性表位,被认为是降低甚至消除大豆蛋白致敏性的最佳选择[5-7]。研究表明,尽管碱性蛋白酶[8-9]、风味蛋白酶[10-11]、中性蛋白酶[12]等较胰蛋白酶[13]和胃蛋白酶[14]对大豆蛋白的水解和降低致敏性的效果较好,但仍然难以完全消除其致敏性[5]。且这几种酶的最适pH值为中性偏碱性,仅适合大豆蛋白的体外水解。天冬氨酸蛋白酶(EC 3.4.23)通常被称为酸性蛋白酶,广泛分布于真菌、脊椎动物、植物、细菌和病毒中。该类酶的最适反应pH值一般在2.0~6.0之间,动物的胃(pH 2.0~4.0)和肠道环境(pH 5.0~7.5)有利于酸性蛋白酶的稳定性和催化功能[15-16]。因此,可将天冬氨酸蛋白酶直接添加到大豆蛋白中,以简化体外水解利用大豆蛋白的生产工艺。除胃蛋白酶外,其他酸性蛋白酶水解大豆蛋白的应用研究很少。如王锦欣等[17]通过黑曲霉酸性蛋白酶和胃蛋白酶联合酶解β-伴大豆球蛋白,可以将α’和α亚基完全消化,但β亚基仍表现出较强的致敏性。因此,发掘出更多、更高效的水解大豆蛋白并降低其致敏性的酸性蛋白酶有助于推动大豆蛋白更广泛的应用和发展。
棘孢木霉(Trichoderma asperellum)是4 种生防效果优良的木霉菌之一,能分泌几丁质酶、纤维素酶、木聚糖酶和蛋白酶等多种胞外蛋白酶,这些酶协同作用发挥其生物防治功能。然而,与其产生的几丁质酶[18-21]、纤维素酶[22-23]和木聚糖酶[24]相比,其产生的蛋白酶性质、功能和应用研究较少。为开发木霉属真菌蛋白酶资源及挖掘蛋白酶的应用价值,本研究从棘孢木霉中克隆天冬氨酸蛋白酶基因asp,并在毕赤酵母(Pichia pastoris)中表达。对表达的重组蛋白酶rAsp成熟肽序列和同源建模分析,然后采用rAsp浓缩液水解大豆分离蛋白,研究rAsp对大豆分离蛋白的水解及降低大豆蛋白致敏性的效果,旨在为酸性蛋白酶应用于大豆蛋白加工或开发酸性蛋白酶饲料添加剂提供理论依据。
1 材料与方法
1.1 材料与试剂
棘孢木霉(Trichoderma asperellum)CGMCC3.17461中国微生物菌种保藏中心;毕赤酵母GS115菌株(hismut+)、质粒pPIC9K 美国Invitrogen公司;RNAiso Plus、PrimeScript™ II 1stStrand cDNA合成试剂盒、PrimeSTAR®Max Premix(2×)、DNA marker、MiNiBEST DNA片段纯化试剂盒、MiNiBEST质粒纯化试剂盒及各种工具酶 TaKaRa(大连)有限公司;pEASY-Blunt克隆试剂盒 北京全式金生物技术有限公司;蛋白质分子质量标准 美国Thermo公司;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE)凝胶配制试剂盒、胃蛋白酶、聚合酶链式反应(polymerase chain reaction,PCR)扩增引物 生工生物工程(上海)股份有限公司;Sephadex G-75 美国GE Healthcare公司;大豆分离蛋白 临沂山松生物制品有限公司;β-伴大豆球蛋白和大豆球蛋白酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒 上海纪宁实业有限公司;其他试剂均为进口或国产分析纯。
棘孢木霉和大肠杆菌(Escherichia coli)培养分别采用马铃薯葡萄糖琼脂(potato dextrose agar,PDA)和溶菌肉汤培养基;毕赤酵母GS115菌株所用培养基及配方均按照Invitrogen公司的毕赤酵母多拷贝表达载体试剂盒操作进行配制。
1.2 仪器与设备
Avanti J-26S XP高速冷冻离心机 美国Beckman Coulter公司;1-14K台式高速冷冻离心机 德国Sigma公司;2720 DNA扩增仪 美国ABI公司;Multiskan GO 1510全波长酶标仪 美国Thermo公司;AKTA Prime Plus蛋白纯化系统 美国GE公司;Gene Pluser XcellTM电转化仪、1658001微型垂直电泳槽 美国Bio-Rad公司。
1.3 方法
1.3.1 棘孢木霉天冬氨酸蛋白酶基因asp的克隆
将棘孢木霉接种至PDA平板上,28 ℃培养72 h,收集菌丝体,采用RNAiso Plus试剂盒提取总RNA,使用PrimeScriptTMII 1stStrand cDNA合成试剂盒合成cDNA第一链。从GenBank数据库中下载棘孢木霉asp基因序列(登录号:XM_024902133.1),去除终止子序列后设计引物F:CGGGATCCGAGGCCATCTTCAACGTCCA和R:TAGGGGGCCCCTGGTTAGACGCAGAATTCA(下划线部分分别为引入的BamH I和ApaI限制性酶切位点序列)。以获得的cDNA为模板,利用引物进行PCR扩增,反应体系为50 μL。反应程序:98 ℃预变性3 min;98 ℃变性45 s,55 ℃退火30 s,72 ℃延伸90 s,30 个循环;72 ℃终延伸3 min。纯化回收PCR产物,连接构建pEASY-Blunt/asp克隆载体,转化至大肠杆菌DH5α菌株中,筛选阳性克隆子并测序验证,并进一步利用生物信息学软件和在线程序对编码的氨基酸序列和蛋白质三维结构进行分析。
1.3.2 重组毕赤酵母工程菌株的构建和筛选
以DH5α阳性克隆子的菌液为模板,利用引物F和R扩增asp基因片段,纯化的PCR产物经BamHI和ApaI双酶切后,连接至表达载体pICH(由载体pPIC9K改造获得),构建重组表达载体pICH/asp。利用StuI线性化载体pICH/asp,电击转化至毕赤酵母GS115菌株中(2 mm电转杯、1.5 kV、25 μF、4~6 ms),电转液经复苏后,12000×g离心2 min,弃培养基上清液至200 μL,吸打混匀后涂布至MD(minimal dextrase)平板上,28 ℃培养72 h后,挑取单菌落接种至含1.0%脱脂奶粉基础甲醇(minimal methanol,MM)平板(pH 5.0)上,以菌落周围产生透明水解圈为选择标志,筛选重组毕赤酵母菌株单菌落。以引物F和R及引物5’-AOX:GACTGGTTCCAATTGACAAGC和3’-AOX:GGCAAATGGCATTCTGACATCC进行酵母基因组PCR扩增验证。
1.3.3 重组毕赤酵母工程菌株的诱导表达
将筛选获得的重组毕赤酵母工程菌株接种至缓冲甘油培养基(pH 6.0)中,28 ℃振荡培养48 h,离心收集菌体,转接至缓冲甲醇培养基(pH 5.0)中,使初始接种量OD600nm为5~6,28 ℃诱导培养7 d。期间每24 h补加甲醇1 次,使其终体积分数为0.8%,并在每次加甲醇之前进行取样,测定培养上清液的蛋白酶活力。
1.3.4 蛋白酶活力的测定
采用Folin-酚法,取适当稀释的酶液100 μL,加入到等体积的2 g/100 mL酪蛋白底物溶液(采用pH 3.0、20 mmol/L Na2HPO4-柠檬酸缓冲液溶解)中,混匀,40 ℃孵育10 min,加入200 μL 0.4 mol/L三氯乙酸溶液终止反应。12000×g离心10 min,取300 μL上清液,先后加入1.5 mL 0.4 mol/L Na2CO3溶液和300 μL Folin-酚试剂,混匀,40 ℃孵育20 min,660 nm波长处测定吸光度,以先加入三氯乙酸的灭活酶作为对照。蛋白酶活力定义为:40 ℃每分钟水解酪蛋白产生1 μg酪氨酸所需的酶量为1 个酶活力单位(U)。
1.3.5 rAsp的纯化
4 ℃、8500×g离心15 min,收集1.3.3节培养上清液,采用截留分子质量为10 kDa的切向流膜过滤设备浓缩发酵上清液至适当体积,再用不同截留分子质量的离心超滤管逐步浓缩去杂后,以pH 3.020 mmol/L Na2HPO4-柠檬酸缓冲液对浓缩液进行透析,进一步采用Sephadex G-75分子筛层析纯化rAsp,将纯化的rAsp浓缩液于4 ℃保藏,用于后续实验。
1.3.6 pH值和温度对rAsp活力及稳定性的影响测定
以pH 2.0~7.0的20 mmol/L Na2HPO4-柠檬酸缓冲液配制不同pH值的2 g/100 mL酪蛋白底物溶液。将rAsp浓缩液用上述缓冲液适当稀释,然后与不同pH值的酪蛋白底物溶液在40 ℃反应,测定蛋白酶活力,以确定最适反应pH值。将1.3.5节纯化的rAsp浓缩液等量加入上述不同pH值缓冲液中,4 ℃孵育24 h,透析至pH 3.0,测定残余酶活力,以确定pH值对rAsp稳定性的影响。
将1.3.5节纯化的rAsp浓缩液和底物混合液于不同温度(30~60 ℃,5 ℃为间隔)下进行酶促反应,以确定rAsp最适反应温度。将rAsp浓缩液分别置于上述不同温度下分别保温10、20、40、60、80、120 min,测定残余酶活力,分析温度对rAsp稳定性的影响。
1.3.7 金属离子和化学试剂对rAsp活性的影响
在4 ℃条件下,将1.3.5节纯化的rAsp浓缩液与不同金属离子(终浓度为5 mmol/L)和不同浓度的化学试剂共孵育30 min,测定残余酶活力,以确定金属离子和化学试剂对rAsp活性的影响。
1.3.8 rAsp和胃蛋白酶水解大豆分离蛋白
用柠檬酸缓冲液(pH 3.0)配制3 g/100 mL的大豆分离蛋白溶液。然后按每毫升大豆分离蛋白溶液中分别加入23 U的rAsp和胃蛋白酶,35 ℃水解,分别于0、5、60、180、360 min取适量水解液,置于沸水中10 min灭酶,12000×g离心30 min,收集水解上清液,备用。
1.3.9 SDS-PAGE检测及水解液的致敏性测定
用SDS-PAGE(分离胶质量分数12%、浓缩胶质量分数5%)检测大豆分离蛋白水解液,以观察水解过程中β-伴大豆球蛋白和大豆球蛋白各亚基的变化情况,对照样品点样量10 μL,酶水解样品点样量20 μL;用考马斯亮蓝法测定水解上清液中蛋白含量的变化。
采用ELISA试剂盒测定大豆分离蛋白水解前后β-伴大豆球蛋白和大豆球蛋白的致敏性,按试剂盒操作步骤进行测定,以致敏性降低百分比表示水解前后致敏性的变化。
1.4 数据处理与分析
2 结果与分析
2.1 asp基因的克隆和序列分析
将提取的棘孢木霉总RNA反转录成cDNA,以cDNA为模板,采用引物F和R进行PCR扩增,获得的产物片段与预期大小一致(图1)。PCR产物经纯化后连接至pEASY-Blunt载体上,转化至大肠杆菌DH5α菌株中,挑取阳性克隆子进行测序。测序结果表明,克隆的asp基因具有完整的开放阅读框,长度为1359 bp,编码453 个氨基酸。其DNA序列与数据库公布的序列存在27 个碱基突变,相似性为98.01%;推测编码的氨基酸序列存在3 个氨基酸残基突变,分别为D251G、S289A和N397D。将rAsp序列与GenBank数据库中的序列进行比对分析,显示其属于霉菌天冬氨酸蛋白酶家族(cd06097:Aspergillopepsin_like)。rAsp成熟肽序列与已报道的该家族其他成员序列的相似性均很低,与来自Aspergillus oryzae的天冬氨酸蛋白酶(PDB code:1izd)[25]相似性最高(47.74%),与来自Trichoderma reesei的天冬氨酸蛋白酶(PDB code:3c9x)[26]相似性为43.81%,与来自Penicillium janthinellum的青霉蛋白酶(PDB code:3app)[27]相似性为44.66%,与来自Cryphonectria parasitica的天冬氨酸蛋白酶Endothiapepsin(PDB code:5hct)[28]相似性为42.04%,与来自Rhizopus chinensis的天冬氨酸蛋白酶(PDB code:2apr)[29]相似性为36.86%,与来自Aspergillus phoenicis的Aspergillopepsin I(PDB code:1ibq)[30]相似性为47.44%。这些序列的比对结果如图2所示。可见,rAsp是一种新型天冬氨酸蛋白酶,有必要进行深入研究。
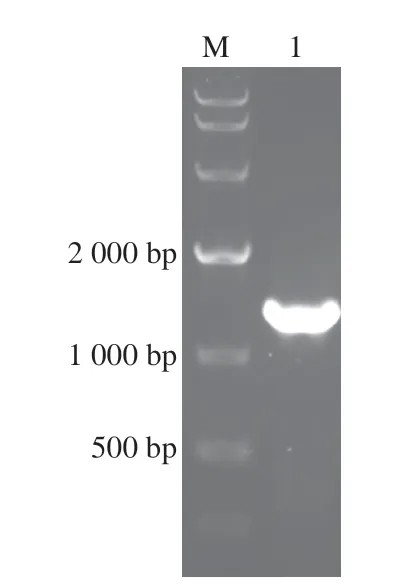
图1 天冬氨酸蛋白酶asp基因的PCR产物电泳图Fig.1 Electropherogram of PCR products of the asp gene
根据GenBank数据库中的Conserved Domain Search Service分析,rAsp为含有一个Asp域的单体酶。根据同源建模的评分,以Trichoderma reesei天冬氨酸蛋白酶(PDB code:3c9x)为模板构建出rAsp的3D结构(图3)。rAsp与其他霉菌天冬氨酸蛋白酶的三维结构和催化机制相似,即由2 个相似N端β-桶域和C端β-桶域构成,在桶域之间形成一个催化裂缝(cleft),便于底物多个残基与之结合,达到定向固定底物作用;每个桶域中DT (S) G Motif结构中的活性催化D残基亲核攻击底物肽键,达到水解底物作用。rAsp与其他6 种酶相比(以序列比对中rAsp第1个氨基酸残基Q序号定义为1,以此类推),增加126~131、145~150、161~164、183~185和262~264位点的残基片段,促使其具有更长Loop结构;rAsp的126~127位点不是保守的cis肽键,M259-W295不能形成保守的二硫键结构。对于底物特异性非常重要的C结构域第二flap环(302~307位点)而言,该环中含有高度保守的G306,该残基对底物构象定向和定位具有重要作用;在rAsp中,高度保守G突变为具有更大侧链基团P残基,以及非极性I305突变为极性N,这可能更利于侧链基团小和极性强的底物结合。rAsp结构中氨基酸残基、二级结构等方面的差异对rAsp分子结构和性质的改造具有一定的指导作用。
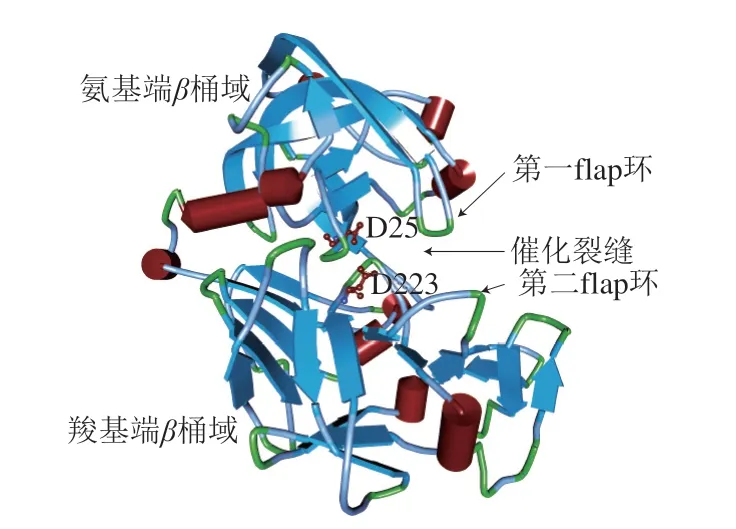
图3 rAsp的同源建模3D结构图Fig.3 3D structure diagram for homology modeling of rAsp
2.2 重组表达载体的构建和毕赤酵母工程菌株的筛选
将线性化的重组表达载体pICH/asp电转至毕赤酵母GS115后,电转菌悬液涂布在MD平板上,28 ℃培养72 h后,从中挑取单菌落至含1%脱脂奶粉的MM培养基上,以单菌落周围产生透明水解圈为筛选标志(图4),挑取具有最大水解圈直径的转化子进行酵母基因组PCR鉴定。由图5可知,以引物F和R扩增获得了asp基因的产物;以引物AOX扩增获得了2 种产物,分别为含有asp基因的重组表达载体pICH/asp序列和毕赤酵母AOX1基因序列。以上结果表明,重组毕赤酵母工程菌株成功构建并得到表达。

图4 重组毕赤酵母工程菌株的筛选Fig.4 Screening of recombinant Pichia pastoris strain
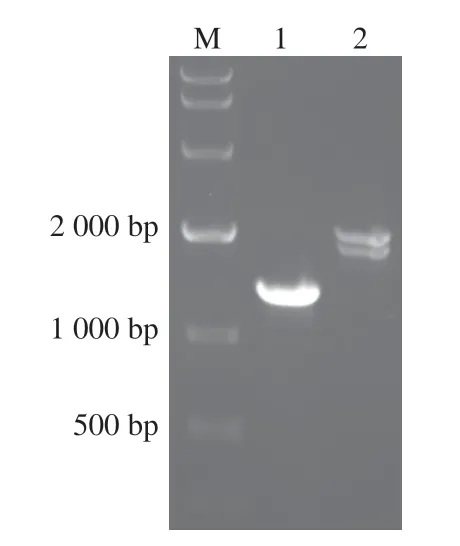
图5 重组表达载体pICH/asp转化子菌液PCR电泳图Fig.5 Electrophoretogram of PCR products from recombinant expression vector pICH/asp transformant
2.3 重组毕赤酵母工程菌株的诱导表达和rAsp的纯化
重组毕赤酵母工程菌株在三角瓶中诱导表达,当发酵至144 h,发酵液酶活力达到最大,约为25.8 U/mL,明显高于从棘孢木霉中克隆的天冬氨酸蛋白酶rAsp55(最高酶活力9.52 U/mL)[31]和rTaAsp(最高酶活力18.5 U/mL)[32],表明rAsp获得了高效表达,为该蛋白酶的应用研究提供了保障。
发酵上清液经切向流膜过滤系统浓缩、离心超滤管浓缩和Sephadex G-75凝胶过滤层析,纯化获得了单一蛋白条带(图6)。根据相对迁移率和分子质量的关系,计算出该蛋白条带的大小为49.1 kDa,与克隆的asp基因序列推导编码的氨基酸序列分子质量大小一致,表明此单一蛋白条带为rAsp。

图6 纯化rAsp的SDS-PAGE图Fig.6 SDS-PAGE analysis of purified rAsp
2.4 pH值和温度对rAsp活力及稳定性的影响结果
由图7A可知,rAsp的最适反应pH值为2.5,低于来自同种的rTaAsp(pH 4.0)[32]及同属哈茨木霉的SA76(pH 3.5)[33];rAsp在pH 2.0~6.0较广范围内稳定性好,在4 ℃孵育24 h后仍保留了90%以上的残余活力。当pH值高于6.0以后稳定性急剧下降,pH值到达7.0以后活性完全丧失。这表明rAsp在酸性条件下具有良好的酶促反应活性和稳定性,能很好地适应动物胃肠道环境,具有作为饲料添加剂的应用潜能。由图7B、C可知,rAsp的最适反应温度为45 ℃,在45 ℃以下稳定性良好,45 ℃孵育120 min仍保留77%以上的活力,当温度高于50 ℃时活力下降明显,55 ℃孵育10 min活性完全丧失。
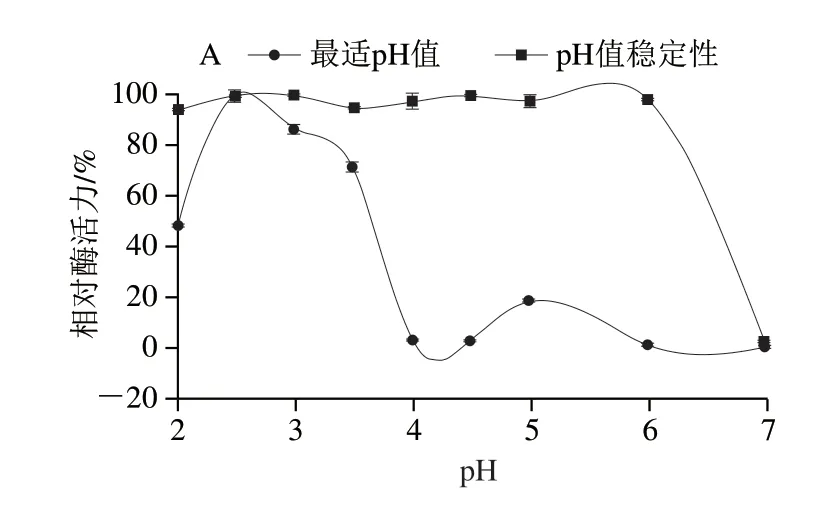
图7 pH值和温度对rAsp活性及稳定性的影响Fig.7 Effects of pH and temperature on the activity and stability of rAsp
2.5 金属离子和化学试剂对rAsp活力的影响
如表1所示,Fe3+和SDS能显著抑制rAsp的活力,其他金属离子和化学试剂促进或不显著影响rAsp的活性。其中,Cu2+和Mn2+对rAsp的活性具有促进作用,分别使其相对酶活力提高19.90%和24.23%。Cu2+和Mn2+对酸性蛋白酶的促进作用与报道的rP6281[34]和TLAP[35]的结果一致,这可能是由于Cu2+和Mn2+稳定了蛋白酶的三级结构所致;胃蛋白酶抑制剂几乎完全抑制rAsp的活性,而苯甲磺酰氟、亮肽素和抑肽酶对其活力影响不明显,表明rAsp是一种天冬氨酸蛋白酶[36-37],这与2.1节预测的结果一致。不同浓度的乙二胺四乙酸(ethylene diamine tetraa cetic acid,EDTA)对rAsp活力影响不大,表明rAsp活力不显著依赖于金属离子[38]。rAsp对大部分金属离子和化学试剂的稳定性显示了其在食品和饲料工业上广泛应用的潜力。

表1 金属离子和化学试剂对rAsp活力的影响Table 1 Effects of metal ions and chemical reagents on rAsp activity
2.6 rAsp和胃蛋白酶对大豆分离蛋白的水解
为探索rAsp在水解大豆分离蛋白上的应用,将rAsp和胃蛋白酶分别在相同条件下水解大豆分离蛋白。由图8可知,随着水解的不断进行,在rAsp和胃蛋白酶不同时间的水解产物中,两种主要致敏原如β-伴大豆球蛋白和大豆球蛋白各亚基条带逐步被降解甚至消失。5 min时,β-伴大豆球蛋白的α’(71 kDa)、α(67 kDa)和β亚基(49 kDa)被rAsp和胃蛋白酶完全降解,大豆球蛋白的酸性亚基A(38 kDa)被部分降解,碱性亚基B(21 kDa)被rAsp降解,仅剩分子质量小于25 kDa的弥散带;而此时胃蛋白酶的水解液中产生了34、31 kDa及≤5 kDa的蛋白带。60 min后,rAsp和胃蛋白酶继续水解大豆分离蛋白,直至逐步将大分子片段降解为小分子肽。水解终点时,rAsp水解液中仅见<14.4 kDa的小分子肽,而胃蛋白酶水解液中在14.4~25 kDa之间仍存在一些未被降解的弥散带,且<14.4 kDa的小分子带颜色明显比rAsp水解液深。相对蛋白含量的变化(图9)显示,随着水解的进行,rAsp和胃蛋白酶水解产物中相对蛋白含量在水解前60 min下降剧烈,在水解终点时趋于稳定,剩余相对蛋白含量分别为21.1%和28.8%,rAsp对大豆分离蛋白的水解效率比胃蛋白酶高7.7%。

图8 rAsp和胃蛋白酶对大豆分离蛋白不同水解时间产物的SDS-PAGE图Fig.8 SDS-PAGE analysis of SPI hydrolyzed by rAsp or pepsin for different time periods
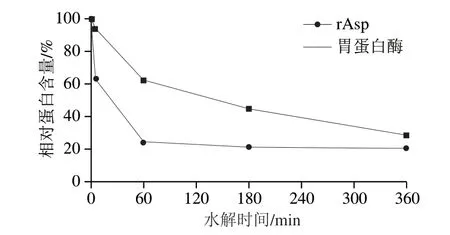
图9 rAsp和胃蛋白酶对大豆分离蛋白不同水解时间产物的相对蛋白含量变化Fig.9 Changes in relative protein content of SPI hydrolyzed by rAsp or pepsin for different time periods
水解终点时,ELASA检测结果显示,rAsp使β-伴大豆球蛋白和大豆球蛋白的致敏性分别降低了35.9%和27.9%;而胃蛋白酶相应使其降低了26.1%和15.6%。可见,rAsp降低β-伴大豆球蛋白和大豆球蛋白致敏性的能力分别约为胃蛋白酶的1.4 倍和1.8 倍。因此,SDSPAGE图谱、相对蛋白含量和致敏性变化结果表明,rAsp对大豆分离蛋白的水解能力明显强于胃蛋白酶;且水解降低大豆分离蛋白致敏性的效果强于相同条件下的胃蛋白酶,具有应用于大豆蛋白深加工或作为饲料添加剂的潜力。
3 结论
本研究从T.asperellum克隆天冬氨酸蛋白酶asp基因,并使其在毕赤酵母中成功表达。在三角瓶中诱导表达时,rAsp发酵液的酶活力最高可达25.8 U/mL。rAsp的最适反应pH值为2.5,最适反应温度为45 ℃;在pH 2.0~6.0范围内和低于45 ℃条件下稳定性好。rAsp和胃蛋白酶均能很好地降解大豆分离蛋白,使β-伴大豆球蛋白和大豆球蛋白各亚基完全水解;然而,rAsp对大豆分离蛋白的水解效率比胃蛋白酶高7.7%,而且对β-伴大豆球蛋白和大豆球蛋白致敏性降低率分别比胃蛋白酶高9.8%和12.3%。
综上所述,rAsp适应pH值范围广,特别是与动物消化系统酸碱环境相吻合,而且在降低和消除大豆蛋白致敏性方面具有显著优势,是一种新型高效的酸性蛋白酶。本研究不仅丰富了蛋白酶库内容以及为大豆食品加工产业和相应动物饲料产业提供了有力支撑,也为大豆蛋白酶水解的深入研究奠定了基础。
