2022年食品中金黄色葡萄球菌、副溶血性弧菌的检测能力验证结果分析
2023-11-06邓锦秀
邓锦秀
摘 要:目的:验证广西融安县疾病预防控制中心食品中金黄色葡萄球菌(定量)和副溶血性弧菌(定性)的检测能力。方法:按照能力验证参试指导书、《食品安全国家标准 食品微生物学检验 金黄色葡萄球菌检验》(GB 4789.10—2016)第二法 金黄色葡萄球菌平板计数法、《食品安全国家标准 食品微生物学检验 副溶血性弧菌检验》(GB 4789.7—2013)对样品进行检测。结果:22-K795、22-Y967样品的Z值分别为-1.5、0.4,能力验证结果判定|Z|≤2.0为“满意”结果,本实验室2份金黄色葡萄球菌(定量)检测样品能力验证结果均为满意。22-L696、22-E161样品均检出副溶血性弧菌,能力验证结果判定实验室检测结果与指定值一致时评价为“满意”,本实验室2份副溶血性弧菌(定性)检测样品能力验证结果均为满意。结论:通过开展本次实验室能力验证,极大地提高了本实验室的检测能力水平,证实本实验室具有食品中金黄色葡萄球菌、副溶血性弧菌的检测能力。
关键词:食品;金黄色葡萄球菌;副溶血性弧菌;检测能力验证
Analysis of Detection Ability Verification Results of Staphylococcus aureus and Vibrio parahaemolyticus in Food
in 2022
DENG Jinxiu
(Rongan County Center for Disease Control and Prevention, Liuzhou 545400, China)
Abstract: Objective: To verify the detection ability of Staphylococcus aureus (quantitative) and Vibrio parahaemolyticus (qualitative) in food from the Rongan County Center for Disease Control and Prevention, Guangxi. Method: Samples were tested according to the proficiency test guide book, the second method of Staphylococcus aureus plate counting method in GB 4789.10—2016, and GB 4789.7—2013. Result: The Z values of samples 22-K795 and 22-Y967 were -1.5 and 0.4, respectively. The ability validation result determined that |Z|≤2.0 was a satisfactory result. The ability validation results of the two (quantitative) detection samples of Staphylococcus aureus in the laboratory were all satisfactory. 22-L696 and 22-E161 samples all detected Vibrio parahaemolyticus, and the ability validation results were evaluated as satisfactory when the laboratory test results were consistent with the specified values. The ability validation results of the two Vibrio parahaemolyticus (qualitative) test samples in our laboratory were all satisfactory. Conclusion: By conducting this laboratory capability verification, the level of detection capability in our laboratory has been greatly improved, confirming that our laboratory has the ability to detect Staphylococcus aureus and Vibrio parahaemolyticus in food.
Keywords: food; Staphylococcus aureus; Vibrio parahaemolyticus; detection capability verification
金黃色葡萄球菌(Staphylococcus aureus)为革兰氏阳性球菌,呈葡萄球状排列,无芽孢、无荚膜,广泛分布于自然界,能引起各种感染和疾病,如皮肤感染、呼吸道感染、食物中毒、败血症等[1-2]。金黄色葡萄球菌具有广泛的多重耐药性和毒力因子,已成为公共卫生领域备受关注的问题之一,可通过细菌培养和鉴定、分子生物学技术、免疫学检测等对其进行检测和诊断。在临床和食品安全等领域,对金黄色葡萄球菌的快速检测和准确诊断具有重要意义,可帮助预防和控制其感染和传播[3]。
副溶血性弧菌(Vibrio parahaemolyticus)为革兰氏阴性菌,呈弧状、棒状等多形态,无芽孢,有鞭毛,常存在于海水和海产品中,可引起肠胃感染,症状包括腹泻、腹部绞痛、呕吐、恶心等[4]。人们主要通过进食受污染的海产品感染副溶血性弧菌,潜伏期一般为4~96 h,严重感染者可能导致肠穿孔和败血症,甚至危及生命[5]。副溶血性弧菌是我国东南沿海地区引起食物中毒的重要病原体之一,目前食物中毒已成为主要的突发公共事件之一[6-7]。
能力验证是指通过对已知样品的测试评估实验室在特定领域检测能力的精确度、准确度和可靠性。能力验证不仅可以评估实验室的技术水平和能力,还能帮助实验室制定和改进质量管理体系、提高检验人员的素质和意识、推动技术创新和学术交流,促进实验室良性循环和发展。因此,能力验证在现代实验室管理中具有广泛的应用价值和社会意义。
本文通过分析本实验室2022年参加由中国检验检疫科学研究院测试评价中心组织和实施的食品中金黄色葡萄球菌(定量)[ACAS-PT1328(2022)]、副溶血性弧菌(定性)[ACAS-PT1329(2022)]的检测能力验证的检测结果,提升本实验室对食品中金黄色葡萄球菌、副溶血性弧菌的检测能力。
1 材料与方法
1.1 样品来源
样品来源于中国检验检疫科学研究院测试评价中心,共检测2个项目,每个项目2个样品,样品为白色冻干块状,为人工污染的食品样品,西林瓶真空包装。
1.2 试剂与仪器
Baird-Parker琼脂(北京陆桥);冻干血浆(北京陆桥);脑心浸出液肉汤(北京陆桥);血琼脂平板(北京陆桥);TCBS培养基(北京陆桥);3%氯化钠胰蛋白胨大豆琼脂(北京陆桥);副溶血性弧菌干制生化鉴定试剂盒(北京陆桥);科玛嘉弧菌显色培养基(科玛嘉);隔水式电热恒温培养箱;XDD-84立式电热压力蒸汽消毒器;HR40-ⅡA2生物安全柜等。
1.3 检验依据
依据能力验证参试指导书、《食品安全国家标准 食品微生物学检验 金黄色葡萄球菌检验》
(GB 4789.10—2016)[8]第二法 金黄色葡萄球菌平板计数法、《食品安全国家标准 食品微生物学检验 副溶血性弧菌检验》(GB 4789.7—2013)[9]对样品进行检测。
1.4 检验方法
1.4.1 样品制备
(1)金黄色葡萄球菌样品(22-K795、22-Y967)用60 mL稀释液再水化。样品开启后,立即加入
5 mL稀释液再水化,待溶解后,吸出放入无菌瓶中,再反复用余下的稀释液清洗西林瓶内壁2~3次,回收清洗液放入上述无菌瓶中,此溶液为待测样品原液。
(2)副溶血性弧菌样品(22-L696、22-E161)用60 mL 3%氯化钠碱性蛋白胨水再水化。样品开启后,立即加入5 mL 3%氯化钠碱性蛋白胨水再水化,待溶解后,吸出放入无菌瓶中,再反复用余下的3%氯化钠碱性蛋白胨水清洗西林瓶内壁2~3次,回收清洗液置于上述无菌瓶中,此溶液为待测样品原液。
1.4.2 接种、增菌及分离培养
(1)金黄色葡萄球菌样品。以无菌吸管吸取
25 mL金黄色葡萄球菌待测样品原液置于盛有
225 mL稀释液的无菌瓶中,充分混匀,制成1∶10的样品匀液;用微量移液器吸取1∶10样品匀液
1 mL注于盛有9 mL生理盐水的无菌试管中,充分混匀,制成1∶100的样品匀液。选择3个稀释度(100、10-1、10-2)的样品匀液,每个稀释度分别吸取1 mL样品匀液以0.3 mL、0.3 mL、0.4 mL的接种量分别加入3个Baird-Parker平板,用无菌涂布棒涂布整个平板,注意不要触及平板边缘。平板涂布后静置10 min,倒置后于36 ℃恒温培养箱培养48 h。同时以标准菌株金黄色葡萄球菌作阳性对照。典型的金黄色葡萄球菌在Baird-Parker平板上呈圆形,表面光滑、凸起、湿润,颜色呈灰黑色或黑色,有光泽,周围绕以不透明圈,其外常有一清晰带。
(2)副溶血性弧菌样品。以无菌操作取25 mL副溶血性弧菌待测样品原液置于盛有225 mL 3%氯化钠碱性蛋白胨水的无菌瓶中,充分混匀,制成1∶10样品匀液。将样品匀液于36 ℃恒温培养箱培养18 h。22-L696、22-E161增菌液均浑浊生长,取增菌液各一环分别划线接种于科玛嘉弧菌显色培养基和TCBS培养基,36 ℃培养24 h。同时以标准菌株副溶血性弧菌作阳性对照。
1.4.3 鉴定试验
(1)金黄色葡萄球菌鉴定试验。选择有典型金黄色葡萄球菌菌落且同一稀释度3个平板菌落数合计在20~200 CFU的平板,計数典型菌落数。从典型菌落中挑取5个可疑菌落进行鉴定试验,分别做染色镜检、血浆凝固酶试验(36 ℃培养6 h),同时划线接种到血平板36 ℃培养24 h。
(2)副溶血性弧菌鉴定试验。挑取3个可疑菌落接种于3%氯化钠胰蛋白胨大豆琼脂平板进行纯培养,于36 ℃培养24 h后进行染色镜检、生化鉴定。
2 结果与分析
2.1 鉴定试验结果
2.1.1 金黄色葡萄球菌鉴定试验结果
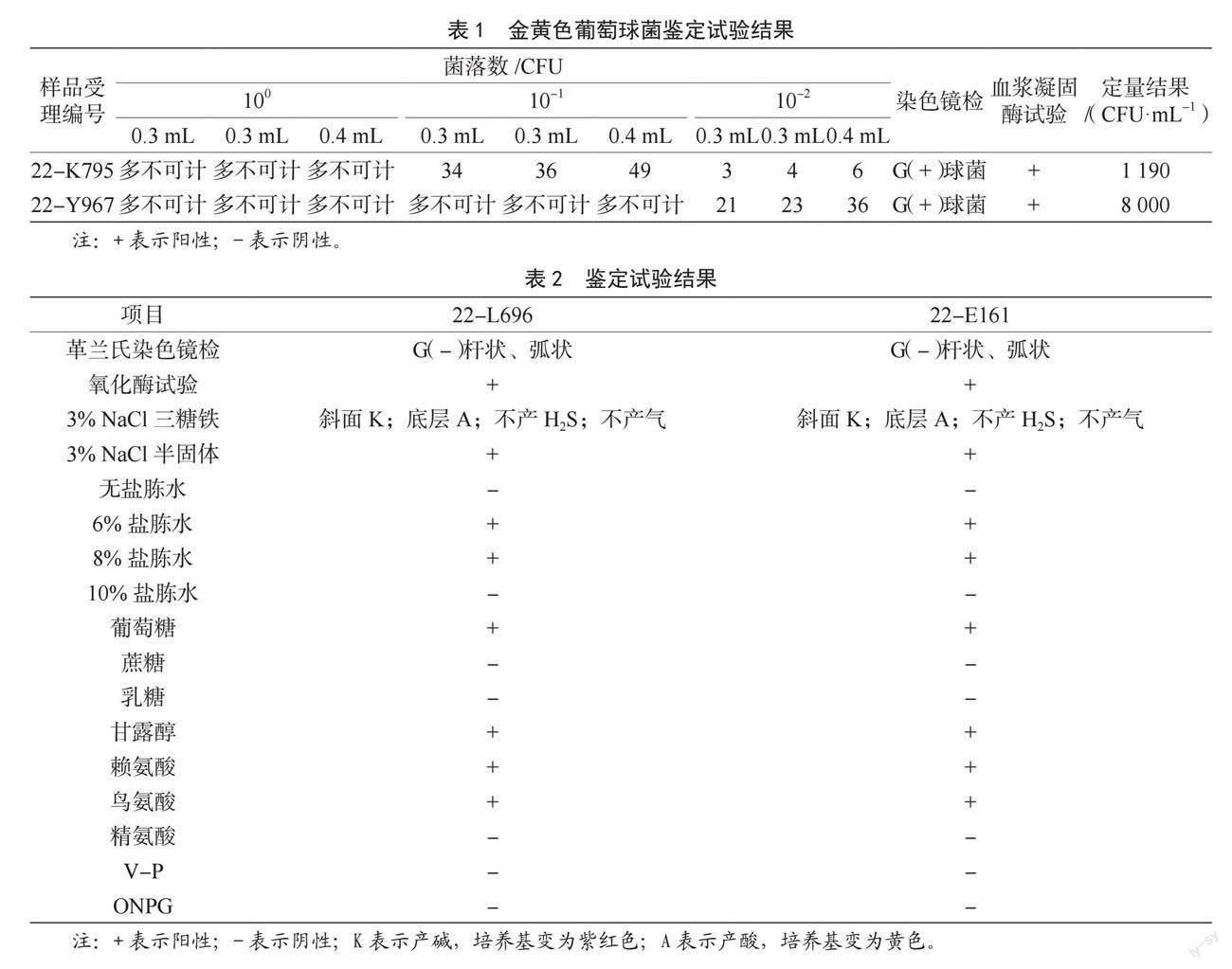
金黄色葡萄球菌样品22-K795、22-Y967在血平板上的菌落形态均为圆形、光滑凸起、湿润、金黄色,菌落周围可见完全透明溶血圈,鉴定试验结果见表1。
2.1.2 副溶血性弧菌鉴定试验结果
副溶血性弧菌样品22-L696、22-E161在科玛嘉弧菌显色平板上均为淡紫色菌落,在TCBS平板上均为圆形、半透明、表面光滑、绿色菌落,其鉴定试验结果见表2。样品22-L696、22-E161均检出副溶血性弧菌。
2.2 能力验证实验结果
2.2.1 金黄色葡萄球菌(定量)能力验证结果
能力验证结果判定|Z|≤2.0为满意结果;2.0<|Z|<3.0为可疑结果;|Z|≥3.0为不满意(离群)结果[10]。22-K795、22-Y967样品的Z值分别为-1.5、0.4,|Z|≤2.0,说明本实验室检测均获得满意结果。
2.2.2 副溶血性弧菌(定性)能力验证结果
能力验证结果判定实验室检测结果与指定值一致时,评价为满意,否则为不满意(假陰性或假阳性)[11]。22-L696、22-E161样品均检出副溶血性弧菌,均与指定值一致,说明本实验室检测均获得满意结果。
3 结论与讨论
能力验证是检测实验室、认可机构和实验室管理部门判定实验室检测能力的重要技术手段之一,也是实验室内部质量控制的有效补充。能力验证活动是判定实验室能力的国际通行做法,其结果得到广泛承认,对实验室了解、提高和证实自身能力都具有积极作用。疾控机构的微生物检验室是为卫生行政部门制定疾病预防与控制策略及采取措施、为卫生监督提供实验室技术支持、为社会日益增长的卫生需要提供卫生技术服务的检测机构,为保证所提供数据的公正、准确和科学,检测实验室需保证测定结果达到确定的检验质量标准。
本实验室检测结果(实验室代码ACAS-PT1328-
056、ACAS-PT1329-056)均与ACAS-PT1328食品中金黄色葡萄球菌(定量)、ACAS-PT1329副溶血性弧菌(定性)的检测能力验证计划指定值一致,能力评价均为“满意”结果,说明本实验室具有食品中金黄色葡萄球菌、副溶血性弧菌的检测能力。通过本次能力验证,极大提高了本实验室的检测能力水平,同时在检测过程中发现一些需要注意的事项。①样品处理时要完全溶解、混匀,无菌操作。②Baird-Parker平板在使用前要确认无水珠,如果有水珠可放置于25~30 ℃培养箱中干燥,直到平板表面水珠消失,否则会出现菌落成片生长而无法计数的情况。③在Baird-Parker平板培养至24 h后可进行一次预计数,对发现的特征菌落用记号笔进行描点标记,避免在48 h后出现杂菌干扰结果判定[12]。④要严格控制培养基的温度、湿度和通风等条件,以确保菌落的正常生长,并防止外界细菌污染。⑤在选择培养基和试剂盒等试剂时,应注意其质量和有效期,避免使用过期或受污染的试剂,影响检测结果的准确性和可靠性[13]。⑥在实验过程中要按照规范的操作程序和实验室管理要求进行,做好记录和报告工作,及时处理发现的问题和异常情况,并根据检测结果进行相应的数据分析和结论推断,提高实验室的整体技术水平和科学研究能力[14]。
参考文献
[1]路桂芬,韩深.以新版《检测和校准实验室能力认可准则》(CNAS—CL01:2018)要求开展检测方法验证的问题及解决方法[J].食品安全质量检测学报,2020,11(2):
638-642.
[2]韩塔拉,王俊瑞.金黄色葡萄球菌异质性耐药机制及实验室检测技术[J].中国感染控制杂志,2022,21(12):
1249-1256.
[3]后来旺,李达容,邓波,等.金黄色葡萄球菌RAA-LFD快速检测方法的建立与应用[J].食品科学,2022,43(4):331-339.
[4]何立勇,俞佳乐,李天华,等.微流控芯片和比色法双模同时检测副溶血性弧菌和鼠伤寒沙门氏菌[J].分析化学,2021,49(1):50-59.
[5]董换哲,苑宁,张蕴哲,等.跨越式滚环等温扩增技术结合CRISPR/Cas12a定量检测海产品中的副溶血性弧菌[J].食品科学,2022,43(14):289-295.
[6]吴俊敏,王艺,郝婧薇,等.湛江地区患病对虾池塘中副溶血性弧菌的MLST分型和新型耐药毒株的分离鉴定[J].大连海洋大学学报,2023,38(1):59-67.
[7]谢丽,杨超,江敏,等.2013—2021年深圳市急性腹泻人群副溶血性弧菌基因组流行病学特征分析[J].中华预防医学杂志,2023,57(3):386-392.
[8]中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局.食品安全国家标准 食品微生物学检验 金黄色葡萄球菌检验:GB 4789.10—2016[S].北京:中国标准出版社,2016.
[9]中华人民共和国国家卫生和计划生育委员会.食品安全国家标准 食品微生物学检验 副溶血性弧菌检验:
GB 4789.7—2013[S].北京:中国标准出版社,2013.
[10]赵丽,申玉金,胡宝翠,等.多种不同方法对微生物能力验证样品测试结果的比较及分析[J].食品安全质量检测学报,2021,12(1):320-325.
[11]覃玉英,曾江凤,王红峰,等.食品中副溶血性弧菌检测能力验证结果分析[J].检验医学与临床,2010,7(15):1552-1553.
[12]李传友,曾宝锋,赵燕英,等.恒温隔绝式聚合酶链式反应检测食品中金黄色葡萄球菌[J].食品科学,2022,43(2):339-345.
[13]滕要辉,索标,艾志录,等.速冻食品中沙门氏菌和金黄色葡萄球菌多重PCR检测方法的建立与应用[J].食品科学,2013,34(8):140-144.
[14]胡凯丽,李延梅,陈娟,等.基于代谢标志物快速检测食品中金黄色葡萄球菌[J].食品科学,2020,41(20):
314-324.
