血清三叶因子、程序性死亡配体1、糖类抗原153、癌胚抗原在乳腺癌诊断及预后中表达及意义
2023-11-06丁兴龙李庆妍杜沙莎张先娥李洪春
丁兴龙 , 李庆妍, 霍 青, 杜沙莎, 张先娥, 李洪春
徐州医科大学第二附属医院1.检验科;2.药剂科,江苏 徐州 221006;3.徐州医科大学 医学技术学院,江苏 徐州 221000
乳腺癌为临床常见恶性肿瘤之一,我国乳腺癌发病率呈递增趋势,以45~49岁较为高发[1-3]。尽早诊断乳腺癌对提高治疗效果及改善预后尤为重要。血清肿瘤标志物检测是用于恶性肿瘤筛查与预后评估的常用手段,其中以糖类抗原153(carbohydrate antigen 153,CA153)、癌胚抗原(carcinoembryonic antigen,CEA)在乳腺癌诊断中较为常用。有研究报道,血清三叶因子(trefoil factor family 1,TFF1)、程序性死亡配体1(programmed death-ligand-1,PD-L1)在乳腺癌中呈较高表达,在乳腺细胞增殖、凋亡中有一定的调控作用[4]。本研究旨在探讨TFF1、PD-L1、CA153、CEA在乳腺癌诊断及预后中的表达及意义,为临床诊治提供参考。现报道如下。
1 资料与方法
1.1 一般资料 选取徐州医科大学第二附属医院自2020年9月至2021年9月收治的200例可疑性乳腺癌患者为研究对象。纳入标准:因乳腺肿块、疼痛、乳头溢液、糜烂或皮肤凹陷等症状就诊;经影像学检查有明确活检指征或手术指征后,行病理穿刺活检或手术病理检查;资料完整且能配合随访。排除标准:既往有病灶切除史者;合并其他恶性肿瘤或存在放化疗史者;检查前1个月存在影响相关检测指标药物治疗史者;合并严重免疫性、血液性疾病或其他严重器官疾病者。根据病理检查结果将患者分为良性组(n=133)与恶性组(n=67)。良性组:平均年龄(50.8±8.5)岁;平均体质量指数(23.46±24.57)kg/m2;合并糖尿病23例。恶性组:平均年龄(51.1±9.0)岁;平均体质量指数(23.16±3.01)kg/m2;合并糖尿病11例。两组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会批准。所有患者均签署知情同意书。
1.2 研究方法 采集所有患者空腹静脉血5 ml,以3 000 r/min离心15 min后,获得血清样本,并将血清样本分为2份,置于-20℃冰箱中保存待检。采用酶联免疫吸附试验法(enzyme linked immunosorbent assay,ELISA)对患者血清TFF1水平进行检测。采用免疫组化法对PD-L1进行检验,根据阳性细胞占组织所有细胞比例与阳性细胞染色深浅进行计分。显色细胞占比<5%为0分;显色细胞占比5%~25%为1分;显色细胞占比26%~50%为2分;显色细胞占比51%~75%为3分;显色细胞占比>75%为4分。阳性细胞染色深浅计分:无显色为0分;浅黄色(1+)为1分;棕色(2+)为2分;深褐色(3+)为3分。采用化学发光免疫法对患者血清CA153、CEA进行检测。
1.3 观察指标 比较两组患者TFF1、PD-L1、CA153、CEA水平,并评估其诊断效能[5]。对恶性组患者进行为期1年的随访,统计其存活率。分析TFF1、PD-L1、CA153、CEA水平表达对患者预后的判断价值。
2 结果
2.1 两组患者TFF1、PD-L1、CA153、CEA水平比较 恶性组患者TFF1、PD-L1、CA153、CEA水平均高于良性组,差异均有统计学意义(P<0.05)。见表1。
表1 两组患者TFF1、PD-L1、CA153、CEA水平比较
2.2 TFF1、PD-L1、CA153、CEA单独及联合对乳腺癌诊断效能比较 TFF1、PD-L1、CA153、CEA单独及联合诊断的ROC曲线见图1。ROC曲线显示,TFF1+PD-L1+CA153+CEA联合诊断的ROC曲线下面积(area under the curve,AUC)、灵敏度、特异度、准确度高于各项指标单独检测。见表2。
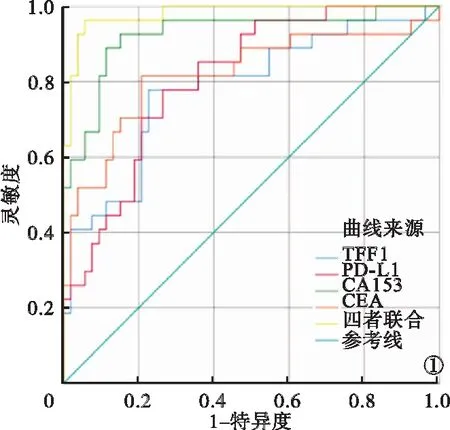
图1 TFF1、PD-L1、CA153、CEA单独及联合诊断乳腺癌的ROC曲线
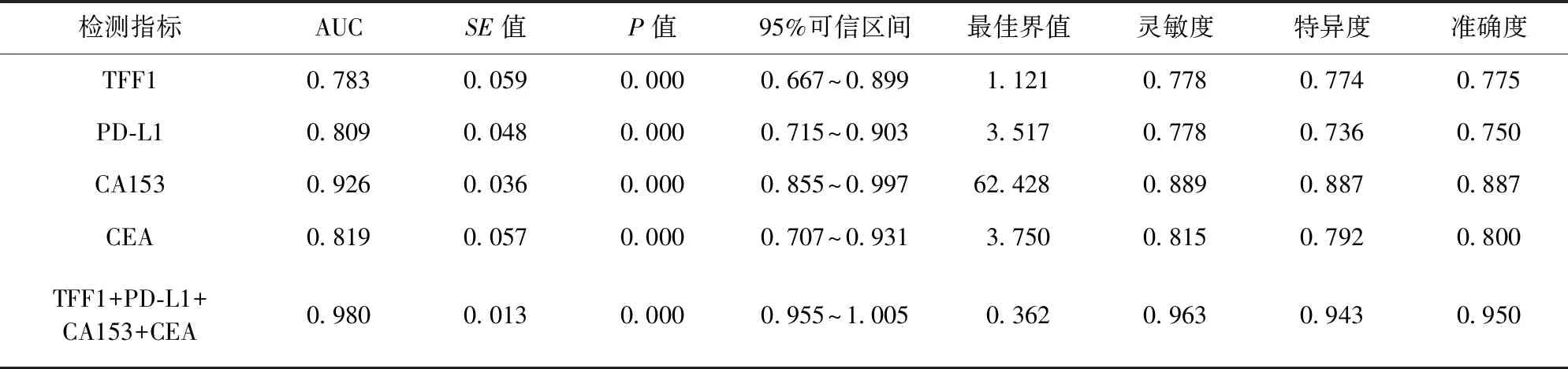
表2 TFF1、PD-L1、CA153、CEA单独及联合对乳腺癌诊断效能比较
2.3 TFF1、PD-L1、CA153、CEA单独及联合对预后诊断效能 随访1年后,67例恶性组患者中,17例死亡,50例存活,存活率为74.63(50/67)。TFF1+PD-L1+CA153+CEA联合对预后诊断的AUC、灵敏度、特异度、准确度均较高。见表3。
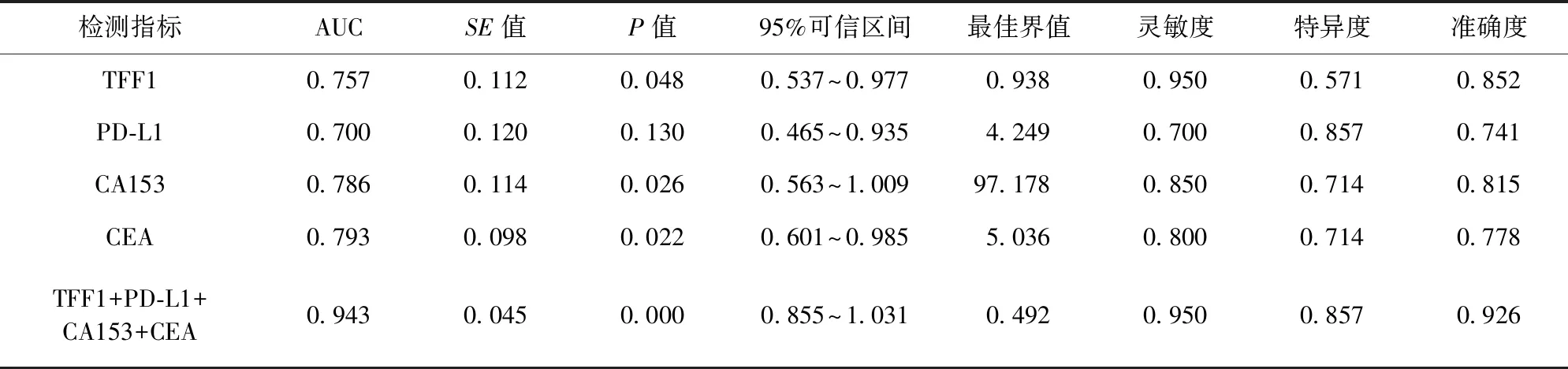
表3 TFF1、PD-L1、CA153、CEA单独及联合对预后诊断效能
3 讨论
近年来,乳腺癌发病率不断升高且呈年轻化趋势,加强对乳腺癌的筛查成为临床关注的焦点。遗传、婚育、饮食模式、肥胖等均可成为诱发乳腺癌的因素[6-7]。
乳腺钼靶摄片、病理活检是目前临床用于鉴别乳腺良恶性肿瘤的主要方式,但由于价格、操作便捷性以及创伤性等问题,用于早期筛查有一定的局限性[8]。与影像学或病理活检相比,肿瘤标志物由于检测便捷、可重复操作以及能够对预后起到一定的预测作用,逐渐成为临床诊断恶性肿瘤的常用手段。CA153、CEA是乳腺癌诊断的常用肿瘤标志物,在阳性患者中通常呈高表达。有研究报道,TFF1、PD-L1均参与乳腺癌的发生发展,对临床诊断与疾病预后监测有一定效果[9-10]。
本研究结果显示,恶性组患者TFF1、PD-L1、CA153、CEA水平均高于良性组,差异均有统计学意义(P<0.05)。这提示,TFF1、PD-L1、CA153、CEA表达水平与乳腺癌恶性程度具有相关性,乳腺恶性肿瘤细胞的增殖及肿瘤组织的扩大均会持续刺激机体产生TFF1、PD-L1、CA153及CEA。有研究报道,TFF1为肿瘤抑制因子,但在乳腺癌中的表达水平变化表明其可能与肿瘤发生、发展具有正相关性[11]。本研究中ROC曲线发现,各项指标诊断乳腺癌的AUC≥0.78,特异度、灵敏度均较高,准确度≥75%。这说明,乳腺癌患者CA153、CEA、TFF1、PD-L1水平呈高表达状态,对肿瘤良恶性均具有一定的鉴别诊断价值。CA153是由癌细胞粘蛋白1基因表达的特异性肿瘤标志物,当腺体细胞发生癌变时,激活细胞膜上的糖基转化酶,造成唾液酶、蛋白酶活性升高,继而使得腺体细胞骨架、癌细胞膜上CA153过量表达,导致淋巴因子激活杀伤细胞和细胞毒性细胞被抑制[9-10]。CEA是一种非特异性肿瘤标志物,其在健康人群肝、胰腺组织中有少量表达[11]。TFF1作为三叶因子家族成员之一,主要在胃肠道黏膜表达,其能够与黏膜蛋白结合,起到保护、修复胃肠道屏障功能的作用。在正常的乳腺组织中,TFF1往往呈低表达状态,当其水平升高时,可造成雌激素分泌紊乱,并促进细胞内细胞周期蛋白D1的表达,由此加速细胞增殖,诱发乳腺癌发生[12]。程序性死亡受体1(programmed cell death protein-1,PD-1)属于免疫调控分子,主要在活化的T细胞中表达,起到抑制T细胞活性以调节免疫系统平衡的作用。PD-L1主要在抗原递呈细胞、活化的T淋巴细胞、巨噬细胞中表达,能够抑制T细胞增值与细胞因子产生的作用[13-16]。当PD-L1与PD-1结合后,可反向活化T细胞传递抑制型号,诱导T细胞凋亡,从而促进恶性肿瘤的发生与发展。本研究结果还发现,TFF1+PD-L1+CA153+CEA联合对预后诊断的AUC、灵敏度、特异度、准确度均较高。这说明,CA153、CEA、TFF1、PD-L1的表达对恶性患者预后的预测有一定价值。随着CA153、CEA、TFF1、PD-L1水平升高,机体对于免疫细胞、T细胞的抑制作用增强,进而导致免疫系统对癌细胞增殖、分化、转移的抑制作用减弱,并形成恶性循环,进一步增加CA153、CEA、TFF1、PD-L1的表达水平[17-20]。
综上所述,血清TFF1、PD-L1、CA153、CEA均在乳腺恶性肿瘤中呈高表达,4者联合用于乳腺癌诊断及其预后评估效果较好。
