一次性使用内窥镜用注射针产品的评价与标准
2023-11-06孙锐王丹上海市医疗器械检验研究院科研与标准部上海201321
孙锐 王丹 上海市医疗器械检验研究院科研与标准部 (上海 201321)
内容提要: 介绍一次性使用内窥镜用注射针产品的应用发展及基于临床需求的设计要点,探讨一次性使用内窥镜用注射针的评价要点及国内外标准情况,并在此基础上提出制定一次性使用内窥镜用注射针产品标准的建议。
内镜注射治疗[术]是1995年公布的医学名词,是目前被广泛使用的治疗手段,内窥镜治疗术的主要优点是微创且可直接将药物注射至患病部位,在治疗消化道疾病上效果明显。内窥镜用注射针是该手术用到的主要器械,是指与内窥镜配套使用的注射针产品,该注射针是无源的医疗器械,提供至临床需保证无菌且仅供一次性使用,通常由针管、内管、外鞘管、手柄(操作部位)、鲁尔连接件(又称鲁尔接头)等部件组成。内窥镜用注射针根据临床使用的需要,具有不同的外径、工作长度、出针长度和针径,配合不同的内窥镜使用,在相关疾病的治疗过程中进行内镜下注射。内窥镜注射常用在消化道诊治的手术中,按照注射的组织部位可分为血管内注射、黏膜下注射、组织表面喷洒等,随着内窥镜技术的内窥镜注射技术的不断推广还用在某些肿瘤诊疗、呼吸器官注射甚至骨关节相关的注射等。内窥镜注射在应用于治疗消化道出血的治疗,诸如注射硬化剂、注射肾上腺素、注射无水乙醇;在用于组织分离,诸如注射生理盐水、注射美兰;在肿瘤诊疗中,诸如注射标记物、肿瘤治疗药物等方面发挥了重要作用,甚至在呼吸科、医美填充也发挥了内镜注射的技术优势。目前,内窥镜超声技术的发展也提高了内镜注射的诊疗水平,超声技术与内镜技术联合检测成为一种有效的影像学检查和治疗方法。
1.一次性使用内窥镜用注射针产品发展情况
在国际范围内,随着软式内窥镜的技术发展,在内窥镜视野下进行消化道内的检查、治疗越来越广泛。在消化道内的肿瘤、息肉等的切除术中,需要使用注射针对黏膜下进行注射,以实现病变组织与基层组织分离,可以更安全地开展黏膜切除术和黏膜剥离术。一次性内窥镜用注射针的使用使手术风险明显降低,患者在术中的伤害大大降低,术后恢复更快。注射针的出现也减少了操作的难度,给医生与患者带来福音。
近年来,国内一次性使用内窥镜用注射针产业发展较快,部分具备内窥镜技术的企业有着向内窥镜注射针发展的趋势,自20世纪80年代,国内内窥镜技术应用于临床治疗消化道疾病,经过长期发展内窥镜技术日臻完善,镜下治疗已成为治疗消化道疾病的重要手段之一[1]。当前,国内配合内窥镜用的一次性使用内窥镜用注射针产品临床需求不断增大,越来越多的企业布局生产该产品。
根据《医疗器械分类目录》,一次性内窥镜用注射针属于第三类医疗器械管理。在国家药品监督管理局网站上查询,一次性内窥镜用注射针产品已经有19张注册证,产品名称有:一次性内窥镜用注射针、一次性使用内镜注射针、一次性使用内窥镜用注射针、一次性使用内窥镜注射针、硬化剂注射针等。其中,进口持证的企业有1家,进口产品结构设计与国内产品基本一致,适用范围一致,关注点在于针管刺出的安全性、稳定性和自动控制性能。
2.一次性使用内窥镜用注射针产品的设计要点
注射针的弯曲性,配合性能、密封性能、连接性能、锁定性能,针尖强度、锋利度和出针长度是注射针在临床环境中安全有效适用的重要基础。
一次性使用内窥镜用注射针结构如图1所示。
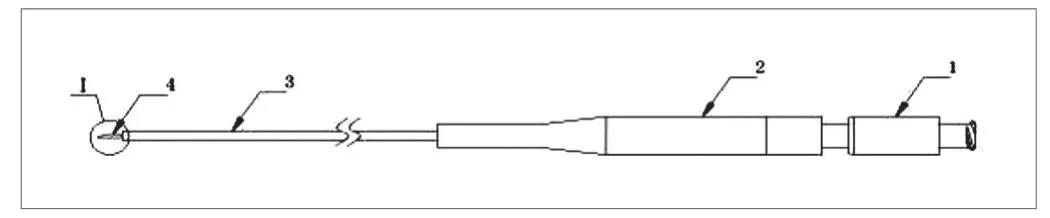
图1. 一次性使用内窥镜用注射针结构(注:1-推杆;2-手柄;3-外鞘管;4-针管;L-有效穿刺长度)
一次性使用内窥镜用注射针从治疗方式上主要分为2类,即上消化道注射用针及下消化道注射用针。临床使用时,首先需保证能将注射针与内窥镜有效配合,明确各型号内镜注射针推荐配合使用内窥镜的尺寸,保证使用时顺利通过内窥镜钳道且操作灵活,根据不同的治疗要求,临床使用需要选择不同针管外径的内镜注射针。针管外径常有21G、22G、23G、25G,对于黏膜切除术和黏膜剥离术注射普通液体垫或药物时,由于黏稠度不大,选用直径为22~25G的内镜注射针(直径0.5~0.7mm),而对于组织胶注射等需要注射的药物具有较高的黏稠度,需要选用直径更为粗大的注射针,为21G(直径1.0mm)。针长4~6mm,临床使用时对针的长度选择主要依据注射部位来确定,对于注射部位较薄的黏膜或管壁,选用短针尖的注射针可以防止或避免穿孔甚至刺深造成意外血肿的机会。
内窥镜用针外管鞘直径长一般<2.4mm(常见有1.8mm、2.3mm),外鞘管长度常在1200~2300mm,胃镜用的内窥镜较柔软,肠镜内窥镜较硬。不同材质的选择是由于胃镜操作时会在胃底进行大角度翻转,软质注射针易于通过,而肠道内窥镜在操作时弯曲度较小,长度比较远,则需要相对硬质的外鞘管来满足使用要求,上消化道用的注射针较短、较软,而下消化道用的注射针一般较长、较硬。由于内窥镜手术的特殊性,需保证内窥镜用针弯曲条件下使用时不会发生断裂,要有足够的弯曲性及一定的连接强度。
针尖强度也是临床使用时关注的要点,临床使用时可能会遇到针刺或黏膜下注射时,刺不进去或水垫注射不成功的现象,可能是所用内窥镜用针的针尖强度和刺穿力不适合导致。在上消化道用的注射针针尖角度小,坡面较长,有效注射深度比较大;下消化道用的注射针针尖角度比较大,坡面较短,有效注射深度比较小,同时需要保证一定的刺穿力才能保证手术的顺利进行。
一次性使用内窥镜用注射针配合内窥镜进行手术治疗,需保证无菌产品,且因将用于注射药液需保证注射针无有毒物质残留,注射针的内管、针管液体通道应保证清洁无微粒污染。注射药液时,针管和针的酸碱度,重金属含量,还原物质及生物相容性都是保证治疗效果的重要保障。此外,外鞘管长度,手柄设计人体工程学要求、手柄安全锁扣的有效、注射流量、注射观察、收放针尖以及外鞘管的坚韧程度也都是主要的设计要点。
3.内窥镜用注射针产品的评价
3.1 一次性内窥镜用注射针的风险研究
一次性使用内窥镜用注射针为短暂使用的无源手术器械产品,根据一次性内窥镜用注射针使用场景的特殊性及特征,对产品的风险进行分析研究。
产品的主要风险点主要集中但不限于:①生物危害,灭菌不彻底致使产品中存在细菌污染,包装材料不符合相关要求;材料热原超标,产品与药物不相容。②化学危害,组成产品的各原材料有化学毒性(如:合成胶、针管、黏合剂、润滑剂等),材料的酸碱度、蒸发残渣、重金属含量、还原物质或环氧乙烷残留量超标。③环境危害,洁净区尘埃粒子超标、温湿度或仓库环境不符合要求等。④信息危害,产品及包装上的标识不明确,不清晰;说明书上的注意事项、操作步骤描述繁琐,对操作人员的警示不足或信息不全。⑤使用危害,没有按照说明书上的注意事项及图示正确选择和操作,产品未能按照预期被使用。⑥功能性失效,产品已经过了有效期被继续使用、组装不到位,密合性或针尖锋利度不符合要求。⑦连接牢固度,部件之间配合不合理,连接牢固度不够,导致使用时脱落。⑧针尖不锋利,针尖角度和刺穿力不够。
3.2 一次性内窥镜用注射针的性能评价要点
确保一次性内窥镜用注射针的使用性能安全稳定已经成为当前临床使用者及监管部门关注的重点。企业在编写技术要求时,主要根据临床实际需要和产品的特性进行评价,以保障产品安全性和有效性。根据2022年1月17日,药监总局发布《一次性使用内窥镜注射针注册审查指导原则(2022年第4号)》[2],常见的通用技术指标包括物理和使用性能:涵盖外观(含针尖)、外鞘管尺寸(外径、长度)、针管(外径、出针长度、耐腐蚀性)、微粒污染、刺穿力、其他组件使用性能、配合性能、鲁尔连接件(又称鲁尔接头)、润滑剂(如适用);化学性能:色泽、酸碱度、蒸发残渣、紫外吸光度、重金属含量、还原物质、环氧乙烷残留量(如适用);生物性能:无菌、细菌内毒素。
性能指标给出一次性内窥镜用注射针产品基本技术性能指标,但并未给出定量要求,由于没有针对该产品的标准,企业可根据临床需求及实际情况结合企业自身产品的技术特点制定相应的技术要求。主要参照GB/T 14233.1-2022《医用输液、输血、注射器具检验方法 第1部分 化学分析方法》[3]、GB/T 14233.2-2005《医用输液、输血、注射器具检验方法 第2部分 生物试验方法》[4]、GB/T 16886.1-2022《医疗器械生物学评价第1部分:风险管理过程中的评价与试验》[5]、GB/T 1962.1-2015《注射器、注射针及其他医疗器械6%(鲁尔)圆锥接头第1部分:通用要求》[6]、YY/T 0149-1993《不锈钢医用器械耐腐蚀性能试验方法》[7]和《中华人民共和国药典》[8]等相关标准的基础上,同时结合产品自身具有的其他技术特性,而制定的注射针的分类与结构、材料、要求、试验方法,按照相关规定制定了包装、标识和说明书方面的要求。
3.3 临床研究
我国的内窥镜用注射针属于无经验或经验极少的新技术产品,需充分考虑一些可能的临床风险,包括原材料来源变化、生产加工过程添加剂等的残留、受到微生物污染、内窥镜的错误选择、未按照正确步骤操作、针刺过深导致的血肿及穿孔。内镜注射器从本质而言其实是属于注射器这个品种的创新,相对于传统的注射器而言,内镜注射器采用了新型的材料,并且具备了全新的功能,全新的作用以及全新的结构。内镜注射器的这些特点作为注射器均被收录于豁免临床评价目录。内镜注射器临床使用的安全性和有效性的评价,需要从这类产品的基本原理,组成结构,安全性,性能,应用范围等这类产品的临床评价材料展开。对于不符合豁免临床评价目录的产品,比如采用了已经在市场上流通的产品中从来没有使用过的新型制造材料的内镜注射器,注册申请人应按照临床评价指导原则的要求通过开展临床试验,或者通过对同品种医疗器械临床文献资料、临床数据进行分析评价,证明医疗器械安全、有效,提交相应的临床评价资料。
4.标准
4.1 国际标准情况
经过调研,国内暂无针对该产品的标准,国际上仅日本有相关标准,JIS T3235-2011《内镜用(穿)刺针》[9],该标准规定了通过内窥镜将药品等注射到胃肠道的内窥镜穿刺针。标准规定了外观、注射针头、抗拉强度、夹柄、生物学安全、无菌保证、细菌内毒素、生物相容性、包装要求,及相应的测试方法。包装要求还包含了一级容器和二级容器的标签信息和符号使用。其中,一级容器应防止微生物入侵,在正常搬运、运输和储存过程中对其内的产品进行适当的保护。一级容器一旦打开即不宜进行重新密封,容器须明显展示为开封状态。二级容器须具有足够的强度,以便在正常搬运、运输和储存期间保护其内物品。但是该国际标准在指标方面不够全面,标准中对刺穿力、通畅性、配合性能、残留容量、蒸发残渣、还原物质、环氧乙烷残留量均未进行规定。
4.2 国内标准的制定建议
根据产品的使用场景,及产品的特性,注射针的弯曲性,配合性能、密封性能、连接性能、锁定性能,针尖强度、锋利度和出针长度是注射针在临床环境中安全有效适用的重要基础;最大残留容量、还原物质、重金属含量、酸碱度、蒸发残渣、紫外吸光度、针头耐腐蚀性、环氧乙烷残留量、无菌、热原、细菌内毒素、生物相容性等化学和生物性能是对产品安全性评价的重要指标,有必要进行规定并给出合适的测试方法。通过标准的规定,建立符合当前内窥镜注射技术现状以及临床应用中对于不同病症下患者的性能测试,对于进一步保证内窥镜用注射针使用安全有效性具有重要意义。
5.注册技术审评
随着内窥镜治疗方式和相关技术发展的成熟,内窥镜和注射针配合使用的诊疗也越来越广泛,临床需求日益增多,仅2020年就有11家相关企业申报了这项产品[10]。根据内窥镜注射针申报适用范围、技术特征和注册审评的关注点,重点描述安全性、有效性列举出配合性能、弯曲性、针尖设计和刺穿力、锁定性能(如适用)、密封性能和连接强度、液体通道清洁度和微粒污染以及特殊设计、功能和结构这些临床常见风险因素,从技术层面论述申报产品的设计、技术特征、性能指标及制定依据、灭菌验证等,把握产品的有效性和风险性,从技术层面论述申报产品的设计、技术特征、性能指标及制定依据、灭菌验证等,规范注册申报文件、产品技术要求和检测报告,明确监管要点,提升监管效率。
6.小结
从一次性内窥镜用注射针产品发展趋势看,越来越多的企业尤其是内窥镜生产企业生产配套使用的注射针,随着内窥镜手术的广泛应用,一次性内窥镜用注射针产品的需求量不断增加;根据临床使用需求,能充分满足不同应用场景的注射针将更受欢迎,但从标准评价的要点看,国际标准规定的指标不够全面,而国内暂无标准,因此,而从临床应用角度来看,一次性内窥镜用注射针的品类繁多,有必要统一相关技术指标及测试评估方法,即通过制定该产品标准对该类产品进行有效的规范和评价,确保临床使用的安全和有效性。从长远来看,标准的规范制定也有助于加快国内相关产品的创新和发展,推动行业的高质量发展。
