妇科恶性肿瘤免疫治疗中国专家共识(2023年版)
2023-11-04中国抗癌协会肿瘤内分泌专业委员会
中国抗癌协会肿瘤内分泌专业委员会
近年来,免疫治疗作为第4大抗肿瘤治疗方法,已在癌症治疗领域取得了突破性进展,早在2013年被Science杂志评为年度十大科学突破之首[1]。目前,妇科肿瘤的免疫治疗主要围绕免疫检查点抑制剂(immune checkpoint inhibitors,ICI)、治疗性疫苗和过继性细胞免疫治疗(adoptive cell therapy,ACT)等。其中,最为广泛使用和开展研究最多的妇科恶性肿瘤免疫治疗是ICI。ICI通过阻断免疫检查点信号传递,恢复T细胞功能,诱导免疫细胞的肿瘤杀伤作用。目前已发现10多种免疫检查点,其中研究尤为广泛而深入的是程序性死亡[蛋白]-1(programmed death-1,PD-1)及程序性死亡[蛋白]配体-1(programmed death ligand-1,PD-L1)及细胞毒性T淋巴细胞相关抗原4(cytotoxic T lymphocyte-assocated antigen-4,CTLA-4)。目前用于预测PD-1/PD-L1免疫疗法的生物标志物众多,但尚未有统一标准。PD-1/PD-L1抑制剂对于PD-L1表达阳性的肿瘤总体效果较好,PD-1/PD-L1在子宫内膜癌、妊娠滋养细胞肿瘤及子宫颈癌组织中表达广泛。由于肿瘤异质性和不同平台检测方法的差异,PD-L1阳性率差异大,对于临床患者筛选也存在限制。肿瘤突变负荷(tumor mutation burden,TMB)由于肿瘤基因突变的局限性及临界值尚不明确,是否能作为筛选免疫获益指标仍存在争议[2]。DNA错配修复(mismatch repair,MMR)缺陷(MMR deficient,dMMR)使DNA复制过程中的修复功能缺失,出现微卫星不稳定,MMR正常的子宫内膜癌中PD-L1的表达水平明显低于dMMR型子宫内膜癌,MMR状态可以用于预测PD-1/PD-L1抑制剂对肿瘤的治疗效果[3]。目前进口或国产ICI药物不断被推荐用于妇科恶性肿瘤。然而,在临床实践中,如何选择免疫治疗优势人群、确定治疗方案、评估疗效、处理不良反应(adverse event,AE)等方面的临床应用尚缺乏专业推荐。因此,由中国抗癌协会肿瘤内分泌专业委员会牵头,组织多领域专家,依据高级别循证医学依据,通过共同讨论及投票,形成《妇科恶性肿瘤免疫治疗中国专家共识(2023年版)》,供国内同行参考,以期进一步规范妇科恶性肿瘤免疫治疗的临床实践。
本共识已在国际实践指南注册与透明化平台(Practice Guideline Registration for Transparency,PREPARE)上注册,注册号为PREPARE-2023CN373。
1 共识指定方法
本共识以应用于妇科恶性肿瘤免疫治疗为目标,结合中国的实际情况,采用国际公认的证据评价与推荐意见分级、制定和评价(Grading of Recommendations, Assessment, Development and Evaluation,GRADE)标准和流程制定,形成有实际应用价值的共识。本共识形成的主要步骤如下。
1.1 成立共识专家工作组
中国抗癌协会肿瘤内分泌专业委员会组织邀请国内相关领域专家共同组成《妇科恶性肿瘤免疫治疗中国专家共识(2023年版)》工作组。工作组所有参与成员均无利益冲突。
1.2 确定共识范畴
本共识就妇科常见子宫颈癌、子宫内膜癌、卵巢癌及其他恶性肿瘤分类推荐了ICI单药或联合化疗、靶向治疗等临床应用方案。总结了肿瘤疫苗、过继性细胞免疫治疗和细胞因子等免疫治疗在妇科恶性肿瘤中的相关研究及应用情况。
1.3 系统全面检索相关文献
检索数据库包括外文数据库(Medline/PubMed Central、EMBASE、Cochrane Library)和中文数据库(万方、中国生物医学文献数据库和中国知网)。检索关键词包括:immunotherapy、immunosuppression therapy、immune checkpoint inhibitors、genital diseases、gynecological malignant tumors、恶性肿瘤、免疫治疗、妇科肿 瘤。
1.4 证据质量评价
采用目前使用最广泛的证据评价和推荐意见分级系统—GRADE,它包括两部分:第一部分为证据评价,第二部分为推荐意见分级。遵循GRADE系统来评价证据,考虑证据中的偏倚风险、不一致性、间接性、不精确性和发表偏倚;GRADE系统将证据质量分为高、中、低和极低四个水平。投票意见对共识推荐强度分为强推荐和弱推荐。证据质量分级和共识推荐强度分级见表1。
2 子宫内膜癌免疫治疗临床应用推荐
2.1 ICI单药治疗
2.1.1 帕博利珠单抗
KEYNOTE-158研究[4]是一项帕博利珠单抗治疗既往治疗失败的微卫星不稳定性-高(microsatellite instability-high,MSI-H)/dMMR实体瘤的非随机、开放、Ⅱ期临床试验,共入组233例患者,其中子宫内膜癌患者49例,完全缓解(complete response,CR)为8例,部分缓解(partial response,PR)为20例,客观缓解率(objective response rate,ORR)为57.1%,中位无进展生存期(median progression-free survival,mPFS)为25.7个月,中位总生存期(median overall survival,mOS)未达到。233例患者中,≥3级治疗相关AE(treatment-related AE,TRAE)率为15%,≥3级免疫相关AE(immunerelated AE,irAE)率为6%。根据KEYNOTE-158研究结果,美国食品药品管理局(Food And Drug Administration,FDA)加速批准了帕博利珠单抗用于治疗既往接受系统治疗后进展的MSI-H/dMMR的实体瘤。已发表的另一项帕博利珠单抗治疗既往经治的晚期/复发性实体瘤的多队列、开放标签、Ⅱ期临床研究[5],前瞻性评估生物标志物组织肿瘤突变负荷(tumor mutation burden,TMB),纳入的1 073例患者中790例可以进行TMB分析,102例(12.9%)为肿瘤突变负荷高(tumor mutation burden-high,TMB-H)(≥10个突变/Mb),688例为非TMB-H。TMB-H的子宫内膜癌患者为15例,非TMB-H的子宫内膜癌患者为67例。TMB-H的子宫内膜癌ORR为46.7%,非TMB-H的ORR为6%。105例安全分析数据中,≥3级TRAE率为15.0%,≥3级irAE率为9.0%。根据该结果,美国FDA批准帕博利珠单抗治疗TMB-H、既往治疗后进展的不可切除/转移性实体瘤的适应证。
共识: 推荐帕博利珠单抗用于既往接受系统治疗后进展的TMB-H或MSI-H/dMMR复发性子宫内膜癌治疗。
证据级别:中
专家共识度:弱
2.1.2 纳武利尤单抗
NCI-MATCH研究[6]:一项纳武利尤单抗单药治疗dMMR的非结直肠癌既往经治过的复发、转移性泛瘤种的Ⅱ期临床研究中,纳入42例dMMR的患者,其中dMMR的子宫内膜癌患者13例,ORR为38.5%,2例子宫内膜癌患者获得CR。
共识:纳武利尤单抗用于dMMR/MSI-H子宫内膜癌的二线治疗可选择方案。
证据级别:中
专家共识度:弱
2.1.3 多塔利单抗
GARNET 研究[7-8]为一项多塔利单抗(dorstarlimab)治疗dMMR、错配修复完整(mismatch repair proficient,pMMR)子宫内膜癌的开放标签、单臂、多队列Ⅰ期临床研究(NCT02715284),104例dMMR的既往接受过铂类药物化疗的子宫内膜癌患者被纳入该研究,71例有可测量的病灶并超过6个月随访纳入疗效分析,ORR为42.3%,CR为9例(12.7%),PR为21例(29.6%),疾病控制率(disease control rate,DCR)为57.7%;mPFS为8.1个月,mOS未达到;≥3级TRAE率为11.5%,≥3级irAE率为7.7%。pMMR/MSS队列受试者156例,ORR为15.4%,mPFS为2.7个月,mOS为16.9个月。2021年4月,美国FDA加速批准多塔利单抗用于治疗经铂类药物治疗后进展的dMMR复发或晚期子宫内膜癌。
共识:多塔利单抗用于dMMR/MSI-H复发性子宫内膜癌的二线及后线治疗其他可选择方案。
证据级别:中
专家共识度:弱
2.1.4 阿维鲁单抗
一项阿维鲁单抗治疗dMMR和pMMR复发、转移性子宫内膜癌的Ⅱ期临床研究[9]中,33例患者入组,31例纳入研究分析(15例dMMR和16例pMMR),pMMR队列由于治疗无效而提前关闭。dMMR队列获得ORR为26.70%(4/15),1例患者为CR,pMMR队列ORR为6.25%;dMMR队列vspMMR队列6个月的PFS率(PFS6)和mPFS分别为:40.00%vs6.25%,4.4个月vs1.9个月;mOS为未达到vs6.6个月。31例患者中≥3级TRAE率为19.40%。
共识: 阿维鲁单抗用于dMMR/MSI-H复发性子宫内膜癌的二线及后线治疗其他可选择方 案。
证据级别:中
专家共识度:弱
2.2 ICI联合
2.2.1 ICI联合小分子抗血管生成药物
KEYNOTE-775/Study309研究[10]为一项帕博利珠单抗联合仑伐替尼在子宫内膜癌中的多中心、随机、对照Ⅲ期临床研究,纳入827例经标准铂类药物化疗失败的子宫内膜癌患者(pMMR为697例),按照1∶1分为pembro+lenva对比医师选择的治疗方案(多柔比星或紫杉醇),主要研究终点为PFS和OS。与化疗相比,pembro+lenva使pMMR患者mPFS延长2.8个月(6.6个月vs3.8个月),疾病复发风险降低40%(HR = 0.6);mOS延长5.4个月(17.4个月vs1.02个月),死亡风险降低32%(HR = 0.68);而对于整体人群,mP F S 延长3.4 个月(7.2个月vs3.8个月),疾病复发风险降低44%(HR = 0.56);mOS延长6.9个月(18.3个月vs11.4个月),死亡风险降低38%(HR = 0.62);ORR提高17.2%(31.9%vs14.7%)。帕博利珠单抗联合组和化疗组≥3级AE率分别为88.9%和72.7%。
共识:推荐帕博利珠单抗联合仑伐替尼用于治疗既往接受系统治疗后进展的复发、转移性非MSI-H/dMMR子宫内膜癌。
证据级别:高
专家共识度:强
2.2.2 ICI联合化疗
帕博利珠单抗联合标准化疗卡铂/紫杉醇一线治疗晚期/复发性子宫内膜癌的Ⅲ期临床研究[11](NRG-GY018,NCT03914612),纳入816例患者(591例为pMMR、225例为dMMR),主要终点为pMMR和dMMR人群的PFS。dMMR人群中mPFS,帕博利珠单抗组未达到,安慰剂组为7.6个月,帕博利珠单抗组降低70%的疾病进展或死亡风险(HR=0.30,P<0.000 1),≥3级AE率为63.3%vs47.2%。pMMR人群中mPFS为11.7个月vs8.7个月,帕博利珠单抗组降低43.0%的疾病进展或死亡风险(HR=0.57,P<0.000 1),≥3级AE率为55.1%vs45.3%。dMMR/pMMR人群的各个亚组分析均支持帕博利珠单抗+化疗更优。多塔利单抗联合卡铂/紫杉一线治疗晚期子宫内膜癌的安慰剂对照、Ⅲ期临床研究[12](RUBY,NCT03981796),纳入494例受试者随机分成多塔利单抗组和安慰剂组,主要终点为PFS[dMMR/MSI-H人群和意向治疗(intent-totreat,ITT)人群]和OS(ITT人群)。dMMR/MSI-H人群中mPFS:多塔利单抗组未达到,安慰剂组为7.7个月,多塔利单抗组降低72%的疾病进展或死亡风险(HR=0.28,P<0.000 1)。全人群中mPFS为11.8个月vs7.9个月,塔利单抗组降低36%的疾病进展或死亡风险(HR=0.64,P<0.000 1)。mOS均未达到,≥3级TRAE率为70.5%vs59.8%(表2)。
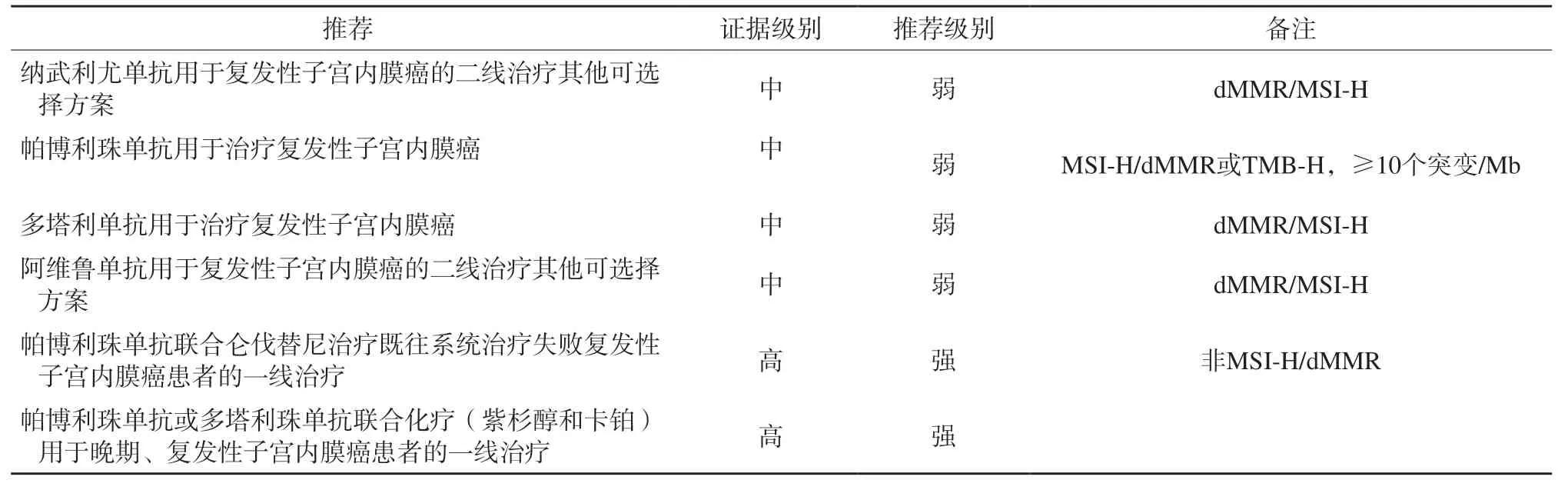
表2 ICI在子宫内膜癌中应用推荐总结Tab. 2 Recommendations for the application of ICI in endometrial cancer
共识:推荐帕利珠单抗或多塔利珠单抗联合化疗(紫杉醇和卡铂)用于晚期、复发性子宫内膜癌患者的一线治疗。
证据级别:高
专家共识度:强
2.2.3 ICI联合化疗及多腺苷二磷酸核糖聚合酶[poly(ADP-ribose) polymerase,PARP]抑制剂(PARP inhibitor,PARPi)治疗
DUO-E研究(NCT04269200)是一项三臂、随机、双盲、安慰剂对照、多中心Ⅲ期临床研究,共入组699例新诊断或复发的Ⅲ期或Ⅳ期子宫内膜癌患者,并于2023年5月公布研究结果。这些患者随机接受铂类药物化疗联合imfinzi(度伐利尤单抗)或安慰剂治疗,停化疗后,接受imfinzi+奥拉帕利或单独imfinzi作为维持治疗。结果显示,在新诊断的晚期或复发子宫内膜癌患者中,与标准化疗相比,imfinzi联合化疗,之后使用imfinzi+奥拉帕利或单药imfinzi作为维持治疗,在无进展生存期方面呈现具有统计学意义的改善。期待后期具体数据公布及改写临床治疗推荐。
3 子宫颈癌免疫治疗临床应用推荐
3.1 ICI单药
3.1.1 帕博利珠单抗
KEYNOTE-158研究[13]为一项单臂、Ⅱ期帕博利珠单抗单药治疗二线及以上子宫颈癌的临床试验,共纳入98例子宫颈癌患者,其中PD-L1阳性患者为82例(84%),总体人群的ORR为12.2%,PD-L1阳性的患者为14.6%。总体人群mPFS和mOS分别为2.1和9.4个月,PD-L1阳性的mPFS和mOS分别为2.1和11.0个月, ≥3级TRAE率为12.2%,≥3级irAE率为5.1%。KEYNOTE-158系列研究[5]前瞻性检测TMB与帕博利珠单抗治疗效果的关系,纳入1 073例患者(子宫颈癌患者75例),805例检测TMB,TMB-H(≥10个突变/Mb)为105例(13%),TMB-H患者ORR为29%,non-TMB-H患者ORR为6%,≥3级TRAE率为15%。美国 FDA于2018年6月加速批准帕博利珠单抗用于铂类药物化疗后疾病进展的PD-L1阳性(CPS≥1)复发或转移性子宫颈癌治疗。2020年,帕博利珠单抗获批TMB-H(≥10个突变/Mb)的不可手术/转移性实体瘤适应证。
共识:推荐帕博利珠单抗用于TMB-H 、PD-L1阳性、MSI-H/dMMR复发、转移性子宫颈癌二线及以上治疗。
证据级别:中
专家共识度:强
3.1.2 纳武利尤单抗
Checkmate 358研究[14]为一项纳武利尤单抗治疗复发、转移性子宫颈癌、阴道癌、外阴癌的单臂、I/Ⅱ期临床研究(NCT02488759),纳入19例子宫颈癌患者(10例PD-L1阳性,6例PD-L1阴性),总体的ORR为26.3%,mPFS为5.1个月,mOS为21.9个月,≥3级TRAE率为21.1%。纳武利尤单抗治疗子宫颈癌的研究证据有限。
共识:推荐纳武利尤单抗用于PDL-1阳性既往治疗失败的复发、转移性子宫颈癌治疗。
证据级别:低
专家共识度:弱
3.1.3 西米普利单抗
EMPOWER-Cervical 1/GOG-3016/ENGOT-cx9研究[15]为一项西米普利单抗对比研究者选择的化疗单药治疗复发、转移性子宫颈癌的随机、对照、双盲、Ⅲ期临床研究(NCT03257267),纳入608例患者,按1∶1随机分配到两组,西米普利单抗vs化疗的ORR为16.4%和6.3%,mPFS为2.8个月vs2.9个月,mOS为12.5个月vs8.5个月,≥3级TRAE率为45.0%vs53.4%。在长期生存分析中与研究者选择的化疗相比,西米普利单抗能显著提高复发、转移性子宫颈癌疗效。
共识:推荐西米普利单抗用于既往治疗失败的复发、转移性子宫颈癌治疗。
证据级别:高
专家共识度:弱
3.1.4 卡度尼利单抗
一项卡度尼利单抗(PD-1/CTLA-4双特异性抗体)治疗复发、转移性子宫颈癌的单臂、多中心、Ⅱ期临床研究[16](NCT03852251),纳入111例既往经过铂类药物化疗失败的复发或转移性子宫颈癌患者,63例(63.6%)患者为PD-L1阳性(PD-L1 CPS≥1)。在可评估疗效的99例患者中,CR率为13.1%,整体人群ORR为31.3%,mPFS为3.71个月,mOS未达到。PD-L1阳性人群ORR为41.3%,在PD-L1阴性的人群中获得16.7%的ORR。在111例受试者中,≥3级TRAE率为27.9%,≥3级irAE率为4.5%。卡度尼利单抗(PD-1/CTLA-4双特异性抗体)已获得国家药品监督管理局批准用于既往接受铂类药物治疗失败的复发、转移性子宫颈癌(不限PD-L1表达),卡度尼利单抗也是全球首个肿瘤免疫双特异性抗体,是国内第一个有子宫颈癌适应证的免疫治疗药物。
共识:推荐卡度尼利单抗用于既往治疗失败的复发、转移性子宫颈癌治疗。
证据级别:中
专家共识度:强
3.2 免疫联合
3.2.1 ICI联合化疗及抗血管生成药物
3.2.1.1 帕博利珠单抗联合铂类/紫杉醇化疗f 贝伐珠单抗
KEYNOTE-826研究[17]为一项帕博利珠单抗vs安慰剂联合铂类药物/紫杉醇化疗f 贝伐珠单抗一线治疗晚期、复发、转移性子宫颈癌的随机、对照、双盲Ⅲ期临床研究(NCT03635567),纳入617例患者,PD-L1 CPS≥1的患者为548例(89%),PD-L1 CPS≥10的患者为317例(51%)。免疫联合组对比铂类药物化疗组全人群中的ORR为65.9%和50.8%,PD-L1 CPS≥1两组的ORR分别为68.1%和50.2%,PD-L1 CPS≥10两组的ORR分别为69.6%和49.1%。全人群中:两组的mPFS分别为10.4和8.2个月,24个月OS率分别为50.4%和40.4%;PD-L1 CPS≥1的人群中,mPFS为10.4和8.2个月,24个月OS率分别为53.0%和41.7%;PD-L1 CPS≥10的人群中,mPFS为10.4和8.1个月,24个月OS率分别为54.4%和44.6%。≥3级任何AE率分别为81.8%和75.1%(表3)。
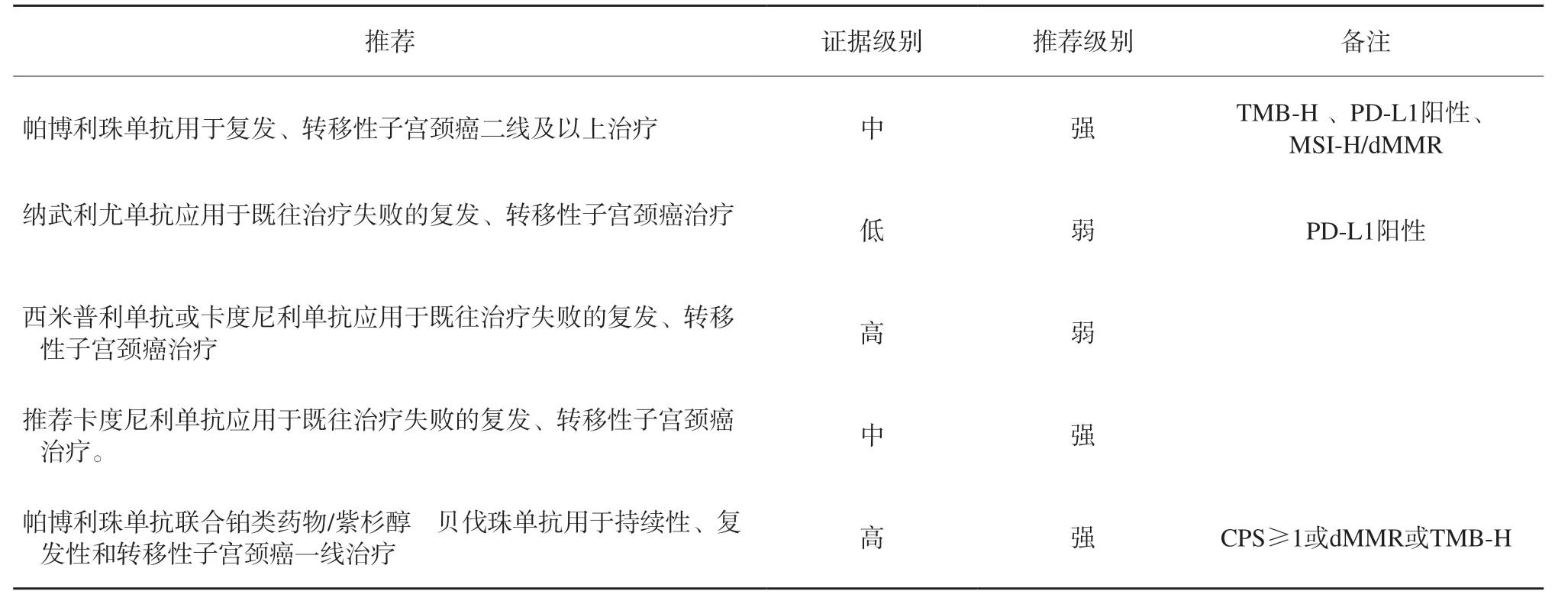
表3 ICI在子宫颈癌中应用推荐总结Tab. 3 Recommendations for the application of ICI in cervical cancer
共识:帕博利珠单抗联合铂类/紫杉醇f 贝伐珠单抗用于PD-L1 CPS≥1或dMMR或TMB-H的复发、转移性子宫颈癌的一线治疗。
证据级别:高
专家共识度:强
3.2.1.2 卡度尼利单抗
AK104-210研究[18]为一项PD-1/CTLA-4双特异性抗体卡度尼利单抗+铂类药物/紫杉f贝伐珠单抗一线治疗子宫颈癌的Ⅱ期临床研究(NCT04868708),纳入45例患者,分成队列A-15(卡度尼利单抗15 mg/kg)、队列A-10(卡度尼利单抗10 mg/kg)和队列B-10(卡度尼利单抗10 mg/kg)。卡度尼利单抗10 mg/kg+化疗f 贝伐珠单抗组的ORR为79.3%,DCR为96.6%(无论PD-L1表达);针对PD-L1 CPS≥1的人群,ORR为82.4%;针对PD-L1 CPS<1的人群,ORR为75.0%;mPFS和mOS未达到,≥3级TRAE率为60%,≥3级irAE率为15.6%。卡度尼利单抗+铂类药物/紫杉醇f 贝伐珠单抗一线治疗子宫颈癌的随机、对照、Ⅲ期临床研究于2022年6月完成入组(440例),期待结果的公布。暂不推荐卡度尼利单抗联合化疗用于晚期、复发子宫颈癌。其他ICI联合化疗f 贝伐珠单抗一线治疗晚期子宫颈癌的研究也在进行中,阿替利珠单抗vs安慰剂+铂类药物化疗+贝伐珠单抗的随机、对照、双盲Ⅲ期一线治疗复发、转移性子宫颈癌的研究(NCT03556839),样本量为404例,预计2023年12月完成。Prolgolimab(BCD-100)vs安慰剂+铂类药物化疗f 贝伐珠单抗的随机、对照、Ⅲ期临床研究,样本量为316例,预计完成时间2024年12月。
共识:基于当前有限数据结果,暂不推荐卡度尼利单抗及其他免疫抑制剂在子宫颈癌中联合应用。
证据级别:低
专家共识度:强
3.2.2 I C I 联合小分子酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)药物
CLAP研究[19]为一项卡瑞利珠单抗联合甲磺酸阿帕替尼二线治疗复发、转移性子宫颈癌的单臂、Ⅱ期临床研究,纳入45例患者,30例PD-L1阳性,10例PD-L1阴性,总体ORR为55.6%,PD-L1阳性的ORR为69%,PD-L1阴性的ORR为50%。总体mPFS为8.8个月,PD-L1阳性的mPFS未达到,PD-L1阴性的mPFS为5.2个月,mOS未到达。≥3级TRAE率为71.1%,≥3级irAE率为8.8%。信迪利单抗联合安罗替尼二线治疗PD-L1阳性的复发、转移性子宫颈癌的单臂、Ⅱ期临床研究[20](ChiCTR1900023015),纳入42例既往至少接受过一次系统性化疗的PD-L1阳性患者,ORR为54.8%,mPFS为9.4个月,mOS为17.4个月25,≥3级TRAE率为16.7%。鉴于上述研究为Ⅱ期小样本临床试验,相关循证医学依据并不充分,临床上宜谨慎使用。
共识: 基于当前数据,暂不推荐ICI联合小分子TKI药物在子宫颈癌中联合应用。
证据级别:低
专家共识度:强
4 卵巢癌免疫治疗临床应用推荐
4.1 ICI单药
ICI单药治疗复发卵巢癌疗效欠佳,尚无免疫治疗方案获批用于卵巢癌治疗。
4.2 免疫联合
4.2.1 ICI联合化疗
JAVELIN Ovarian 100研究[21]及IMagyn050/GOG3015/ENGOT-OV39研究[22]均未获得阳性结果。这两项研究的结果提示现有证据下并不支持在新诊断的卵巢癌患者中使用ICI。
4.2.2 ICI联合PARPi
2023年6月,美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)公布了奥拉帕利一线治疗卵巢癌的Ⅲ期临床DUO-O试验[23]中期分析结果,DUO-O是一项随机双盲试验,旨在评估度伐利尤单抗联合铂类药物化疗和贝伐珠单抗,随后给予度伐利尤单抗和贝伐珠单抗(伴或不伴奥拉帕尼)维持治疗,在新确诊的无BRCA突变的晚期卵巢癌患者中的疗效和安全性。结果显示,与对照组(化疗+贝伐珠单抗)相比,奥拉帕尼、度伐利尤单抗、化疗和贝伐珠单抗联合疗法能够在统计学与临床上显著改善患者的无进展生存期。表明新诊断的晚期卵巢癌联合免疫治疗、贝伐珠单抗及PARPi可能获得新的突破,有望第一次把ICI联合治疗写入卵巢癌诊治指南。
4.2.3 双ICI联合
CTLA-4/B7和PD-1/PD-L1是两种最具代表性的免疫检查点途径,它们在T细胞活化的不同阶段负性调节T细胞免疫功能。与单独的PD-1抑制剂相比,针对PD-1和CTLA-4的双重检查点抑制已显示出增强的临床前及临床抗肿瘤活性[24-29]。美国纪念斯隆凯特琳癌症中心的一项随机Ⅱ期临床研究[30]结果显示,对于持续性或复发性卵巢癌患者,与单药纳武利尤单抗相比,接受纳武利尤单抗联合CTLA-4抗体伊匹木单抗(ipilimumab)的缓解率更高,mPFS更长(尽管有限),单药纳武利尤单抗和联合组的mPFS分别为2.0和3.9个月,且联合使用的毒性与既往报道的相当。
4.3 ACT
一项采用肿瘤浸润淋巴细胞(t u m o r infiltrating lymphocyte,TIL)疗法治疗6例铂类药物耐药卵巢癌患者的初步研究[31]结果显示,4例患者疾病稳定(stable disease,SD)3个月,2例患者SD 5个月,其中5例患者的靶病灶有所减少,进展主要是由于出现新病灶,而靶病灶总体上保持稳定或消退。一项探索6B11-OCIK过继性细胞治疗铂类药物耐药、复发或难治性卵巢癌的初步安全性和潜在疗效的研究[32]结果显示,3例铂类药物耐药复发或难治性卵巢癌患者中,1例为SD,2例为PR;2例患者出现潜在的药物相关1级和2级虚弱,未观察到其他AE。这些小样本的初步临床研究结果提示ACT治疗卵巢癌的耐受性良好,毒性可控,可行性尚可,具有潜在的临床疗效,但仍需进一步研究确定疗效及获益人群。
4.4 肿瘤疫苗
SOV01是一项评估卵巢癌树突状细胞疫苗DCVAC/OvCa联合一线标准化疗应用于减瘤手术后新诊断上皮性卵巢癌患者的随机、开放、三臂多中心Ⅱ期临床试验[33],共纳入99例患者分为3组:A组患者接受DCVAC/OvCa疫苗与化疗(卡铂和紫杉醇)同时治疗,B组患者接受化疗(卡铂和紫杉醇)与DCVAC/OvCa疫苗序贯治疗,C组患者仅接受化疗(卡铂和紫杉醇),结果显示,化疗后序贯使用DCVAC/OvCa疫苗,患者的mOS最长,疗效最好,3组的mPFS分别为18.3、24.3和18.6个月。随后,研究者针对DCVAC/OvCa疫苗与化疗序贯治疗进行了SOV02试验[34],共纳入71例患者,39例患者接受DCVAC/OvCa疫苗与化疗序贯治疗,其中32例患者完成了治疗并获得了可观察的数据,另有32例患者仅接受卡铂联合吉西他滨的化疗,结果显示,DCVAC/OvCa组的mPFS为11.3个月,mOS为35.5个月;化疗组的mPFS为10.1个月;mOS为22.1个月;DCVAC/OvCa组的mPFS及mOS比化疗组分别延长了1.2和13.4个月。DCVAC/OvCa组患者的2年OS率为72.4%;化疗组患者仅为40.9%。肿瘤疫苗具有潜在的临床疗效,但仍需进一步研究确定其疗效。
共识:基于当前数据,尚无免疫治疗有效方案推荐用于卵巢癌治疗。
证据级别:极低
专家共识度:强
5 其他妇科恶性肿瘤免疫治疗
5.1 外阴、阴道癌
I C I 在外阴、阴道癌中相关研究较少。KEYNOTE158外阴癌队列共入组101例晚期患者,ORR 为10.9%,mPFS为2.1个月,mOS为6.2个月,中位持续缓解时间(median duration of response,mDOR)为20.4个月[35]。一项评估纳武利尤单抗在HPV阳性的复发、转移性子宫颈癌、外阴癌或阴道癌的临床试验,包括5例外阴或阴道癌,使用纳武单抗240 mg每2周静脉注射,中位随访时间31周。阴道/外阴癌的客观有效率为20.0%(95% CI:0.5 ~ 71.6)[36]。
共识:推荐帕博利珠单抗用于TMB-H、PDL1阳性或dMMR/MSH-H外阴癌二线或后线可选择治疗;纳武利尤单抗用于HPV相关肿瘤。
证据级别:低
专家共识度:弱
5.2 外阴阴道黑色素瘤
免疫治疗在黑色素瘤的治疗中占有重要地位,免疫治疗联合化疗的有效率明显高于单纯化疗和单纯免疫治疗。生殖道黑色素瘤应用ICI治疗研究有限,往往借鉴皮肤型黑色素瘤治疗经验。纳武利尤单抗和帕博利珠单抗已被美国FDA批准与CTLA-4抑制剂伊匹木单抗联合使用治疗BRAFV600野生型转移性黑色素瘤患者。另外,伊匹木单抗或纳武利尤单抗可用于区域淋巴结转移或>1 mm的微转移的黑色素瘤术后辅助治疗。首个国产PD-1抑制剂特瑞普利单抗被中国国家药品监督管理局批准用于既往接受全身系统性治疗失败的不可切除或转移性黑色素瘤[37]。对初诊黑色素瘤患者建议进行C-KIT、BRAF和NRAS基因检测[38-39],其检测结果可指导预后预测、分子分型和晚期治疗。外阴/阴道黑色素瘤中BRAF、NRAS基因突变率很低,C-KIT基因突变则更为常见。BRAF突变阳性者可从BRAF抑制剂维莫非尼(vemurafenib)治疗中获益,突变阴性者可选用PD-1抑制剂。
共识:推荐帕博利珠单抗、纳武利尤单抗和(或)伊匹木单抗用于治疗不可切除或转移性外阴/阴道黑色素瘤患者;推荐特瑞普利单抗、普特利单抗用于经全身治疗失败的不可切除或转移性黑色素瘤的治疗。
证据级别:低
专家共识度:强
5.3 妊娠滋养细胞肿瘤免疫治疗与临床应用
TROPHIMMUN研究[40]是第一项前瞻性、单臂、多中心的Ⅱ期临床研究,对单药化疗耐药的GTN患者,每2周静脉注射avelumab治疗,直至人绒毛膜促性腺激素(human chorionic gonadotrophin,hCG)正常,然后巩固3个周期。在纳入的15例患者中,8例(53.3%)在中位9个周期后hCG降至正常,中位随访时间19个月没有复发。CAP 01研究[41]是用卡瑞利珠单抗联合甲磺酸阿帕替尼治疗复发/耐药妊娠滋养细胞肿瘤的Ⅱ期单臂临床研究,20例患者的ORR为55%(95% CI:32 ~ 77),其中10例获得CR(50%;95% CI:27 ~ 73),mPFS为9.5个月(95% CI:NR ~ NR);mOS尚未达到。其中5例(71%)再接受入组前未能成功的化疗方案仍能达到CR,提示免疫检查点抑制剂联合抗血管生成可能会调节患者的免疫系统,从而改善化疗的敏感性[41]。探索新的免疫检查点抑制剂以及免疫治疗联合其他治疗,降低化疗的不良反应是滋养细胞肿瘤治疗的新趋势(表4)。

表4 ICI在妇科其他恶性肿瘤中应用推荐总结Tab. 4 Recommendations for the application of ICI in other gynecological malignancies
共识:推荐对化疗耐药/复发的妊娠滋养细胞肿瘤患者个体化挽救治疗。推荐对高危耐药/复发的妊娠滋养细胞肿瘤患者,可以选择单药帕博利珠单抗或卡瑞利珠单抗联合甲磺酸阿帕替尼治疗。
证据级别:中
专家共识度:强
6 妇科肿瘤免疫治疗不良反应及管理
近年来,随着免疫治疗在妇科肿瘤中的应用日益广泛,其相关AE也备受关注。与免疫治疗相关的AE称为irAE。据统计,几乎所有器官系统都可能受到irAE的影响,包括皮肤、消化道、肺、内分泌系统和心血管系统[42]。尽管大多数irAE表现较轻且具自限性,但仍有一些严重AE不可预测,甚至出现致死性毒性反应。轻度irAE通常采取对症治疗即可,而对于重度irAE,可能需要停止治疗和(或)给予免疫抑制治疗。因此,对于妇科肿瘤中出现irAE的患者应注重全程化管理,临床医师必须熟知irAE及处理流程,以确保用药安全、患者安全。
6.1 irAE的发生机制
irAE发生的确切病理生理学机制尚不清楚,目前认为其与机体自身免疫系统功能的改变相关,包括机体免疫系统过度激活、自身免疫耐受打破,或机体对抗原的识别更加敏感而攻击自身组织[43]。可能相关机制见表5。

表5 irAE发生的可能机制Tab. 5 The possible mechanism of irAE
6.2 irAE的发生特点
ICI以免疫细胞为靶点,通过增强抗肿瘤免疫反应起效,可带来长期和持续的临床获益,其irAE以早期表现为主,最主要的毒性集中在与免疫相关的器官上,如胃肠道、皮肤、甲状腺、肝脏。另外免疫治疗耐受性较好,与化疗引起的AE相比,irAE整体发生率较低,其出现时间通常由受累器官系统决定,从早期发生(第1周)至延迟事件(急性肾损伤最长26周),主要发生时间窗为4 ~ 12周,而绝大多数时间发生在前2个月。irAE以1 ~ 2级为主,3 ~ 4级发生率低,大部分呈可逆性,研究显示ICI通常与短暂性irAE相关,其中大部分可在几周内消失,而与免疫治疗有关的内分泌疾病往往是不可逆的,需要长期激素替代治疗[44](证据级别:中;推荐级别:弱)。不同ICI的irAE毒性谱和发生率有所差异,同一ICI作用于不同肿瘤产生的毒性谱不同。
6.3 妇科肿瘤患者常见的irAE
在妇科肿瘤临床研究中,应用ICI的安全性与已知其他瘤种中单药及联合用药的安全性基本一致,ICI常见的irAE包括免疫相关胃肠毒性、免疫相关皮肤毒性、免疫相关内分泌毒性、免疫治疗肝脏相关AE、免疫相关肺毒性(肺炎)、免疫相关心脏毒性(心肌炎)等[45](证据级别:高;推荐级别:弱)。卵巢癌相关irAE:PD-L1抑制剂irAE的发生率为16.8%,常见为甲状腺功能减退和皮疹,3级irAE(结肠炎、2型糖尿病、肌炎)率为2.4%,未见4级或5级irAE[46](证据级别:高;推荐级别:弱)。子宫内膜癌相关irAE:常见的irAE为甲状腺功能减退、皮疹、腹泻、肌炎等[9]。子宫颈癌相关irAE:PD-L1抑制剂的G3及以上irAE率为12% ~ 21%,常见为腹泻、结肠炎、皮疹、肝功能异常、关节疼痛等[47]。
皮肤毒性是最常见的irAE,多为轻-中度,PD-1/PD-L1抑制剂所致的任意级别和严重皮肤毒性发生率分别为17% ~ 40%和<5%,常发生在治疗早期,包括皮疹、瘙痒、白癜风、反应性皮肤毛细血管增生症,甚至严重大疱性皮炎、中毒性表皮坏死松解症等[48]。胃肠道毒性也是常见irAE,主要表现为腹泻、结肠炎、临床表现为腹泻、腹痛、大便带血或黏液、发热等,此外还可表现为口腔溃疡、肛门病变等。内分泌毒性是另一种常见irAE,包括甲状腺功能异常(甲状腺功能减退、甲状腺功能亢进、甲状腺炎等)和急性垂体炎(垂体功能低下,包括中枢肾上腺功能减退、性腺功能减退等),其他少见的irAE包括原发肾上腺功能减退、1型糖尿病、高钙血症、甲状旁腺功能减退等。免疫性肺炎亦十分常见,在所有肺炎病例中,72%的患者为1 ~ 2级,与甲状腺炎和肝炎等免疫反应不同,大部分免疫相关性肺炎需要激素或免疫抑制剂治疗。
6.4 irAE的全程化管理策略
2018年ASCO联合美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)共同发布了《免疫治疗相关不良反应管理指南》以指导临床实践,现已更新至2022年第1版[49],2019年中国临床肿瘤学会(Chinese Society of Clinical Oncology,CSCO)发布了《CSCO免疫检查点抑制剂相关的毒性管理指南》[50]。本共识主要参考CSCO毒性指南。irAE的基本处理原则包括预防、检查、评估、治疗和监测。
6.4.1 预防、检查及评估
irAE的预防、检查及评估详见表6。
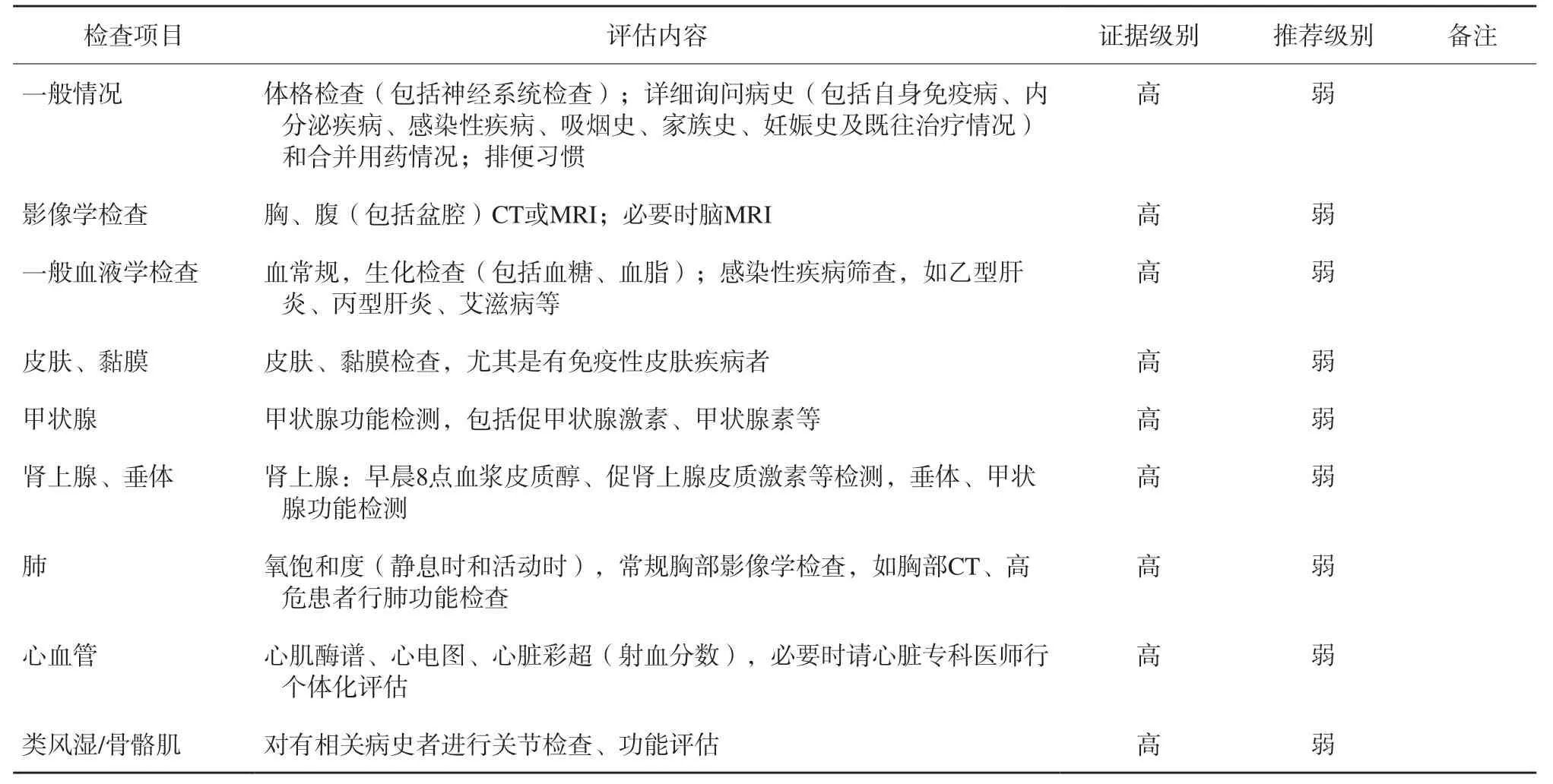
表6 irAE的检查及评估Tab. 6 Examine and evaluation for irAE
6.4.2 irAE的治疗(分级处理原则)
一线治疗:激素内分泌系统以补充为主;二线治疗:合成的其他免疫抑制剂,单抗类靶向治疗药物(表7、8)。
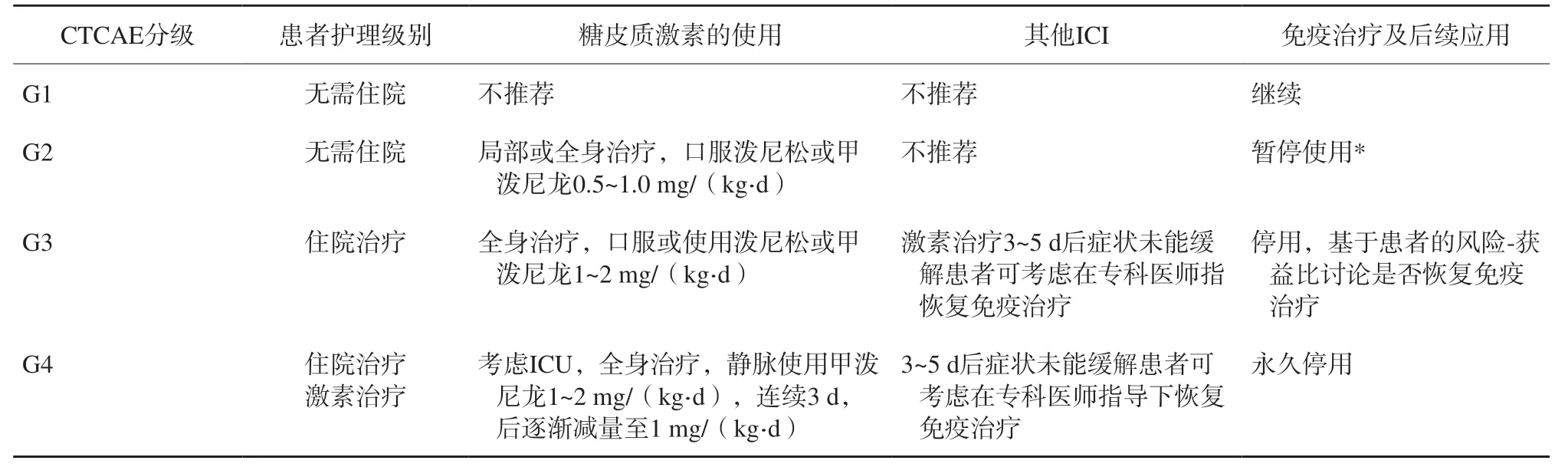
表7 irAE的分级及治疗Tab. 7 Gradation and treatment of irAE

表8 irAE治疗原则Tab. 8 Treatment principles for irAE
利益冲突声明:所有作者均声明不存在利益冲突;与相关药物企业无利益冲突。
致谢:
我们衷心感谢《重庆医科大学学报》编辑部唐秋姗女士和其他对本共识提供建议和帮助的专 家。
