身体剂量参数对局部晚期鼻咽癌患者免疫细胞减少的影响分析:一项回顾性队列研究
2023-11-04江健韵翟瑞萍应红梅
江健韵,翟瑞萍,应红梅
1. 复旦大学附属肿瘤医院放射治疗中心,复旦大学上海医学院肿瘤学系,上海 200032;
2. 上海市放射肿瘤学重点实验室,上海 200032;
3. 上海市放射治疗临床医学研究中心,上海 200032
调强适形放疗(intensity-modulated radiotherapy,IMRT)的使用可显著提高鼻咽癌患者的局部无复发生存(locoregional relapse-free survival,LRFS)和总生存(overall survival,OS)率。然而,局部晚期鼻咽癌患者的预后仍无法令人满意,这些患者5年总生存率仅为67% ~ 77%,5年局部复发(locoregional relapse,LR)的概率为10% ~ 20%,5年远处转移(distant metastasis,DM)的概率为20% ~ 40%[1-5]。因此,确定有效和准确的预后预测标志物对改善放疗效果和实现个体化治疗至关重要。
白细胞(white blood cell,WBC)计数是免疫系统状况的一个重要标志[6]。在多种肿瘤中,剂量学参数被认为有助于评估放疗剂量对循环免疫细胞的影响,并与血液系统并发症的发生风险有关[7]。然而,鼻咽癌患者WBC计数的动态变化与患者生存结局的关系尚未被深入探讨。本研究拟评估放疗期间各种WBC计数的百分比变化对局部晚期患者预后的影响。剂量-体积直方图(dose-volume diagram,DVH)中基于体积的剂量学参数可用于评估血液系统并发症的风险[8],本研究采用DVH分析与血液毒性相关的身体剂量参数,并分析其与WBC水平之间的关系,观察患者的生存情况。
1 资料和方法
1.1 临床资料
本研究纳入2012年1月1日—2016年12月31日在复旦大学附属肿瘤医院接受根治性放疗的423例鼻咽癌患者,末次随访时间截至2022年12月15日。具体入选标准如下:基于美国癌症联合会(American Joint Committee on Cancer,AJCC)/国际抗癌联盟(Union for International Cancer Control,UICC)第7版分期系统的Ⅲ ~ Ⅳa期鼻咽癌;治疗前未发现有远处转移灶;完整的放疗周期;美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)表现状态为0 ~ 1级。所有患者均采用同步加量(simultaneous-integrated boost,SIB)调强放疗技术。放疗计划和对计划评价的具体标准参考先前发表的研究[9]。所有患者模拟定位计算机断层扫描(computed tomography,CT)的范围皆为头顶到锁骨头下缘下2 cm,进行5 mm层厚的连续扫描。在分析前,导出的所有治疗计划均由同一位放疗科医师和物理师重新评估过,以消除人为因素造成的误差。
1.2 数据收集
在放疗前7天内收集患者的绝对WBC计数、淋巴细胞(lymphocyte,LYM)计数、绝对单核细胞(monocyte,MONO)计数、绝对中性粒细胞(neutrophil,NEU)计数和绝对血小板(platelet,PLT)计数,放疗期间每周至少检测1次。不同细胞计数的百分比变化幅度(ΔWBC%、ΔLYM%、ΔMONO%以及ΔNEU%和ΔPLT%)的计算方法为:(放疗前的细胞计数-放疗期间细胞计数最低值)/放疗前的细胞计数h 100%。身体剂量参数从剂量-体积直方图中提取,VdGy(%)定义为暴露于d Gy以上射线的身体体积百分比,从V5开始到V70,以5为单位进行收集。此外,还采集了辐照平均身体剂量(mean body dose,MBD)和身体辐照总剂量(integral body dose,IBD)。MBD代表放疗计划中CT定位确定的身体体积在整个放疗过程中接受辐射的平均剂量,该数据是从复旦大学附属肿瘤医院放疗科的Philips Pinnacle 2 治疗计划系统导出;IBD则是身体辐照平均剂量MBD和CT模拟定位体积(即头顶到锁骨头下缘下2 cm的扫描范围)的乘积。最后获得共计16个身体剂量参 数。
1.3 临床终点与随访
本研究的主要终点是OS,定义为从开始治疗的时间到死亡或随访截至日期(2022年12月15日)。次要终点是LRFS和无远处转移生存(distant metastasis free survival,DMFS),前者指从放疗开始到首次出现局部区域复发的时间,后者指放疗开始到首次出现远处转移的时间。通过影像学检查确定患者是否出现局部区域复发或远处转移。对于没有定期随访的患者,我们通过电话随访来获取信息。
1.4 统计学处理
运用Chi-square检验或Fisher’s精确检验方法对分类变量进行分析,用t检验对连续变量进行分析。对于ΔWBC%、ΔLYM%、ΔMONO%、ΔNEU%和ΔPLT%,将其中位细胞计数作为截断值,分为高、低两组。使用Kaplan-Meier和logrank分析方法来描绘生存曲线。采用Cox比例危险模型,确定与患者生存结局相关的影响因素。最后用LASSO回归和logistic回归模型来确定导致WBC减少的因素。P<0.10时的因素进入多因素分析。采用双侧检验,P<0.05为差异有统计学意义。所有数据分析都在SPSS 26.0和R 4.2.1软件中完成。使用的R软件包包括 “survival”、“survminer”和 “rms”。
2 结 果
2.1 患者的基线资料
共计423例局部晚期鼻咽癌患者被纳入,患者中位年龄为49岁(范围:14 ~ 70岁)。其中男性313例(74.0%),女性110例(26.0%);分期为Ⅲ期的患者占39.7%,ⅣA期占60.3%。ΔWBC%、ΔLYM%、ΔMONO%、ΔNEU%和ΔPLT%的中位数分别为25.5%、77.0%、28.5%、22.6%和17.0%。本研究患者队列的5年OS率为82.3%,5年LRFS率为80.2%,5年DMFS率为78.4%。对所有患者的中位随访时间为80.4个月(表1)。

表1 所有患者的特征Tab. 1 Characteristics of all patients
2.2 WBC计数百分比变化的预后价值
对OS的多因素分析中,年龄、ⅣA期(vsⅢ)、有诱导化疗、辅助化疗、ΔLYM%和ΔMONO%都与OS独立相关。对于LRFS、ⅣA期(vsⅢ期)、有诱导化疗和ΔLYM%是独立预后因素。DMFS的独立预后因素为ⅣA期、有诱导化疗、ΔLYM%和ΔMONO%(表2)。
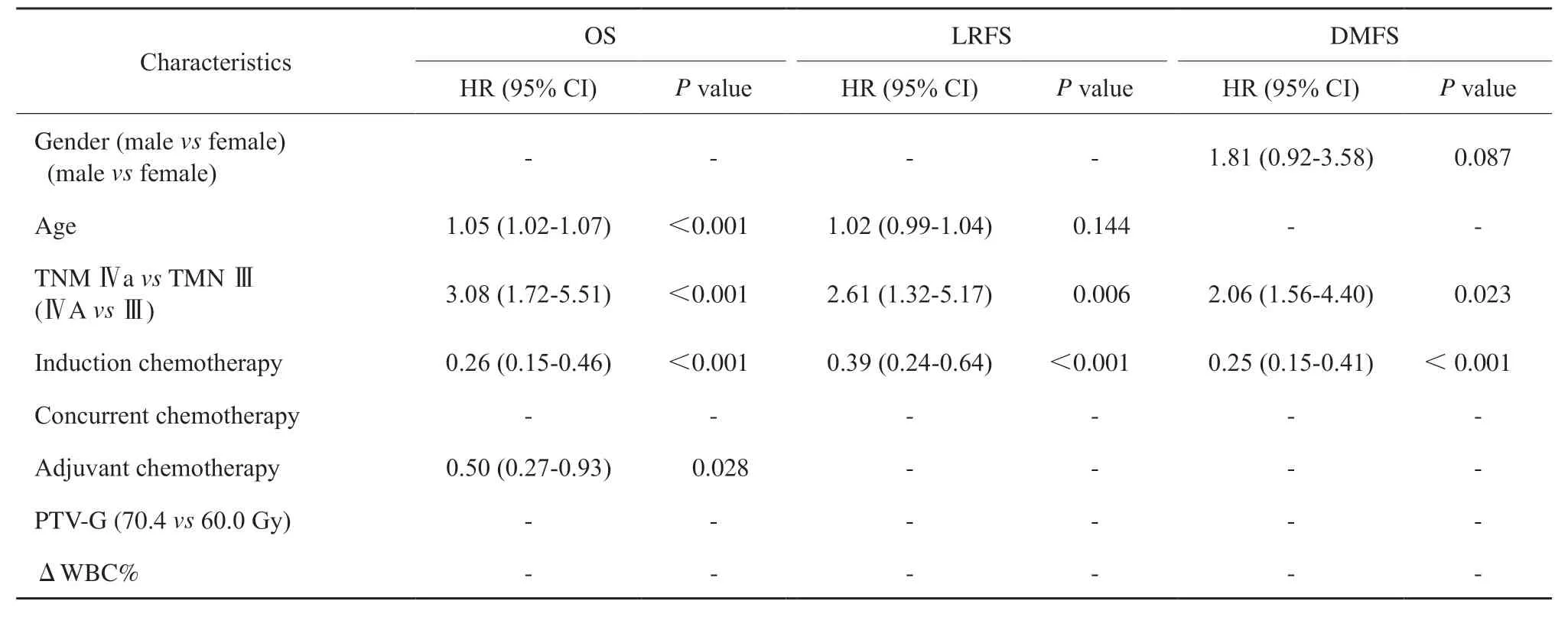
表2 对OS、LRFS和DMFS的多因素Cox回归分析Tab. 2 Multivariable Cox regression analyses for OS, LRFS, and DMFS
高、低ΔLYM%和ΔMONO%两组的Kaplan-Meier生存曲线结果显示,ΔLYM%(82.5%vs72.8%)和ΔMONO%(82.9%vs74.5%)组之间的5年OS率差异有统计学意义(P<0.05,图1)。低ΔLYM%组的LRFS(84.9%vs73.7%)和DMFS(85.3%vs71.4%)也比高ΔLYM%组的生存期更长。同样,低ΔMONO%组和高ΔMONO%组的DMFS率差异有统计学意义(83.9%vs72.1%,P<0.05)。然而,LRFS在高、低ΔMONO%组之间差异无统计学意义(78.2%vs76.5%,P>0.05)。

图1 高、低ΔLYM%和ΔMONO%组患者OS、LRFS和DMFS生存曲线的比较Fig. 1 Survival curves between high, low ΔLYM%, and ΔMONO% groups
2.3 ΔLYM%和ΔMONO%的预测因素
根据LASSO回归分析,16个身体剂量参数中筛选出9个与高ΔLYM%相关,分别是MBD、IBD、body V5、V15、V45、V55、V60、V65和V70;筛选出5个与高ΔMONO%相关,分别是MBD、IBD、body V5、V55和V70(图2)。将上述变量与其余临床变量一起纳入logistic回归分析,结果显示,多因素分析中,年龄(OR = 1.071,P<0.001)、IBD(OR = 1.004,P= 0.037)和body V60(OR = 1.046,P= 0.036)是ΔLYM%的独立预测因子;Ⅳa期(vsⅢ,OR = 0.512,P= 0.035),body V70(OR = 0.734,P= 0.022), V55(OR = 1.132,P= 0.009)是ΔMONO%的独立预测因子(表3、4)。
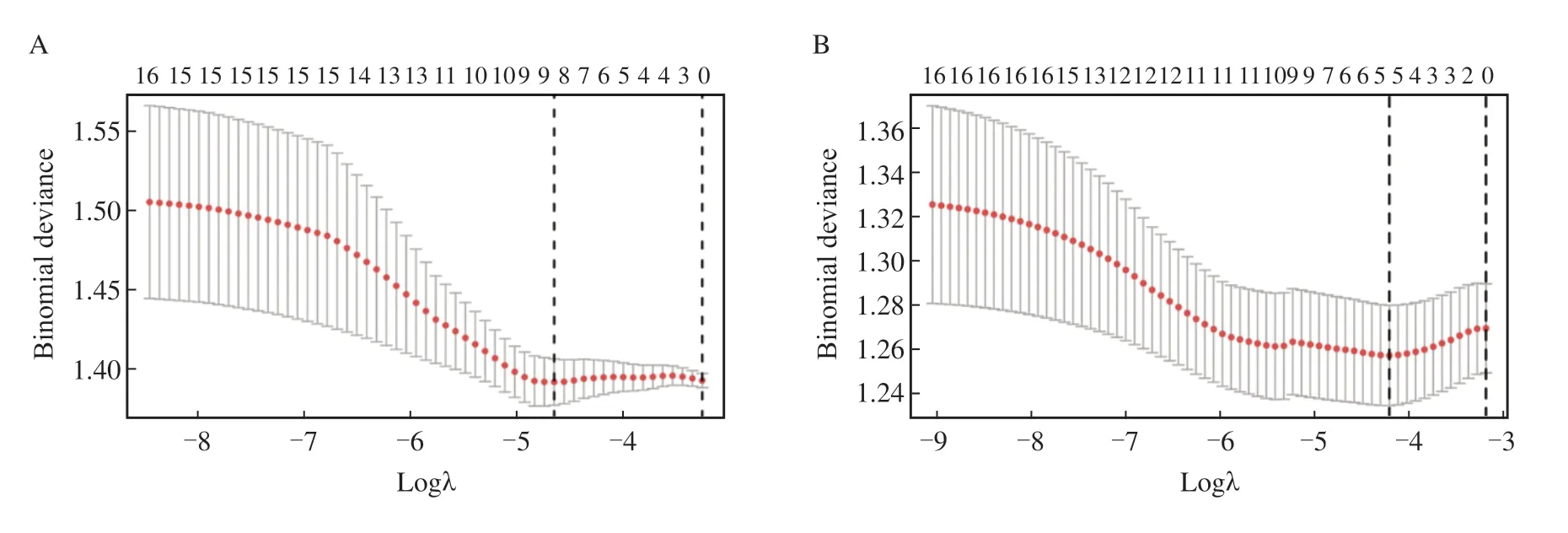
图2 将身体剂量参数对ΔLYM%和对ΔMONO%进行LASSO回归分析(10倍数交叉验证)Fig. 2 LASSO analysis for body dose parameters (10-fold cross validation) with ΔLYM% and ΔMONO%
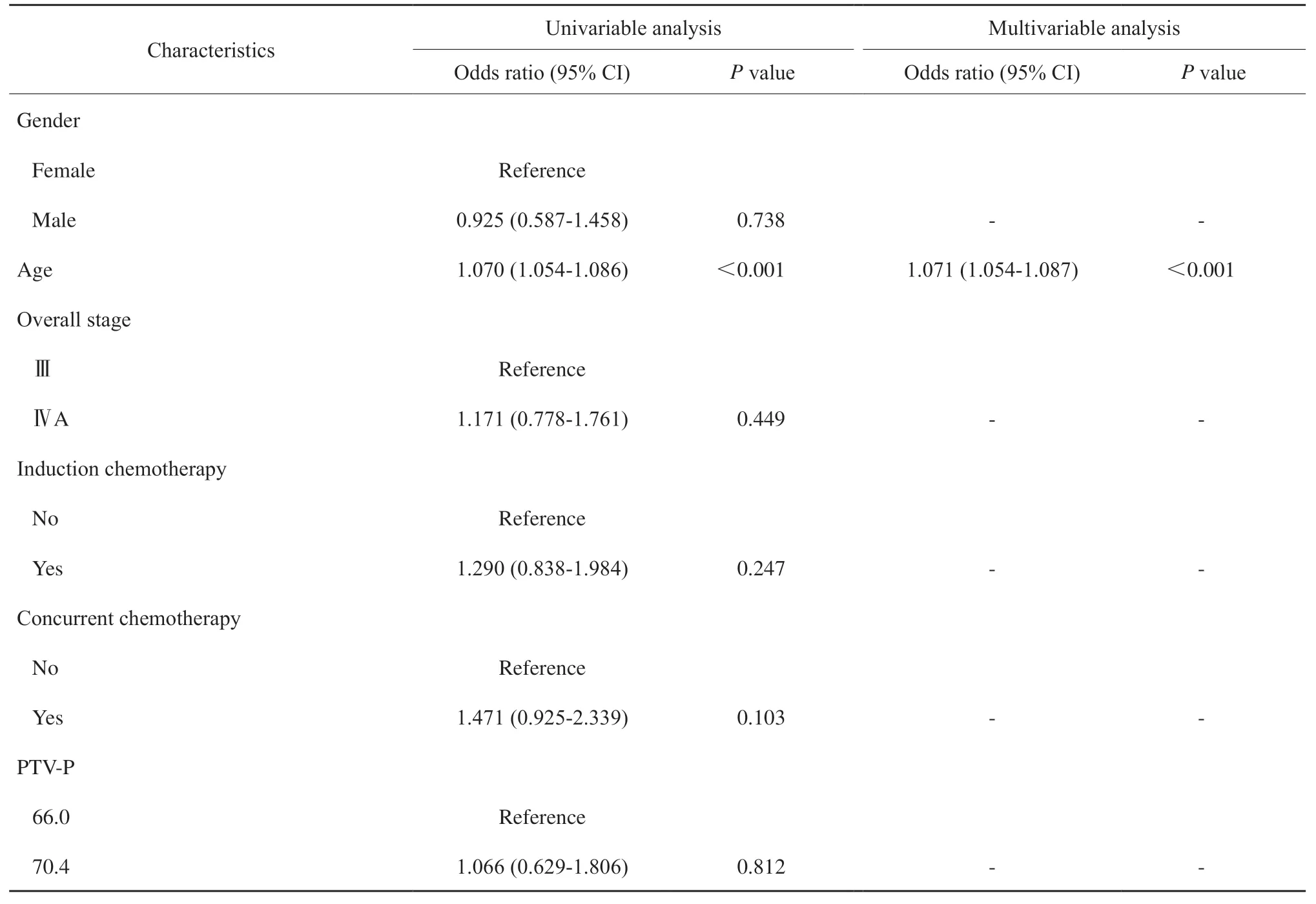
表3 ΔLYM%的logistic回归分析Tab. 3 Logistic regression analyses for percentage change in absolute lymphocyte count
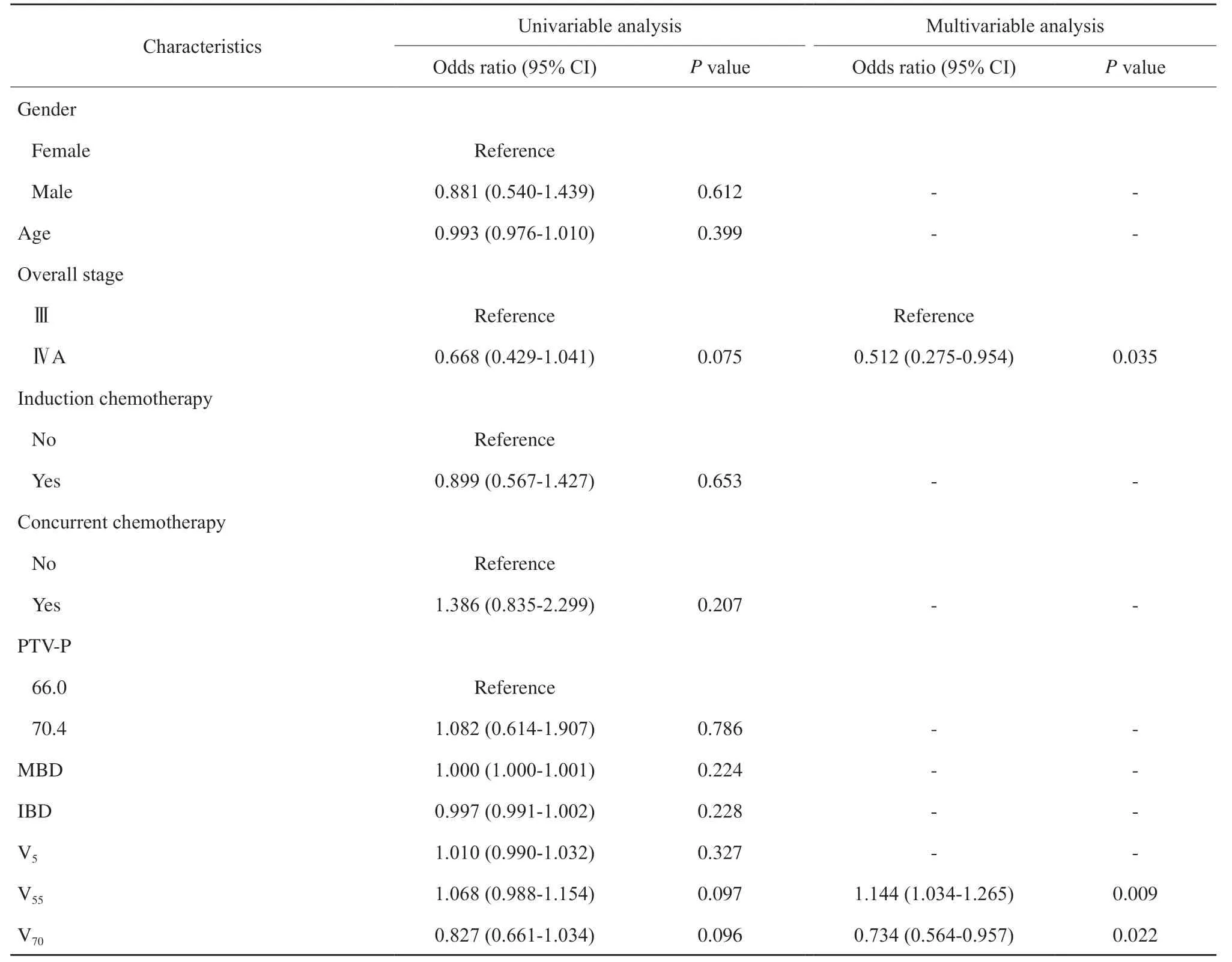
表4 ΔMONO%的logistic回归分析Tab. 4 Logistic regression analyses for percentage change in absolute lymphocyte count
3 讨 论
在该研究中,我们发现放疗期间LYM和MONO计数的百分比变化对患者生存结局具有预测意义,此外,还证实了我们提出的假设——身体剂量参数与LYM及MONO计数的减少有关。IBD和body V60是放疗期间LYM减少的两个不良预测因素;body V55和V70是MONO减少的不良预测因素。
身体辐射体积可用于估计循环血细胞的辐射暴露程度。一项研究表明,较高的身体辐照剂量与WBC、LYM、NEU、PLT计数的减低有关[10]。Mai等[11]验证了ΔLYM%和ΔMONO%对于接受同步放化疗的鼻咽癌患者的预后价值。我们的研究还纳入了仅接受放疗的患者,不过在多因素分析中,不同治疗方案对放疗期间LYM和MONO的影响并无统计学意义(表3、4)。诱导化疗对LYM减低的影响不明显,这与先前鼻咽恶性肿瘤及其他广泛研究的肿瘤得出的结论一致[12-13]。通常情况下,同期化疗会引起LYM计数波动。在我们的分析中,虽然同期化疗也是LYM减少的危险因素(OR = 1.471),但差异无统计学意义(P= 0.103)。可能原因是我们将LYM变化范围作为分类变量进行了分析,在放疗的基础上加入同期化疗,导致LYM下降程度未达到整体下降的中位数百分比。以往有证据表明,在放疗靶区是否涉及骨髓或淋巴组织、是否接受同期化疗等条件下,放疗都会无例外地导致明显的LYM减少[14-15]。在一项类似的研究[16]中,当LYM计数的最低值作为分类变量(G4级vsG3级LYM减低)时,同期化疗也无显著影响,而与放疗方式及LYM基线值密切相关。针对MONO,目前对于诱导化疗和同期化疗对其影响的研究较为有限。在结直肠癌合并肝转移患者中,已有研究[17]报道诱导化疗不会影响到肝内驻留的MONO;同样,在一项子宫颈癌的研究[18]中,同期化疗程数与MONO之间差异无统计学意义。在本研究中,logistic回归分析表明诱导化疗与同期化疗时MONO变化的差异没有统计学意义,这可能是因为本研究中的患者通常接受顺铂单药治疗2个周期,对比之下,放疗引起的血细胞变化更加突出。显然,关于放疗与MONO之间的关系还需要进一步探讨。
鼻咽癌的一个典型组织学特征是有大量的炎症细胞浸润。多项研究[6,19-20]结果表明,治疗前的中性粒细胞与淋巴细胞比值(neutrophil to lymphocyte ratio,NLR)、淋巴细胞与单核细胞比值(lymphocyte to monocyte ratio,LMR)、血小板与淋巴细胞比值(platelet to lymphocyte ratio,PLR)可作为衡量机体免疫力的指标,并影响疾病预后。有研究[21-23]结果表明,治疗期间LYM的数量减少对总生存期有不良影响。以往鼻咽癌的研究也表明基线LYM计数较高是一种预后保护性因素[22,24];而治疗期间LYM的最低值越低,则与较差的PFS和DMFS显著相关[21-22]。其中的机制可能是:治疗前LYM水平较高,代表T淋巴细胞更容易从外周血进入肿瘤中发挥作用,于是影响放疗的效果[25];而最低值越低,则代表机体免疫力受损越严重[26]。此外,血细胞的动态变化和功能状态也会受到辐射剂量的影响。有研究[16]发现与二维适形放疗(twodimensional conventional radiotherapy,2D-CRT)相比,IMRT对身体辐照的总剂量更高,因此更容易引起鼻咽癌患者的LYM减少。与此类似,在一项关于食管癌的研究中,与质子放疗相比,接受光子放疗的患者的身体辐照平均剂量更高,因此其LYM水平也更低[14]。对于MONO,一些研究[27-28]表明放射线照射后循环MONO的数量会下降,但也有其他研究发现辐射暴露引起MONO计数增加[29]。因此放射线对MONO影响的确切机制仍不完全清楚,可能涉及复杂的炎症反应,并取决于多种因素,包括放疗时间、辐照总剂量、身体辐照范围以及机体免疫反应。一项肺癌研究[13]显示身体辐照总剂量与治疗后LYM减少之间存在相关性。还有研究[30-31]表明,高剂量辐照区域与鼻咽癌患者的预后有关,进一步限制CTV的剂量与体积有助于减少晚期并发症。我们的结果与以往的剂量学研究结论是一致的:高剂量区域V60和V55与LYM减少相关。V60和V55分别大致对应高危临床靶体积(clinical target volume 1,CTV1)和低危临床靶体积(clinical target volume 2,CTV2),是富含淋巴结和淋巴管的区域,因此容易引起LYM和MONO数量的变化。
循环免疫细胞计数的波动在放疗期间很常见。我们认为相比于基线值和治疗期间的最低值,细胞计数的波动范围是更好的预测指标,因为它同时反映机体的免疫力和对辐射剂量的反应。基于身体辐照体积的剂量参数对LYM减少症发生概率的影响在各种恶性肿瘤中已被广泛探讨[12,32-34]。近期的一项系统综述提出,限制特定的剂量体积参数以维持机体的免疫功能可以与既定的放疗准则相结合[35]。在本研究中,我们首次证实了鼻咽癌治疗期间身体剂量参数与免疫细胞减少之间的关联。对IBD、V60和V55、V70进行适当限制可能有助于减轻鼻咽癌患者的LYM减少和MONO减少的程度,不过这一点仍需要前瞻性研究进行验证。
然而,我们的研究存在几点局限性:首先,这是一项单中心研究,可能会导致区域偏差。其次,由于有一定比例的患者在放疗结束后未进行定期的复查,因此我们没有记录分析免疫细胞计数在放疗结束后的变化,而放疗剂量对血液指标的影响可能会延续到放疗后3个月以上[36]。最后,由于鼻咽癌的解剖位置特殊复杂,我们没有对照射范围内特定器官进行勾画,未来对鼻咽癌的剂量学研究可以根据具体器官的辐照情况来进一步分析剂量的生物学效应。
总而言之,我们发现局部鼻咽癌患者在调强放疗期间,较高的身体剂量参数会导致免疫细胞的更大波动,其中LYM和MONO的动态下降是不良预后因素。因此,对相关参数进行限制,以优化IMRT治疗方案可以帮助鼻咽癌患者恢复免疫功能,进一步改善预后。
利益冲突声明:所有作者均声明不存在利益冲突。
