FBW7基因通过GSDME介导的焦亡增强紫杉醇对胰腺癌的抗肿瘤作用研究
2023-11-04贾聿明邓艳丽李胜超张志磊徐晓武
贾聿明,叶 增,邓艳丽,李胜超,张志磊,王 超,徐晓武,秦 毅#,彭 利#
1. 河北医科大学第四医院肝胆外科,河北 石家庄 050000;
2. 复旦大学附属肿瘤医院胰腺外科,复旦大学胰腺肿瘤研究所,复旦大学上海医学院肿瘤学系,上海 200032;
3. 河北医科大学第四医院检验科,河北 石家庄 050000
胰腺癌恶性程度极高,被称为“癌中之王”[1]。由于多数患者就诊时已处于晚期,从而失去了手术机会。对于这些患者,以化疗为主的全身治疗成为胰腺癌的重要治疗方法,但效果不佳。多数化疗药物通过诱导肿瘤细胞凋亡起到抗肿瘤作用,但是肿瘤耐药成为化疗效果欠佳乃至治疗失败的主要原因。
细胞的死亡方式有多种,包括凋亡、铁死亡、坏死、焦亡等,其中焦亡可能为肿瘤治疗带来新的突破[2-3]。焦亡是一种由焦孔素(gasdermin,GSDM)蛋白介导的程序性死亡方式,常伴有炎症和免疫反应[4]。GSDM蛋白家族包含GSDMD、GSDME等多种蛋白,GSDM蛋白家族是由C端和N端结构域相连,C端与N端的结合可以抑制其活性,当该蛋白被切割后,释放的N末端可以诱导质膜穿孔发生细胞焦亡[5]。在肿瘤细胞中,已有研究[6-9]证实,GSDME可以介导多种化疗药物以及免疫治疗引起的肿瘤细胞焦亡。研究[10]发现,GSDME是抗肿瘤药物诱导癌细胞发生焦亡或凋亡的“切换按钮”,即在GSDME高表达的肿瘤细胞中,化疗药物可诱导发生焦亡,否则只能发生凋亡。紫杉醇是治疗胰腺癌的常用药物,可以引起胰腺癌细胞的凋亡[11],已有研究[7]证实,紫杉醇可以引起GSDME介导的肺癌细胞的焦亡,在胰腺癌中,紫杉醇是否可以诱导焦亡尚需进一步研究。
FBW7基因是一种抑癌基因,该基因功能丧失会导致染色体不稳定和肿瘤发生[12]。FBW7通过促进原癌基因的降解可以促进癌细胞凋亡并抑制增殖[12]。研究[13]发现,FBW7可以通过铁死亡方式增强胰腺癌的化疗效果。
本研究旨在探索FBW7基因对胰腺癌焦亡的影响及其机制,旨在为胰腺癌的综合治疗提供新的思路。
1 材料和方法
1.1 细胞和实验试剂
人胰腺癌细胞系PANC-1获自美国典型培养物保藏中心(American Type Culture Collection,ATCC),并于2015年通过DNA指纹鉴定,并在收到后6个月内在本实验室传代。DMEM培养基、10%胎牛血清、胰蛋白酶、青-链霉素和磷酸盐缓冲生理盐水(phosphate-buffered saline,PBS)均购自美国Gibco公司,紫杉醇(A601183-0100)购自生工生物工程(上海)有限公司,细胞计数试剂盒-8(cell counting kit-8,CCK-8)购自日本同仁化学研究所,APC膜联蛋白Ⅴ试剂盒购自上海碧云天生物技术有限公司,CytoTox 96 NonRadioactive细胞毒性检测试剂盒购自美国Promega公司,LipofectamineTM3000和TRIzol试剂购自美国Invitrogen公司,反转录试剂盒和实时荧光定量聚合酶链式反应(real-time fluorescent quantitative polymerase chain reaction,RTFQ-PCR)试剂盒购自日本TaKaRa公司,二辛可宁酸(bicinchoninic acid,BCA)蛋白定量试剂盒购自上海雅酶生物科技有限公司,FBW7抗体购自美国Proteintech公司,GSDME抗体购自英国Abcam公司,β-actin、caspase-3、活化的caspase-3(active-caspase-3)抗体及辣根过氧化物标记二抗购自美国Abclonal公司,乳酸脱氢酶(lactate dehydrogenase,LDH)检测试剂盒购自生工生物工程(上海)有限公司。
1.2 临床标本
收集2017—2021年于复旦大学附属肿瘤医院行手术切除或活检的30例胰腺癌患者的癌组织(由复旦大学附属肿瘤医院组织库保存),其中男性17例,女性13例,年龄44 ~ 83岁。所有患者术前均未接受化疗、放疗或免疫治疗。
1.3 实验方法
1.3.1 细胞培养与转染
采用含10%胎牛血清、青-链霉素的DMEM高糖培养基,将细胞置于37 ℃、CO2体积分数为5%的培养箱中培养。待细胞贴壁生长融合度达80%时,加入胰蛋白酶消化并传代。取对数生长期的PANC-1细胞,消化后接种于6孔板中培养过夜,加入过表达FBW7WT和FBW7T205A慢病毒载体pCDH-CMV-MCS-EF1-puro及其对照病毒(LVNC)转染细胞,并用嘌呤霉素筛选1周,构建稳定转染细胞株。同时,将转染对照病毒的细胞设置空载体(empty vector,EV)组。
1.3.2 RTFQ-PCR检测
采用TRIzol试剂提取总RNA。使用TaKaRa P r i m e S c r i p t 反转录试剂盒通过逆转录获得cDNA。RTFQ-PCR由ABI 7900HT RTFQ-PCR系统进行。使用引物:FBW7基因有义链为5’-CCACTGGGCTTGTACCATGTT-3’,反义链为5’-CAGATGTAATTCGGCGTCGTT-3’;GSDME基因有义链为5’-GATCTCTGAGCAC ATGCAGGTC-3’,反义链为5’-GTTGGAGTCC TTGGTGACATTCC-3’;β-actin基因有义链为5’-CTACGTCGCCCTGGACTTCGAGC-3’,反义链为5’-GATGGAGCCGCCGATCCACACGG-3’。
1.3.3 CCK-8实验
将处于对数生长期的细胞按照1h 103个/孔的密度接种于96孔板,加入100 μL含有不同浓度的紫杉醇的培养基分别培养24 h后加入10 μL CCK-8试剂,置于细胞培养箱中避光温育2 h,检测450 nm波长处各孔的吸光度(D)值。实验重复3 次。
1.3.4 免疫组织化学检测
收集组织标本,常规采用4%甲醛溶液固定,经脱水、浸蜡包埋、切片后使用山羊血清温育30 min封闭,4 ℃温育一抗过夜。次日用PBS清洗3次,室温温育二抗30 min,PBS清洗3次。滴加辣根过氧化物酶溶液,室温温育30 min,PBS清洗3次,滴加DAB显色液,当显微镜下可见染色区域发黄即可使用蒸馏水冲洗,苏木精复染1 min。使用梯度乙醇进行脱水处理,二甲苯浸泡,最后滴加中性树胶,盖玻片封片,显微镜下观察并拍照。通过染色强度和阳性细胞比例进行免疫组织化学评分。染色强度评分标准为0分(阴性)、1分(弱阳性)、2分(中等强度)、3分(强阳性)。阳性细胞比例的评分标准为0分(<5%)、1分(5% ~ 25%)、2分(26% ~ 50%)、3分(51% ~ 75%)、4分(> 75%)。将染色强度评分与阳性细胞比例评分相乘计算总分。
1.3.5 流式细胞术
采用APC膜联蛋白Ⅴ试剂盒检测细胞死亡。经含或不含紫杉醇处理48 h后,收集细胞,并在室温下与膜联蛋白Ⅴ和PI一起在黑暗中温育15 min。染色后,将300 μL 1h 结合缓冲液添加到每个样品中,并立即采用流式细胞术分析细胞(BD Biosciences,CA,USA)。
1.3.6 LDH释放实验
采用CytoTox 96 NonRadioactive细胞毒性检测试剂盒测量LDH释放。将50 mL 9%(重量/体积)的Triton®X-100溶液添加到细胞中并在室温下温育30 min,进而测量总LDH裂解。之后在450 nm处测量D值。
1.3.7 显微镜成像
将细胞在6孔板中处理。使用Olympus Ⅸ71显微镜捕获静态明场图像,检查焦亡细胞的形 态。
1.3.8 蛋白质印迹法(Western blot)检测
收集各组细胞,提取总蛋白,用B C A试剂盒测定蛋白浓度,取5 0 μ g 蛋白进行1 0%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecylsulphate polyacrylamide gel electrophoresis,SDS-PAGE)分离,将分离的蛋白电转移至聚偏二氟乙烯膜上。用5%脱脂奶粉封闭2 h,采用吐温-20三羟甲基氨基甲烷缓冲生理盐水(tris-buffered saline Tween,TBST)洗膜3次,每次10 min,加入稀释的FBW7、GSDME、caspase-3、active-caspase-3或β-actin一抗,4 ℃温育过夜。TBST洗膜3次,加入辣根过氧化物酶偶联二抗,室温温育2 h,TBST洗膜3次,用ECL化学发光试剂显色。
1.3.9 统计学处理
采用SPSS 26.0进行统计学处理,计量资料以表示,正态分布的两组计量资料比较采用独立样本t检验,等级资料相关性分析采用spearman相关分析。P<0.05为差异有统计学意义。
2 结 果
2.1 RTFQ-PCR和Western blot检测FBW7过表达胰腺癌细胞株中GSDME的表达
RTFQ-PCR结果显示,转染野生型FBW7WT和磷酸缺陷FBW7T205A基因的PANC-1细胞的FBW7 mRNA水平较EV组PANC-1细胞明显升高(图1A)。Western blot结果显示,转染FBW7WT和FBW7T205A基因的PANC-1细胞的FBW7蛋白水平较NC组PANC-1细胞明显升高(图1B、C),说明过表达FBW7基因的稳定转染株构建成功。RTFQ-PCR和Western blot检测结果还显示,过表达FBW7基因的PANC-1细胞中GSDME的mRNA和蛋白水平均升高(图1D、E、F),表明FBW7基因过表达上调了GSDME的表达。
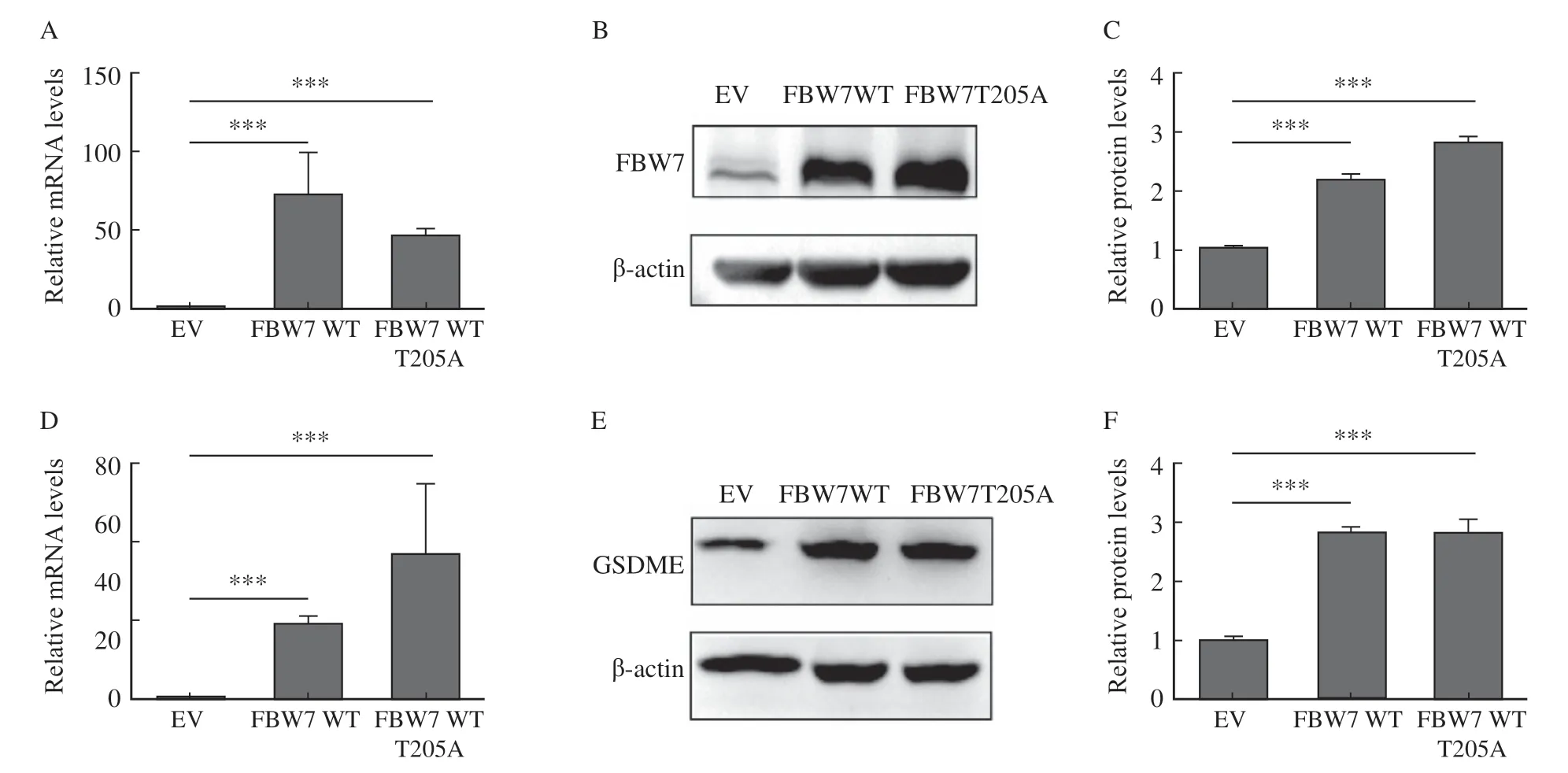
图1 FBW7基因过表达可以上调GSDME表达Fig. 1 Overexpression of FBW7 gene up-regulates GSDME expression
2.2 免疫组化检测FBW7和GSDME表达的相关性
本研究随机选择复旦大学附属肿瘤医院组织库中保存的曾在本院诊治为胰腺癌且经手术切除的30例胰腺癌患者的肿瘤组织,探讨患者组织中FBW7和GSDME表达之间的关系。在石蜡包埋的组织中用FBW7和GSDME抗体进行了免疫组织化学染色。通过比例分数和强度分数相乘计算FBW7和GSDME的免疫组织化学评分。对FBW7与GSDME之间相关性进行的统计学分析结果显示,胰腺癌患者的FBW7与GSDME基因表达呈正相关(图2A)。FBW7和GSDME表达情况的两个典型示例见图2B。

图2 FBW7与GSDME基因表达在患者肿瘤组织中呈正相关Fig. 2 The expression of FBW7 and GSDME genes was positively correlated in tumor tissues of patients
2.3 胰腺癌细胞对紫杉醇的敏感性
焦亡细胞表现为细胞肿胀的特征,细胞膜上出现大气泡[9],该形态不同于经典的凋亡细胞形态。本研究采用0.5 μmol/L紫杉醇处理后,光镜下观察细胞形态。镜下可见PANC-1细胞发生了符合焦亡形态的变化,而在FBW7基因过表达的细胞系中,发生这些形态变化的细胞的数量要显著多于EV组(图3A)。

图3 FBW基因过表达增强了PANC-1细胞对紫杉醇化疗的敏感性Fig. 3 FBW gene overexpression enhances the sensitivity of PANC-1 cells to paclitaxel chemotherapy
本研究采用膜联蛋白Ⅴ-FITC/碘化丙啶(propidium iodide,PI)凋亡检测试剂盒检测细胞的死亡情况。经紫杉醇处理后,可观测到大量的膜联蛋白Ⅴ-FITC/PI双阳性细胞,而且在FBW7过表达的细胞系中,膜联蛋白Ⅴ-FITC/PI双阳性细胞比EV组细胞更高(图3B、C)。LDH释放实验可以反映细胞损伤的情况,细胞损伤时,LDH会被释放出来。本研究检测了细胞上清液中的LDH含量,紫杉醇药物处理过的PANC-1细胞上清液中LDH明显上升,且FBW7过表达明显促进了这一情况的发生(图3D)。CCK-8实验结果发现,FBW7过表达的细胞系,经过24 h不同浓度的紫杉醇处理后,细胞活力低于EV组细胞(图3E)。上述结果表明,紫杉醇可以引起胰腺癌细胞系PANC-1的死亡,而FBW7基因过表达显著增强了细胞对紫杉醇处理的敏感性。
2.4 Western blot检测紫杉醇处理后胰腺癌细胞中caspase-3和GSDME蛋白的表达
GSDME可以被active-caspase-3切割,所产生的GSDME-N结构域具有使细胞膜成孔活性,从而诱导细胞焦亡[9]。此前的研究[9]已证实FBW7过表达可以增加GSDME在PANC-1细胞中的表达,同时也增加了细胞对紫杉醇药物刺激的敏感性。为了进一步探讨FBW7过表达细胞对紫杉醇敏感性的影响是否由GSDME表达增加和细胞焦亡水平增加所引起,本研究采用紫杉醇处理PANC-1细胞及其FBW7过表达细胞株,对蛋白质成分进行Western blot检测。结果显示,FBW7过表达并未显著上调caspase-3的表达,但是促使其活化,未经紫杉醇处理的细胞active-caspase-3和GSDME的N端结构域Western blot信号很弱或几乎检测不到,但经紫杉醇药物处理后可见caspase-3活化,并且GSDME被切割,即GSDME的N端结构域表达,且FBW7过表达的细胞株的caspase-3以及GSDME的活化更加明显(图4A、B、C)。表明FBW7过表达增强了caspase-3/GSDME信号转导通路的活性,从而促进了细胞焦亡的发生。

图4 FBW7基因通过caspase-3/GSDME信号转导通路增加PANC-1细胞对紫杉醇的敏感性Fig. 4 The FBW7 gene increases the sensitivity of PANC-1 cells to paclitaxel through the caspase-3/GSDME pathway
3 讨 论
紫杉醇是常用的化疗药物,可以诱导细胞周期停滞和细胞凋亡,从而发挥抗肿瘤作用[14]。本研究发现了紫杉醇诱导胰腺癌死亡的机制——焦亡。
细胞焦亡是一种细胞程序性死亡,不同于细胞凋亡,焦亡是由GSDM家族蛋白介导的一种炎症性死亡方式。近年来对焦亡的研究主要集中在两条焦亡分子信号转导通路。① GSDMD蛋白介导的,主要是由各种炎症体介导的经典模式或脂多糖LPS诱导的caspase-1、caspase-4、caspase-5、caspase-11切割GSDMD引起的非经典模式[15-16]。② GSDME介导的细胞焦亡。在化疗药物作用下,可以引起线粒体损伤释放细胞色素C,进而激活caspase-9、caspase-3,当肿瘤细胞中GSDME高表达时,下游的GSDME被活性caspase-3切割产生GSDME的N端结构域,GSDME也可被颗粒酶B直接切割。与GSDMDNT相似,GSDME-NT也具有质膜穿孔活性,可以诱导焦亡[10](图5)。
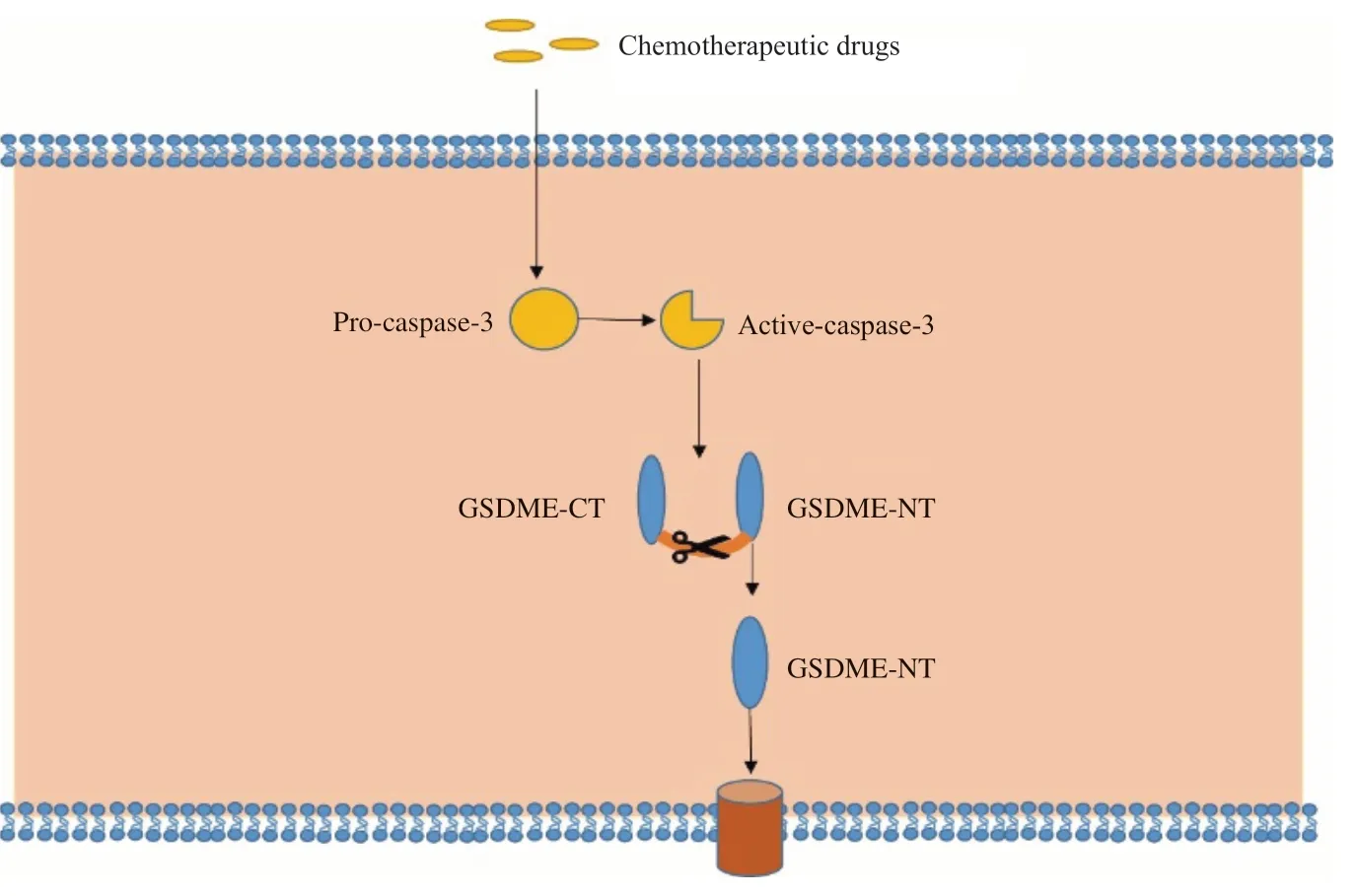
图5 Caspase-3/GSDME分子信号转导通路示意图Fig. 5 Schematic diagram of caspase-3/GSDME signal transduction pathway
很多化疗药物可引起肿瘤细胞焦亡,本研究证实了紫杉醇具备诱导PANC-1细胞焦亡的能力。
本研究发现,紫杉醇处理后,肿瘤细胞呈现焦亡的典型表现,即细胞膜出现的大泡结构。本研究采用Western blot对caspase-3和GSDME的蛋白水平进行了检测,结果发现,紫杉醇处理后,肿瘤细胞中出现了caspase-3和GSDME的切割活化,说明caspas-3/GSDME信号转导通路参与了PANC-1细胞的焦亡过程。Caspase-3是一种与凋亡相关的蛋白,以往认为其活化与细胞凋亡相关,然而在多种肿瘤中都已发现其活化切割GSDME蛋白诱导焦亡的现象。本研究结果与文献[6,9-10]报道结果相似。
Caspase-3也许可以诱导肿瘤细胞的焦亡并受GSDME表达情况影响。Wang等[17]发现,GSDME是化疗药物诱导癌细胞发生凋亡还是焦亡的必要条件,应用化疗药物时,只有在GSDME高表达时才能发生焦亡,而低表达时发生凋亡。
GSDME在大多数肿瘤细胞中低表达,原因是其启动子的超甲基化导致基因沉默[18-19]。所以在多数肿瘤细胞中,化疗药物可能并不能通过GSDME的信号转导通路诱导细胞发生焦亡,而提高GSDME的表达是促进细胞发生焦亡的关键。有研究[19]证实,地西他滨(一种DNA甲基转移酶抑制剂)可以提高GSDME的表达,从而可以通过增强化疗引起视网膜母细胞瘤的焦亡水平而提高其疗效。本研究结果证实了GSDME的表达与FBW7基因之间的关系。在PANC-1细胞中,GSDME的表达和FBW7的表达呈正相关,这反映出GSDME的表达受FBW7的正向调控,但是FBW7基因如何调节GSDME的表达仍需要进一步研究。当FBW7表达上调时,GSDME的表达也相应升高。GSDME的表达水平升高为紫杉醇诱导PANC-1细胞焦亡创造了条件,这是FBW7基因过表达的PANC-1细胞对紫杉醇敏感性增加的分子基础。
FBW7基因促使GSDME表达上调,使肿瘤细胞在化疗药物的作用下发生更高水平的焦亡。本研究结果表明,FBW7基因过表达的PANC-1细胞株使化疗药物的敏感性提高表现在IC50的下降、流式细胞术检测发现死亡细胞的比例增加、光镜下具有焦亡形态的细胞增加等。GSDME基因被认为是抑癌基因,其表达与肿瘤恶性程度及患者预后呈负相关[20]。FBW7基因可以增强化疗药物对肿瘤的敏感性已经得到证实,既往研究[13,21]主要集中在其通过促进肿瘤细胞凋亡和铁死亡等形式。本研究发现FBW7基因通过增加caspase-3激活和上调GSDME的表达增强细胞焦亡,从而增加化疗敏感性,这可能成为抗肿瘤的潜在靶点。
细胞焦亡的意义不仅在于增加化疗药物对肿瘤细胞的杀伤作用。焦亡作为一种炎性的细胞死亡方式,肿瘤细胞膜被破坏,使细胞因子和内容物释放,造成的炎性环境可增加肿瘤微环境中免疫细胞的募集并激活抗肿瘤免疫反应[22]。从多种意义上来说,肿瘤细胞焦亡可能对抗肿瘤的治疗产生重要的影响。
利益冲突声明:所有作者均声明不存在利益冲突。
