COVID-19感染后手术时机与乳腺癌术后血栓并发症风险分析
2023-11-04程纬浩王微丽张朝蓬赵家贤邱鹏飞王永胜
程纬浩,王微丽,毕 钊,张朝蓬,孙 晓,赵家贤,邱鹏飞,陈 鹏,王永胜
山东省肿瘤防治研究院(山东省肿瘤医院)乳腺病中心,山东第一医科大学(山东省医学科学院),山东 济南 250117
自2023年1月8日起,由严重急性呼吸综合征冠状病毒2型(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)引起的2019冠状病毒病(coronavirus disease 2019,COVID-19)从“乙类甲管”调整为“乙类乙管”。在SARSCoV-2活动性感染期间,许多患者出现肺炎、呼吸衰竭、心律失常、肺栓塞(pulmonary embolism,PE)和深静脉血栓形成(deep vein thrombosis,DVT)等并发症[1-10]。癌症患者可能比非癌症患者更容易感染病原体,因为恶性肿瘤和抗肿瘤治疗(包括化疗或手术)可能会使患者全身免疫状态受到影响[11-12]。2020年,乳腺癌约占所有女性癌症病例的24.5%,占癌症死亡的15.5%,在全球大多数国家,乳腺癌的发病率和死亡率均居首位[13]。因此感染SARS-CoV-2的乳腺癌患者数量也是巨大的。COVID-19流行期间,乳腺癌手术时机有所延迟。随着COVID-19疫情逐渐稳定,COVID-19感染患者的术前评估、手术时机选择、术后并发症预防等成为目前医患双方共同关注的焦点问题。
自COVID-19全球流行以来,已有多项临床研究聚焦于感染对患者术后并发症及死亡率的影响。COVID Surg协作组与Global Surg协作组的全球多中心研究发现,术前确诊SARS-CoV-2感染患者,在感染后7周内接受手术,术后30 d死亡率为3.6% ~ 4.1%,感染7周后接受手术,术后30 d死亡率降为1.5%,与未感染者基本持平[12]。多中心研究[14]发现,SARS-CoV-2感染患者在感染后4周内接受手术,肺炎、呼吸衰竭、PE、DVT、脓毒症等术后并发症发生风险显著升高;患者在感染后4 ~ 8周接受手术,上述并发症发生率开始下降;患者感染8周后接受手术,上述并发症发生率逐渐降至基线水平。术后DVT是血液在深静脉内不正常凝结引起的静脉回流障碍性疾病,主要不良事件是PE和血栓形成后综合征(post thrombotic syndrome,PTS),可以显著影响患者的生活质量,甚至导致患者死亡。癌症患者发生DVT的风险较非癌症患者高,目前乳腺癌术后DVT可接受发生率并未形成国内和国际共识,从多项研究中得知乳腺癌术后DVT发生率为2.00% ~ 6.40%[15-17]。
先前研究入组的患者包含多种手术方式,但手术方式的不同可能会影响患者的术后并发症的发生。与其他类型手术方式相比,乳腺癌术后并发症可能有所不同。因此需要对COVID-19感染患者进行个体化的术前评估,综合考虑不同因素的影响,选择最佳手术时机。本研究旨在评估COVID-19感染相关的手术时机与乳腺癌患者术后DVT风险之间的关系。
1 资料和方法
1.1 研究人群
本研究纳入在山东省肿瘤医院乳腺病中心2022年12月20日—2023年3月20日确诊为COVID-19感染症状体征转阴的317例乳腺癌患者。研究队列中的COVID-19诊断日期(即患者被确认患有COVID-19的日期)定义为患者进行第一次COVID-19反转录聚合酶链反应检测结果为阳性或抗原检测阳性的日期。COVID-19的严重程度分为无症状感染、轻症和重症(出现肺炎症状)。同时本研究选择2019年5月1日—2019年9月30日接受手术的329例乳腺癌患者为对照组,这部分患者接受乳腺癌手术前未感染COVID-19。
本次研究按当前术式代码对患者进行分类,术式涵盖了目前乳腺癌的主要择期手术(包括乳腺癌改良根治术、乳腺癌保乳根治术、乳腺癌假体重建术)。排除标准包括术前接受治疗或未接受上述任何一项手术的乳腺癌患者。
1.2 COVID-19感染相关的手术时机
根据手术时间与COVID-19诊断日期的关系,患者被分为6组。“围COVID-19感染期”组定义为在COVID-19诊断日期后0 ~ 2周进行手术。这些是围手术期感染COVID-19的患者。“COVID-19感染1组”为COVID-19诊断日期后3 ~ 4周内接受手术的患者。“COVID-19感染2组”定义为COVID-19诊断日期后5 ~ 6周内接受手术的患者。“COVID-19感染3组”定义为COVID-19诊断日期后7 ~ 8周内接受手术的患者。“COVID-19感染后期组”定义为COVID-19诊断后8周或更长的时间内进行手术的患者。研究选择2019年5月1日—2019年10月1日接受手术的患者作为对照组,这部分患者术前没有感染过COVID-19,术后30天出现的任何并发症都不能归因于COVID-19感染的后遗症,将此组患者定义为COVID-19未感染组。
1.3 并发症与伴发疾病
本研究的主要研究终点为术后DVT。DVT诊断标准为患者出现肢体疼痛症状且血管超声查见栓子形成。伴发疾病包括:糖尿病、高血压、慢性阻塞性肺疾病、胃食管反流病、肥胖、冠状动脉疾病、充血性心力衰竭、慢性肾病、溃疡性结肠炎、克罗恩病、轻度肝病、重度肝病、中风史、抑郁症。
1.4 统计学处理
分类变量采用Pearson卡方检验,连续变量采用t检验或Wilcoxon秩和检验,评估患者特征和未调整结果。多变量logistic回归模型用于评估发生术后DVT的风险大小,调整先验协变量年龄、肿瘤分期(T、N)、术式(乳腺癌改良根治术、乳腺癌保乳根治术、乳腺癌假体重建术)、手术间隔时间、伴发病确定为临床相关。P<0.05为差异有统计学意义。使用SPSS 22.0软件和R version 3.3.3软件进行统计学分析。
2 结 果
本研究共入组6 4 6 例乳腺癌患者,其中COVID-19未感染组患者共329例,“围COVID-19感染期”、“COVID-19感染1组”、“COVID-19感染2组”和“COVID-19感染3组”患者分别为17例(5.36%)、29例(9.15%)、31例(9.78%)和50例(15.78%)。“COVID-19感染后期组”患者共190例(59.90%)。患者临床病理学特征见表1。
入组646例乳腺癌患者中位年龄为49岁,COVID-19未感染组、“围COVID-19感染期”组、“COVID-19感染1组”、“COVID-19感染2组”、“COVID-19感染3组”、“COVID-19感染后期组”中位年龄分别为49、49、49、45、44和50岁。COVID-19感染患者中,98.74%的患者为无症状或轻症COVID-19感染,仅有1.26%的患者为重症COVID-19感染(出现肺炎症状)。95.27%的患者体温低于39 ℃,4.73%的患者体温高于39 ℃。在所有组中,最常见的伴发综合征是肝病、糖尿病和高血压。无论是否有COVID-19感染,最常用的手术方式都是乳房切除术。
不同分组间术后D V T 并发症结果见表2。DVT类型均为肌间静脉血栓。与未感染COVID-19的患者相比,感染COVID-19患者术后DVT发生率更高(1.21%vs3.15%)。在COVID-19感染8周后手术患者DVT发生率(1.58%)与未感染COVID-19患者相似。感染8周内手术患者术后DVT发生率为5.51%;围手术期COVID-19感染患者的DVT发生率最高(11.76%),COVID-19感染后3~8周术后DVT发生率为4.55%,感染3周后手术患者术后DVT发生率为2.67%。
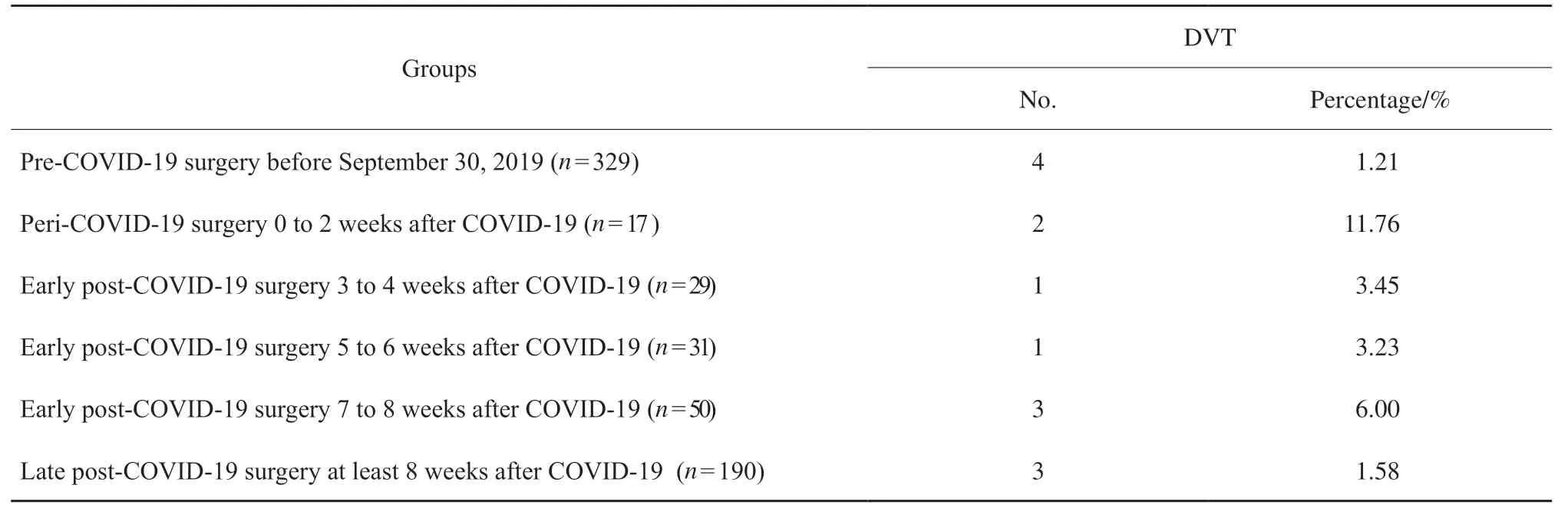
表2 乳腺癌患者术后血栓并发症分析Tab. 2 Analysis of postoperative thrombus complications in breast cancer patients
术后DVT影响因素分析结果见表3、4。
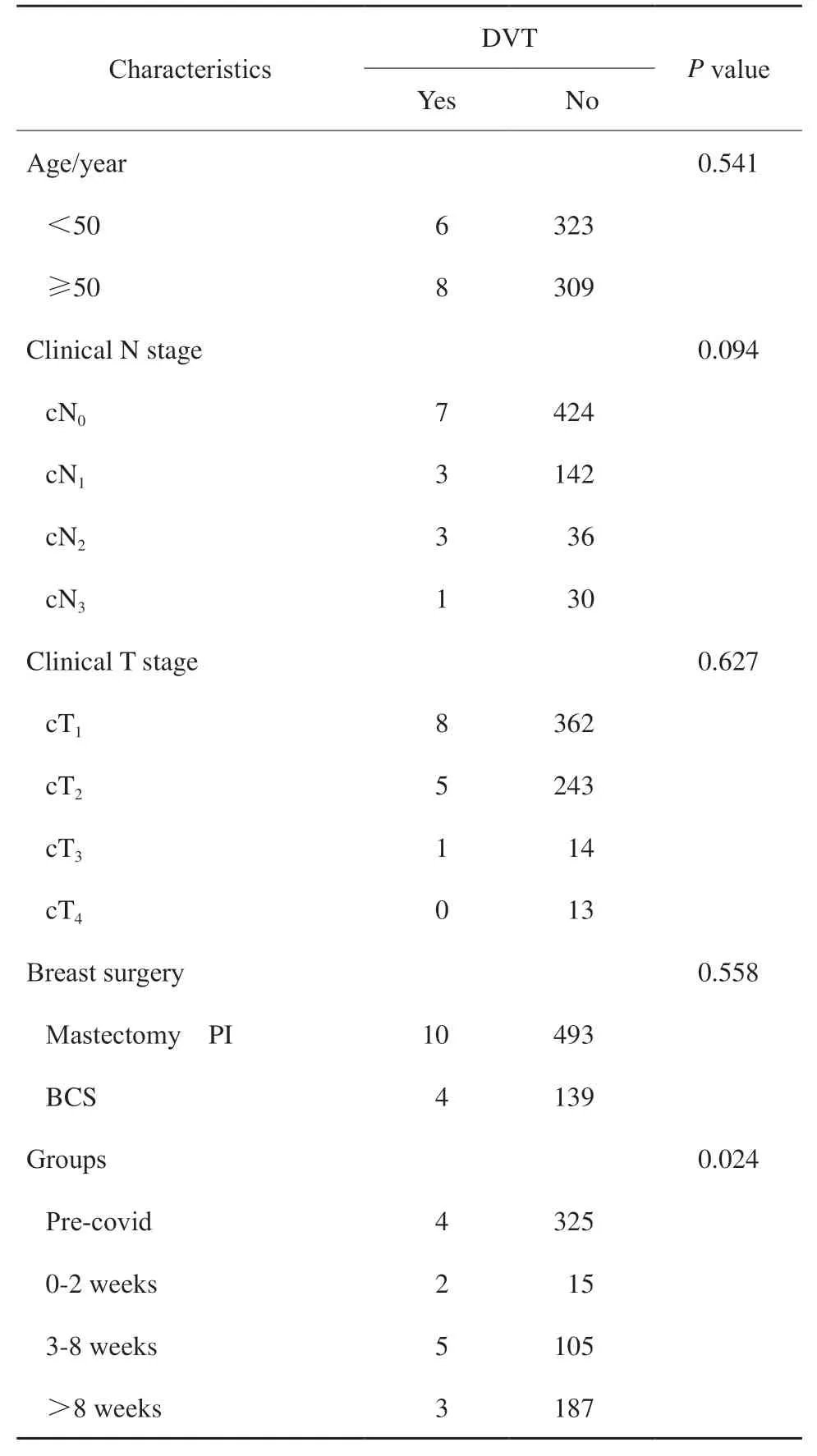
表3 术后血栓并发症单因素分析Tab. 3 The univariate analysis of postoperative DVT

表4 术后血栓并发症多因素logistic分析Tab. 4 The multivariable logistic regression analysis of postoperative DVT
单因素分析结果显示,围COVID-19感染期患者术后DVT发生率显著高于其他组患者。根据患者特征进行调整,排除年龄、肿瘤分期、术式、伴发病等混杂因素,多因素分析结果显示,COVID-19感染间隔时间是DVT惟一的独立预测因素(OR = 2.795;95% CI:0.692 ~ 11.278,P= 0.024)。根据患者特征进行调整后,与未感染COVID-19的329例患者相比,COVID-19感染患者8周内手术DVT发生风险显著高于COVID-19感染8周后的患者(OR = 11.270;95%CI:1.363 ~ 16.480,P= 0.024),COVID-19感染2周内手术患者术后DVT发生风险最高(OR = 10.556;95% CI:1.095 ~ 303.313,P= 0.030),COVID-19感染3 ~ 8周手术患者术后DVT差异有统计学意义(OR = 4.551;95% CI:1.020 ~ 14.674,P= 0.048)。COVID-19感染8周后患者术后DVT的风险与未感染COVID-19患者类似。
2022年12月20日—2023年3月20共10例乳腺癌术后DVT患者纳入随访,随访期5 ~ 7个月(平均6个月),10例患者采用抬高患肢、溶栓治疗及常规抗凝方法进行治疗,经低分子肝素及华法林持续治疗 7 d 后均痊愈,无肺栓塞等严重并发症,经对症处理后未影响后续辅助抗肿瘤治疗的进行。
3 讨 论
本研究评估了646例乳腺癌患者COVID-19感染与手术间隔时间对术后DVT发生风险的影响。围COVID-19感染患者接受手术后DVT风险显著增加,在COVID-19感染后3 ~ 8周进行手术仍存在较高的DVT风险。感染8周后接受手术患者,术后DVT与未感染COVID-19患者类似。
值得注意的是,本研究中的绝大多数患者为轻度COVID-19和Omicron变异株感染。目前认为Omicron变异株相比于Delta变异株具有复制优势,其能够更大程度地逃避由感染和疫苗诱导的体液免疫,同时所致感染的严重程度似乎要低于其他变异株[18]。但是目前没有证据表明Omicron变异株和Delta变异株感染患者术后并发症存在差异。
COVID-19感染患者术后并发症是疫情发生以来全球外科学界普遍关注的焦点。近年多来,多项研究在这一领域进行探索。COVID-19感染后相关手术时机与术后并发症之间的研究[14]显示,COVID-19感染后0 ~ 4周的重大择期手术与术后并发症的风险增加有关,COVID-19感染4 ~ 8周进行手术仍与术后肺炎风险增加有关,但在COVID-19诊断后8周进行手术与并发症增加无关。然而,来自印度的单中心研究却得出了不同的结论,研究[19]发现,COVID-19感染7周内进行手术与术后并发症发生率无相关性,该研究认为,在轻度至中度COVID-19感染患者中,癌症择期手术甚至可以在7周内安全进行。该研究的时间段是2020年5月—2021年11月,比上述研究稍晚,感染病毒株可能有差别。上述研究均入组多种手术方式,本研究聚焦于乳腺癌单病种,旨在为乳腺癌患者提供治疗建议,本研究结果显示,与未感染患者相比,COVID-19感染患者2周内接受手术DVT发生率显著增高。同时,本研究中几乎所有的患者为轻症患者,且均为Omicron变异株感染,这也可能是我们的研究中患者术后并发症较轻的原因。
癌症患者发生DVT的风险较非癌症患者增高,目前有关乳腺癌术后DVT可接受发生率并未形成国内和国际共识,从多项研究中得知乳腺癌术后DVT发生率为2.00% ~ 6.40%[15-17]。COVID Surg协作组开展了旨在确定围手术期或既往有COVID-19感染患者静脉血栓栓塞的风险是否进一步增加的研究,主要预后指标为术后30 d内静脉血栓栓塞,结果显示,非COVID-19感染患者术后静脉血栓栓塞发生率为0.5%,围COVID-19感染期患者为2.2%,近期COVID-19感染患者为1.6%,既往 COVID-19感染患者DVT发生率为1.0%[20]。本研究结果显示,乳腺癌患者感染COVID-19后,术后DVT发生率显著增高,COVID-19未感染患者术后DVT发生率为1.21%,感染2周内手术患者DVT发生率为11.76%,超过未感染患者术后DVT发生率。而感染3周后行手术治疗的乳腺癌患者术后DVT发生率为2.67%,与未感染患者术后DVT发生率接近。在目前情况下,我们建议乳腺癌手术在COVID-19感染2周内进行需谨慎,乳腺癌择期手术患者入院后应详细记录SARS-CoV-2感染病史,进行血栓风险评估,根据病情采取静脉血栓栓塞症基础预防措施,术后早期下床,术中及术后使用抗血栓袜、间歇充气加压装置等机械预防措施[21],严密监测DVT。
本研究也存在一定的局限性。首先是单中心研究设计,可能存在患者选择偏倚。其次,研究例数较少,无法进行倾向评分匹配。因此将来需要多中心研究,入组更多患者来进一步证实我们的研究结果。此外,SARS-CoV-2可能通过诱导免疫血栓形成增加DVT并发症的发病风险,后续需要更多的基础研究证实SARS-CoV-2感染对于血栓形成是否具有诱导作用。
综上所述, COVID-19感染患者术后DVT发生率高于未感染患者。从DVT发生风险考虑,乳腺癌择期手术在COVID-19感染2周内进行需谨慎。临床实践中应详细记录手术患者SARSCoV-2感染史,密切监测术后DVT情况,早期预防。
利益冲突声明:所有作者均声明不存在利益冲突。
