红蓝光对濒危植物香果树幼苗生长及内源激素的影响
2023-11-03毛小涛郭连金薛苹苹王阿微钟文君
毛小涛 郭连金 薛苹苹 王阿微 钟文君

摘 要 为研究不同光照对濒危植物香果树幼苗生长的影响,测定分析了红光和红蓝光处理下香果树幼苗光合特性、内源激素含量、生长状况等。结果表明:红光处理香果树幼苗净光合速率增加了4.2%,GA和可溶性糖含量分别增加12.7%、17.0%,叶片干重增加了83.6%;60%红光+60%蓝光处理香果树幼苗净光合速率增加了129.1%,IAA和细胞分裂素tZ分别增加了17.7%、23.3%,根系干重和叶干重分别增加了3.9%、55.3%,显著提高了香果树幼苗叶片的比重,使茎叶比下降49.7%。表明红光和红蓝光对香果树幼苗光合速率和内源激素具有促进作用,特别是红蓝光能显著促进香果树幼苗叶片和根系的生长,60%红光+60%蓝光可作为香果树幼苗培养最有利光源使用。
关键词 香果树;光照;幼苗;生长;光合特性;内源激素
中图分类号:S183 文献标志码:A DOI:10.19415/j.cnki.1673-890x.2023.15.001
香果树(Emmenopterys henryi)为茜草科香果树属高大落叶乔木,我国特有单种属植物,我国二级保护植物[1]。该树种主要分布在江西、福建、湖南、湖北、四川、安徽和浙江南部等地海拔400~1 400 m山区湿润肥沃的山坡和谷地,是我国亚热带中山或低山地区落叶阔叶林或常绿落叶混交林中的伴生树种,长江流域广泛分布的特有树种[2-3]。香果树树姿优美,花大艳丽,为优良的园林观赏植物,同时也是研究茜草科系统发育重要植物[2,4-5];香果树还有重要的药用价值,其根和树皮可入药,能治疗恶心、呕吐、擦伤和跌打损伤等[6];香果树分离出来吲哚生物碱,对肺癌、肝癌及结肠癌细胞具有一定的毒活性和抗炎活性[7-8]。近年来,由于香果树原生境遭到破坏、过度开发及其更新能力弱等原因导致香果树种群不断衰退[1]。香果树种群更新过程中,在野生环境下幼树成长为大树的比例严重不足,种群呈衰退趋势[9]。香果树幼树多分布在郁闭的大树下,林下光照情况对其具有重要影响,研究表明中低强度的光强对香果树幼苗生长最为有利,香果树幼苗具有喜阴的特点[10-11]。除光强外,不同光谱也会影响香果树茎叶的生长,进而影响香果树种群的多样性分化[12]。一些学者分别从生境中光照强度、遮阴情况、光系统Ⅱ等方面开展了研究[10,13-14]。
植物激素是植物体内调节自身生理代谢的活性物质,主要包括生长激素、细胞分裂素、赤霉素、脱落酸、乙烯、油菜素内酯、可溶性糖等,它们对植物生长发育、抗逆、光系统调节、干物质累积运输、延缓衰老等方面具有重要作用[15]。植物体内生长素、赤霉素、脱落酸等激素的分布对蓝光或红光的光形态建成有非常密切的相关性,尤其光照对植物体内激素变化的影响,研究发现高光强能显著提高高山杜鹃芽内的赤霉素、生长素等,有利于高山杜鹃的开花[16];外源的赤霉素能够促进植物叶绿素的合成,提高植物光合速率,进而调节光合产物的比例和分布[17];红光和远红光处理大豆幼苗,发现不同光质显著影响大豆组织中生长素和赤霉素的比值[18]。然而对红光和蓝光光照下香果树幼苗激素变化及生物量变化的研究较少。笔者针对不同光照下香果树幼苗的光合变化、生长情况及不同激素变化情况进行研究,旨在探明香果树幼苗对不同光质需求特征,以及光质变化影响香果树幼苗生长的机制,为香果树繁殖和种群复壮提供理论依据。
1 材料与方法
1.1 材料和设计
试验在江西上饶师范学院上饶农业技术创新研究院光照培养间进行。供试香果树种子采自福建武夷山国家公园,于2021年3月进行幼苗培养,培养基质配比为m(蛭石)∶m(营养土)=1∶1,在温室培养5个月后,将其移至光照系统实验室,进行不同光质处理,保证水分供给。设3个处理,对照(日光灯CK)、红光(R)、红光+蓝光(各60%,RB),处理30 d,30 d后进行光合特性、激素含量及生长指标测定。红蓝光源由深圳澳德森有限公司研制开发。
1.2 研究方法
1.2.1 光合参数测定
利用Li-6400XT便携式光合仪(Li-Cor,USA)测定香果树叶片的气体交换参数,上午10:00开始测定。每个处理选取3株,每株取从上往下选第3片完全展开功能叶进行测定。测定参数包括:净光合速率(rp,n,μmol·m-2·s-1),蒸腾速率(rT,mmol·m-2·s-1),气孔导度(Gs,mmol·m-2·s-1),胞间CO2浓度(φic,μmol·mol-1),水分利用率(Cu,w,mmol·mol-1)=rp,n/rT等。
1.2.2 激素含量测定
不同光照处理后,每个处理取3个顶芽,用去离子水清洗干净后,迅速放入液氮中,置于-80 ℃冰箱保存,用于吲哚乙酸(IAA)、细胞分裂素cZ(cZ)、细胞分裂素tZ(tZ)、赤霉素(GA)、脱落酸(ABA)、可溶性糖(Soluble sugars,SS)等测定。2021年9月28日,样品由青岛科创质量检测有限公司通过试剂盒进行测定。
1.2.3 生长数据测定
不同光照处理后,每个处理取5株幼苗,用去离子水清洗干净,分别用于测定根、茎、叶鲜重,测定鲜重后置于105 ℃烘箱杀青30 min,在65 ℃烘干48 h直至恒重,分别称取根、茎、叶干重,并计算不同处理的茎叶比和根茎比。
1.3 数据分析
采用Excel 2010软件进行数据处理,SPSS软件对數据进行统计分析,单因素方差分析(one-way ANOVA),LSD法进行差异显著性检验(p<0.05)。使用Prism软件作图。
2 结果与分析
2.1 不同光照对香果树幼苗光合特性的影响
由图1可知,不同光照处理中,红光光照强度最强,红蓝光次之,日光灯处理光照最弱(图1A);与对照相比,红光和红蓝光处理显著增加了香果树幼苗净光合速率,其中红蓝光处理香果树幼苗净光合速率最高,达到4.9 μmol·(m-2·s-1),比对照高出1.3倍(图1B);红光处理的气孔导度和蒸腾速率与对照相比没有显著变化,其中红蓝光处理的蒸腾速率平均比对照增加了84.6%,两者差异不显著(图1C、图1D);可能是不同光照处理的光照强度不同,在温室环境下对香果树幼苗的气孔导度及蒸腾没有显著影响。
2.2 不同光照对香果树幼苗激素的影响
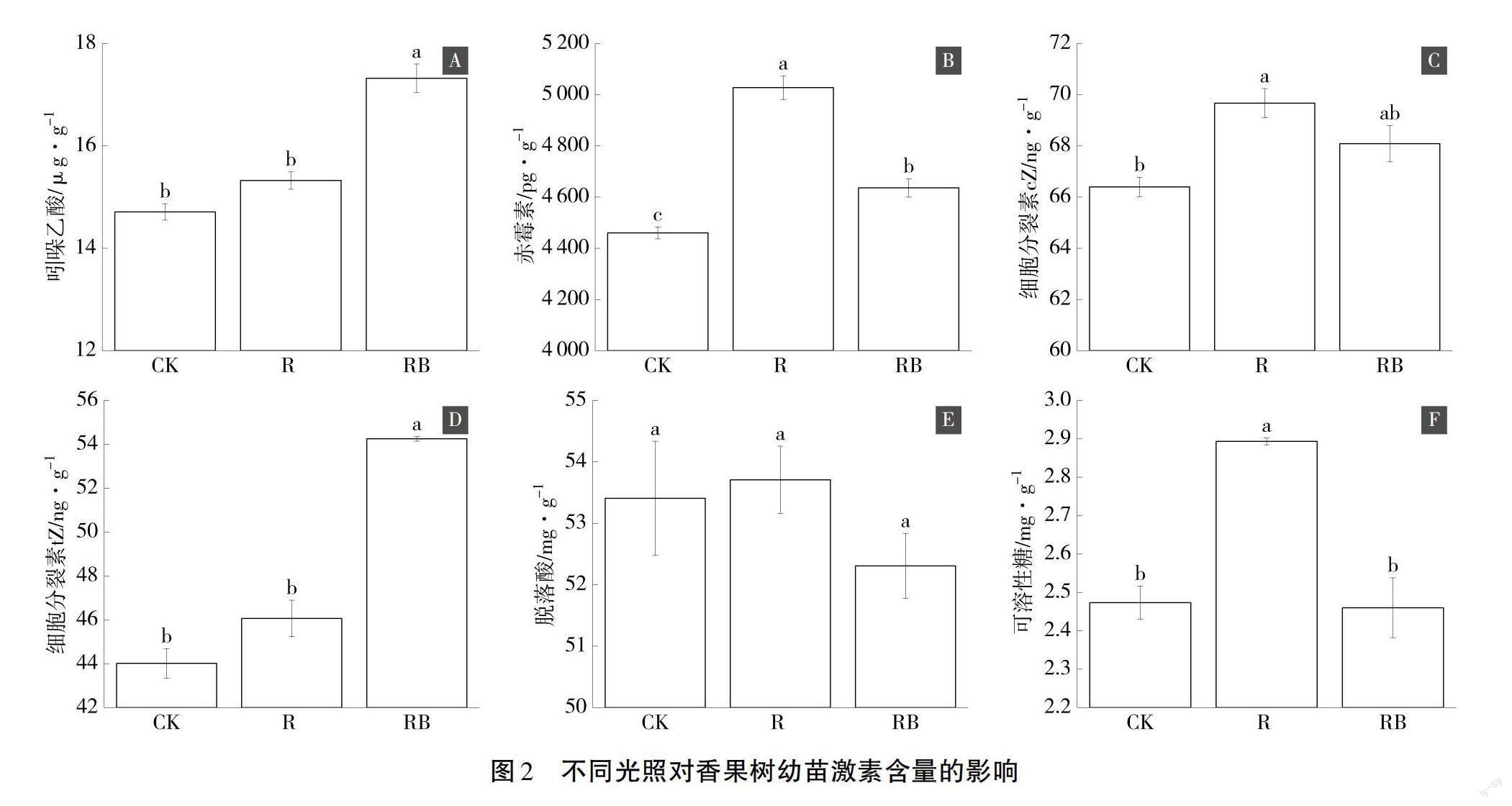
由图2可知,与对照相比,红光显著增加了香果树幼苗顶芽GA、cZ及SS含量,分别增加了12.7%、4.9%和17.0%(图2B、图2C、图2F);与对照相比,红蓝光处理显著增加了香果树幼苗顶芽IAA、GA及tZ,分别增加了17.7%、3.9%和23.3%(图2A、图2B、图2D);与对照相比,红光和红蓝光处理没有显著增加香果树幼苗顶芽ABA的含量(图2E)。表明红光和红蓝光处理影响了香果树幼苗顶芽中IAA、GA、cZ、tZ及SS的含量变化。
2.3 不同光照對香果树幼苗生长特性的影响
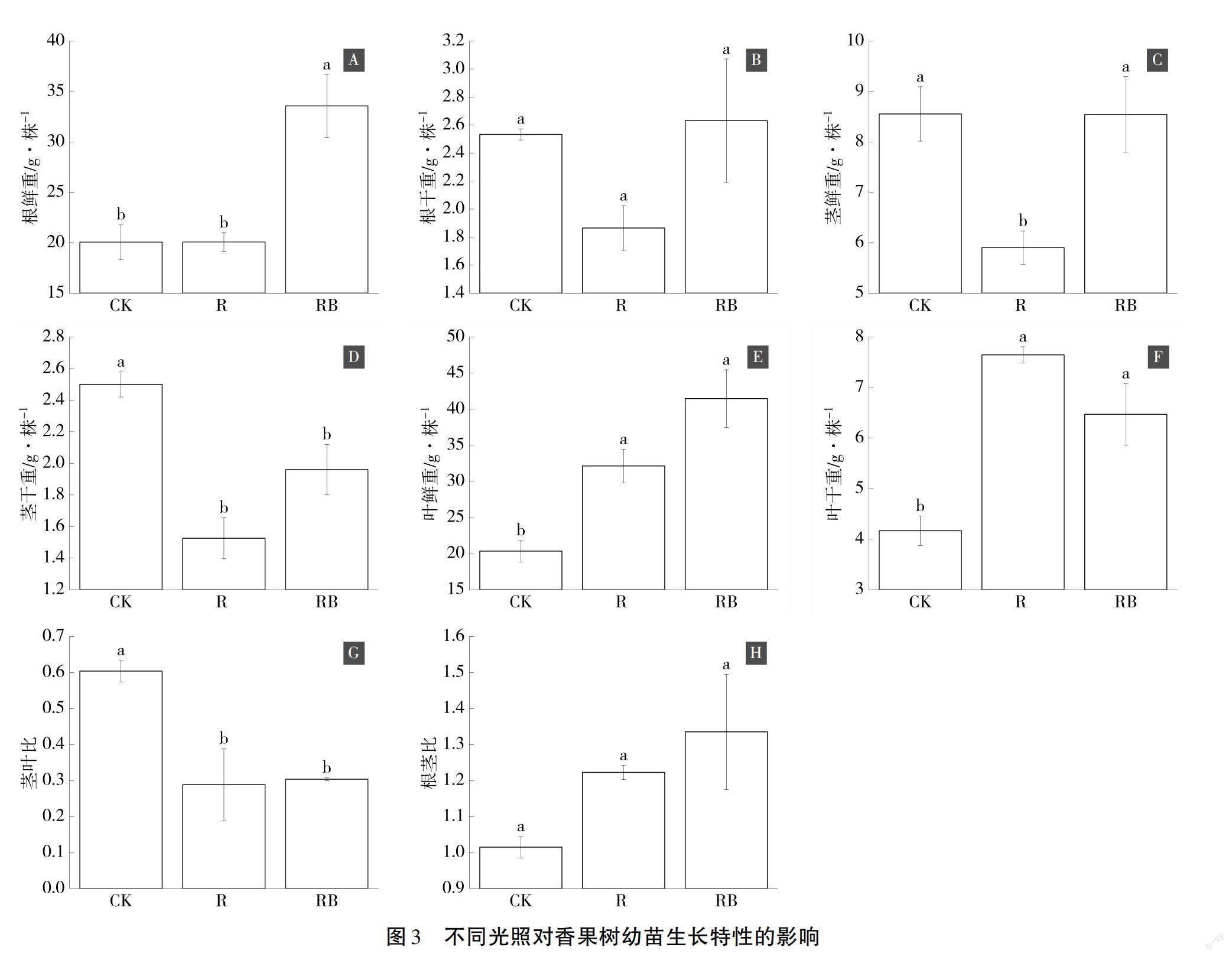
由图3可知,与对照相比,红光处理显著增加了香果树幼苗叶片鲜重和干重,分别增加了58.0%和83.6%(图3E、图3F),并显著降低了香果树幼苗的茎鲜重、茎干重及茎叶比,降幅达到31.0%、39.0%、52.2%(图3C、图3D、图3G);与对照相比,红蓝光处理显著增加了香果树幼苗根鲜重、叶片鲜重和叶片干重,分别增加了67.3%、104.0%、55.3%(图3A、图3E、图3F),并显著降低了茎干重和茎叶比,分别降低了21.6%和49.7% (图3D、图3G);而红光和红蓝光处理对香果树幼苗根干重和根茎比没有显著影响(图3B、图3H)。表明红光和红蓝光处理能显著促进香果树幼苗的叶片和根系生长。
3 讨论与结论
光合作用是植物物质循环和能量流动的基础,也是生物固碳的主要途径,受到光照、温度、水分等因素的影响,决定了植物干物质积累和生长发育[12]。其中,不同光质影响植物器官生长、形态建成、激素含量变化等,进而调控植物的生长和环境的适应性[18]。不同的光照对香果树幼苗的生存起到关键作用,包括香果树种子萌发、幼树生长都需要特定的光照条件[11,19]。本文通过不同光照处理香果树幼苗,发现红光和红蓝光处理显著增加了香果树幼苗的光合速率,分别增加了73.3%和129.1%,表明在香果树幼苗培育过程中增加红光和红蓝光能够促进香果树幼苗的光合作用。叶片的光合能力直接决定了植物生产力的高低,光合作用增强表明对环境的适应能力增强[20]。结果表明,红光及红蓝光对增加香果树幼苗的适应性有显著促进作用。
植物激素作为调节植物自身生理代谢的活性物质,主要包括生长激素、细胞分裂素、赤霉素、脱落酸及可溶性糖等,在植物适应环境过程中发挥重要的调控作用,并且植物形态发生的光依赖也受到植物激素的调控[15,17]。植物激素还在光合作用的直接和间接的调节中起着核心作用[21]。为了进一步探讨红光和红蓝光对香果树幼苗生长激素的影响,本文对不同光照处理的香果树幼苗顶芽的激素情况进行测定,发现红光显著增加了香果树幼苗顶芽GA、cZ及SS含量,分别增加了12.7%、4.9%和17.0%;红蓝光显著增加了香果树幼苗顶芽IAA、GA及tZ,分别增加了17.7%、3.9%和23.3%;红光和红蓝光处理对香果树幼苗顶芽ABA的含量没有显著增加。表明红光和红蓝光显著影响了香果树幼苗顶芽中IAA、GA、cZ、tZ及SS的含量变化。结果与红光通过提高大豆叶片中IAA和GA水平,进而提高其系统的同化速率和电子产量的结果相同[18]。
不同光照除了对植物光合作用、激素含量影响外,对植物的生长情况也有显著影响。研究发现香果树对光照具有较好的生理调节机制,幼苗具有喜光性,有效辐射强度保持在自然光强60%以上时对香果树幼苗最有利[22];高的光强对香果树幼苗生长不利,中低光强对香果树幼苗生长较好[10]。本文对红光和红蓝光处理的香果树幼苗的根、茎、叶的生长状况进行测定,发现红光处理香果树幼苗叶片鲜重和干重分别增加了58.0%和83.6%,香果树幼苗的茎鲜重、茎干重及茎叶比,减少了31.0%、39.0%、52.2%;红蓝光处理香果树幼苗根鲜重、叶片鲜重和叶片干重分别增加了67.3%、104.0%、55.3%,降低了香果树幼苗茎干重和茎叶比21.6%和49.7%。红光和红蓝光处理能显著促进香果树幼苗的叶片和根系生长,促进了香果树幼苗的营养生长,对今后香果树幼苗培育是非常有利的,表明不同光质通过影响香果树体内生长激素的改变,进一步调节其植物光合产物分配。结果与郭连金[12]等发现野外林窗下香果树生长速度最快、生物量最大,内源激素的改变和生物量有显著的相关性研究结果相似[23]。表明红光和红蓝光有助于提高香果树的光合能力、生长激素含量,并增加叶片和根系的竞争力,对促进香果树幼苗的更新有重要意义。本文仅研究了不同光照下当年香果树幼苗的生长情况,对多年生长的香果树而言,还需要开展长期研究,为香果树的保护更新提供理论支撑。
综上所述,红光和红蓝光(60%)能够促进香果树幼苗光合速率的增加,提高香果树幼苗GA和tZ的含量,进而促进香果树幼苗叶片和根系生物量的增加,表明红光和红蓝光对香果树幼苗生长具有促进作用,特别是红蓝光能显著促进香果树幼苗叶片和根系的生长,60%红光+60%蓝光可作为香果树幼苗培养最有利光源使用。
参考文献:
[1] GUO L, SHAO X, XUE P, et al. Root sprouting ability and growth dynamics of the rootsuckers of Emmenopterys henryi, a rare and endangered plant endemic to China[J]. Forest Ecology and Management, 2017, 389: 35-45.
[2] 樊卫东,沈茂才,刘军,等.香果树属秦岭北坡茜草科一新分布属[J].西北植物学报,2012,32(4):819-820.
[3] GUO L, XUE P, LI M, et al. Seed bank and regeneration dynamics of Emmenopterys henryi population on the western side of Wuyi Mountain,South China[J]. Journal of Forestry Research, 2017, 28(5): 943-952.
[4] 刘军.国家Ⅱ级重点保护植物香果树的保护与利用[J].甘肃科技,2003,19(10):151-152.
[5] 杨开军,张小平.稀有植物香果树的研究进展[J].中国野生植物资源,2007,26(2):1-4.
[6] WU X D, HE J, LI X Y, et al. Triterpenoids and steroids with cytotoxic activity from Emmenopterys henryi[J]. Planta Med, 2013, 79(14): 1356-1361.
[7] 周慧斌.香果树化学成分及其生物活性研究[D].上海:第二军医大学,2008.
[8] WU X D, WANG L, HE J, et al. Two New Indole Alkaloids from Emmenopterys henryi[J]. Helvetica Chimica Acta, 2013, 96(12): 2207-2213.
[9] 康华靖,陈子林,刘鹏,等.大盘山自然保护区香果树种群结构与分布格局[J].生态学报,2007,27(1):389-396.
[10] 刘鹏,康华靖,张志详,等.香果树(Emmenopterys henryi)特性和叶绿素荧光对不同光强的响应[J].生态学报,2008,28(11):5656-5664.
[11] 郭连金.濒危植物香果树(Emmenopterys henryi)种群结构与动态[J].武汉植物学研究,2009,27(5):509-514.
[12] 张志祥,刘鹏,康华靖,等.基于主成分分析和聚类分析的FTIR不同地理居群香果树多样性分化研究[J].光谱学与光谱分析,2008,28(9):2081-2086.
[13] 郭连金,杜佳朋,吴艳萍,等.香果树实生苗的光合特性及其与环境因子的关系[J].应用生态学报,2017,28(5):1473-1481.
[14] 李冬林,金雅琴,崔梦凡,等.遮荫对香果树叶片生理特性及叶肉细胞超微结构的影响[J].植物研究,2020,40(1):29-40.
[15] 朱波,徐绮雯,马淑敏,等.干旱缺钾对油菜内源激素、光合作用和叶绿素荧光特性的影响[J].中国油料作物学报,2022,44(3):570-580.
[16] 龚洪恩,姚小华,吴鹏飞,等.LED不同光强对油茶苗生理生化特性的影响[J].广西植物,2019,39(12):1599-1604.
[17] WEN Y, SU S C, MA L Y, et al. Effects of gibberellic acid on photosynthesis and endogenous hormones of Camellia oleifera Abel. in 1st and 6th leaves[J]. Journal of Forest Research, 2018, 23(5): 309-317.
[18] YANG F, FAN Y, WU X, et al. Auxin-to-Gibberellin Ratio as a Signal for Light Intensity and Quality in Regulating Soybean Growth and Matter Partitioning[J]. Frontiers in plant science, 2018, 9: 56.
[19] 郭连金,李梅.濒危植物香果树武夷山种群分布格局的分形分析[J].西北植物学报,2009,29(5):867-873.
[20] ZHANG C G, LIU X, FAN Y L, et al. Sunfleck limits the small-scale distribution of endangered Kingdonia uniflora in the natural habitat of subalpine forest proved by its photosynthesis[J]. Acta Physiologiae Plantarum, 2016, 38: 1-11.
[21] MULLER M, MUNNE-BOSCH S. Hormonal impact on photosynthesis and photoprotection in plants[J]. Plant physiology, 2021, 185(4): 1500-1522.
[22] 李冬林,王火,江浩,等.遮光對香果树幼苗光合特性及叶片解剖结构的影响[J].生态学报,2019,39(24):9089-9100.
[23] HUAN L, JIN Q W, QING L. Photosynthesis product allocation and yield in sweet potato with spraying exogenous hormones under drought stress[J]. J Plant Physiol, 2020, 253: 153265.
(责任编辑:丁志祥)
