基于IGF-1/SDF-1/CXCR4轴研究黑地黄丸含药血清对骨髓间充质干细胞增殖迁移的影响❋
2023-11-03李颖颖田增辉潘广辉叶莉莹张法荣
李颖颖,田增辉,赵 平,潘广辉,叶莉莹,张法荣△
(1. 山东中医药大学附属医院,济南 250014;2.山东中医药大学,济南 250014;3.泰安市中医院,山东泰安 271000,4.广饶县中医院,山东东营 257300)
骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)作为兼具易于体外分离培养、造血支持、多分化潜能、免疫调节、旁分泌效应等多种优点的多能干细胞,可归巢至受损部位通过分泌相关因子或分化为相关组织以修复损伤。多项研究表明BMSCs对急性肾损伤[1]、慢性肾脏病[2]、局灶性节段性肾小球硬化[3]、糖尿病肾病[4]、肾血管疾病[5]、狼疮性肾炎[6]、多囊肾[7]和肾纤维化[8]等多种慢性肾脏疾病都具有巨大的潜在治疗作用,成为肾脏组织修复领域研究热点[9]。然而BMSCs的低归巢率以及在局部缺血缺氧条件下的低存活率影响了其治疗效果[10]。近年来中医药在改善BMSCs微环境并促进其归巢领域备受关注[11-12]。本课题组前期研究显示,黑地黄丸可促进肾衰大鼠体内BMSCs的增殖并促进其分泌胰岛素样生长因子(insulin-like growth factor,IGF)-1[13]。查阅文献发现IGF-1是BMSCs分泌的重要细胞因子之一,在促进BMSCs迁移归巢过程中发挥重要作用[14-15],IGF-1可与胰岛素样生长因子1受体(insulin-like growth factor 1 receptor, IGF-1R)结合后通过基质细胞衍生因子(stromal cell-derived factor, SDF)-1/趋化因子受体(C-X-C chemokine receptor type, CXCR)4轴促进自身迁移[16-17]。因此,本实验假设黑地黄丸可促进BMSCs自分泌IGF-1,通过SDF-1/CXCR4轴促进自身迁移。本研究拟通过体外实验观察黑地黄丸含药血清对BMSCs增殖、迁移的影响,探索其机制,证明黑地黄丸可以促进BMSCs迁移,为中医药促进BMSCs的归巢及治疗慢性肾脏疾病提供更多实验依据及治疗靶点。
1 材料与方法
1.1 动物
健康雄性Wistar大鼠30只,6~7周龄,体质量(200±20)g,购自北京维通利华实验动物技术有限公司,实验动物许可证号:SCXK(京)2016-0006。动物饲养于山东中医药大学实验动物中心,饲养条件为:温度22~24 ℃,相对湿度40 %~70 %,噪声<60分贝,照明时间L/D=12 h/12 h,自由饮食饮水。动物实验经山东中医药大学动物伦理委员会批准,伦理编号:SDUTCM20201019002。
1.2 药品
黑地黄丸由熟地黄、苍术、干姜、大枣共4味药组成,均购于山东中医药大学附属医院门诊药房。
1.3 试剂与仪器
黄芪甲苷(纯度≥98%),货号84687-43-3,滁州仕诺达生物科技有限公司;DMEM低糖培养基,货号C11885500BT,美国Gibco公司;噻唑兰,货号M8180,1%结晶紫染液,货号G1062,北京索莱宝公司;Wistar大鼠骨髓间充质干细胞成骨诱导分化试剂盒,货号RAWMX-90021,成脂诱导分化试剂盒,货号RAWMX-90031,广州赛业生物公司;Anti-CD90,货号ab33694,Anti-CD34,货号ab81289,美国abcam公司;Anti-CD45,货号202205,美国BioLegend公司;大鼠IGF-1 ELISA测定试剂盒,货号jl10683,上海江莱生物公司;BCA蛋白浓度测定试剂盒(增强型),货号P0010S,上海碧云天生物公司;NVP-AEW541(IGF-1R抑制剂),货号78617-10-4,上海陶素生化科技有限公司;IGF-1抗体,货号9750 T,SDF-1抗体,货号3530 s,美国CST公司;CXCR4抗体,货号11073-2-AP,武汉三鹰公司;二抗,货号ZB2301,北京中杉金桥公司;GAPDH,货号A19056,武汉ABclonal公司。
HFsafe-1200LC生物安全柜,上海力康Heal Force公司;FORMASTERI-CYCLE i160倒置相差显微镜,日本Olympus公司;BioTek Cytation 5全波长酶标仪,美国BioTek公司;Amersham Imager600多色荧光成像系统(自动化学发光凝胶成像分析),美国GE Healthcare公司。
1.4 含药血清制备
6~7周龄雄性Wistar大鼠适应性喂养7 d,随机分为黑地黄丸(熟地黄20 g、苍术20 g、大枣20 g、干姜3 g)组、黄芪甲苷组、空白组。成人服用黑地黄丸剂量为100 g/60 kg/d,换算成200 g大鼠为10.43 g/kg/d,以此剂量给大鼠灌胃;AS-Ⅳ根据文献方法[18]以1.5 mg/kg/d给大鼠灌胃;空白组每天相同时间灌等体积0.9%生理盐水。每天灌胃1次,连续灌胃10 d,于最后一次灌胃2 h后,腹腔注射戊巴比妥钠(50 mg/kg)麻醉大鼠,腹主动脉取血。室温静置2 h,4 ℃ 3 000 r/min离心20 min,分离血清,同组血清混合,56 ℃水浴30 min灭活补体,0.22 μm滤器过滤除菌后分装,-80 ℃冻存备用。
1.5 BMSCs原代提取与鉴定
1.5.1 BMSCs提取与培养 采用全骨髓细胞贴壁筛选法提取原代细胞[19]。大鼠引颈处死后,75%酒精浸泡5 min,无菌条件下取出股骨、胫骨,剪去两端骨骺,暴露骨髓腔。完全培养液反复冲洗骨髓腔至骨头发白,反复吹打骨髓冲洗液,收集后室温下1 000 r/min离心3 min,弃上清,向沉淀中加入细胞培养液,制成单细胞悬液接种于培养瓶中,37 ℃、5% CO2孵箱内静置培养,待细胞融合至80%~90%时,按照1:2传代培养。
1.5.2 BMSCs鉴定
1.5.2.1 诱导成骨、成脂分化 取生长融合至80%~90%的P3代BMSCs,按照成骨诱导试剂盒说明进行成骨诱导,待出现大量明显钙结节后进行茜素红染色。倒置显微镜下观察染色效果并拍照。取生长融合至80%~90%的P3代BMSCs,按照成脂诱导试剂盒说明进行成脂诱导,当出现足量、大小适宜的脂滴时进行油红O染色。倒置显微镜下观察染色效果并拍照。
1.5.2.2 流式鉴定BMSCs表面抗原CD90、CD45、CD34的表达 取生长融合至80%的P3代BMSCs,胰酶消化后制成1×106个/mL单细胞悬液,分为阴性对照组、CD90组、CD45组、CD34组,每组各100 μL。CD90组加入1.25 μL CD90-PE染液,CD45组加入0.5 μL CD45-FITC染液,CD34组加入0.5 μL CD34-FITC染液,吹打混匀后室温避光孵育15 min,流式细胞仪检测。以CD45、CD34阳性率低于5%,CD90阳性率高于95%为标准[20-23],鉴定所得细胞为高纯度的BMSCs。
1.6 MTT检测黑地黄丸含药血清对BMSCs增殖的影响
取生长融合至80%~90%的P3代BMSCs,分为对照组、黑地黄丸含药血清组(1%、5%、10%、15%、20%)及黄芪甲苷含药血清组(1%、5%、10%、15%、20%),每组3个复孔,黑地黄丸含药血清组、黄芪甲苷含药血清组每孔分别加入100 μL含相应浓度含药血清的培养液,对照组加入含空白含药血清的培养液。48 h后加入20% 噻唑兰(methyl thiazolyl tetrazolium,MTT)溶液,37 ℃避光孵育3 h,弃液后加入150 μL DMSO溶液,酶标仪检测495 nm处吸光度(A)。增殖率计算公式:[(药物组平均吸光度—对照组平均吸光度)/对照组平均吸光度×100%]。
1.7 细胞划痕实验检测黑地黄丸含药血清对BMSCs划痕愈合的影响
取生长融合至80%~90%的P3代BMSCs,以2×104个/(cm2)接种于6孔板,静置培养48 h,细胞生长融合至90%时,用200 μL枪头进行划痕。设置对照组、5%黑地黄丸含药血清组、5%黑地黄丸含药血清+IGF-1R抑制剂组(10 μg/ml)、5%黄芪甲苷含药血清组。分别于给药0 h、24 h于倒置显微镜下观察划痕情况并拍照,利用Image J软件计算各组划痕面积。划痕愈合率=(0 h划痕面积-24 h划痕面积)/0 h划痕面积×100%。
1.8 Transwell法检测黑地黄丸含药血清对BMSCs迁移数量的影响
取生长融合至80%~90%的P3代BMSCs制备细胞悬液,以2×104个/cm2接种于Transwell小室中,将小室置于6孔板中静置培养6 h。设置对照组、5%黑地黄丸含药血清组、5%黑地黄丸含药血清+IGF-1R抑制剂组(10 μg/ml)、5%黄芪甲苷含药血清组。各给药组分别加入含相应药物的培养液,对照组加入含5%空白含药血清的培养液,干预48 h后,取出小室,磷酸缓冲盐溶液(phosphate buffer saline,PBS)洗涤3次,弃液,4%多聚甲醛中室温固定15 min,PBS洗涤3次,弃液,1%结晶紫染液室温避光染色20 min,PBS洗去浮色,用湿棉棒轻轻擦去小室上层未穿膜的细胞,将小室正置于载玻片上,于倒置显微镜下观察迁移细胞数量并拍照。利用Image J软件计算各组迁移细胞数量。
1.9 ELISA法检测细胞培养上清内IGF-1的含量
取生长融合至80%的P3代BMSCs,胰酶消化后制成单细胞悬液,以2×104个/cm2接种于6孔板,细胞培养箱内静置培养24 h。设置对照组、5%黑地黄丸含药血清组、5%黄芪甲苷含药血清组,每组3个复孔。各给药组分别加入含相应药物的培养液,对照组加入含5%空白含药血清的培养液,干预48 h后,取各组培养上清液,2 000 r/min离心20 min,取上清,按照ELISA说明书制备样品,于酶标仪检测450 nm处吸光度(A)。
1.10 Western blot法检测BMSCs中IGF-1、SDF-1、CXCR4的表达
细胞接种培养方法同1.8。设置对照组、5%黑地黄丸含药血清组、5%黑地黄丸含药血清+IGF-1R抑制剂组,每组3个复孔。药物干预48 h后,将BMSCs消化收集,加入细胞裂解液充分裂解,提取蛋白并检测蛋白含量,取等质量等体积蛋白样品,进行凝胶电泳、转膜、封闭,依次加入一抗、二抗孵育,洗膜后胶片分析仪对蛋白条带进行处理分析。
1.11 统计学分析
2 结果
2.1 BMSCs形态及鉴定
图1A示,BMSCs分离后贴壁生长,呈成纤维状、短梭状或不规则状,形态欠统一;图1B示,P3代BMSCs呈成纤维状,旋涡状紧密排列,细胞形态统一。图2A示,经成骨诱导14 d、茜素红染色后呈现大量红色钙结节;图2B示,经成脂诱导16 d、油红O染色后出现橘红色脂滴。提取的BMSCs的细胞形态及分化能力符合干细胞特性。流式结果示,CD45、CD34阳性率低于5%,CD90阳性率高于95%,符合BMSCs鉴定标准(图3)。提示所提取的原代细胞为高纯度BMSCs。
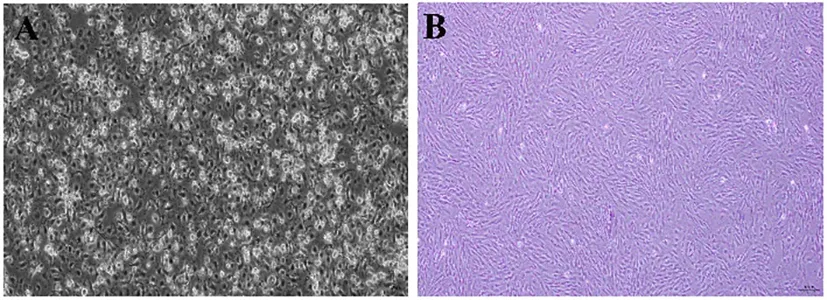
注:骨髓间充质干细胞(BMSCs)A.P0代BMSCs贴壁后的细胞形态;B. P3代BMSCs贴壁后的细胞形态

注:CD90阳性率为97.25%,CD45阳性率为2.22%,CD34阳性率为1.69%;骨髓间充质干细胞(BMSCs)
2.2 黑地黄丸含药血清对BMSCs的促增殖作用
图4示,黑地黄丸含药血清浓度在1%~10%范围内可促进BMSCs的增殖,5%黑地黄丸含药血清对BMSCs的促增殖作用最强,黄芪甲苷含药血清干预浓度不超过5%时,均可促进BMSCs的增殖,因此最终选用5%作为黑地黄丸含药血清、黄芪甲苷含药血清的共同干预浓度。

注:骨髓间充质干细胞(BMSCs)
2.3 5%黑地黄丸含药血清促进BMSCs划痕愈合
表1、图5示,与对照组比较,5%黑地黄丸含药血清可显著促进划痕愈合(P<0.01),提示5%黑地黄丸含药血清可促进BMSCs迁移。与5%黑地黄丸含药血清组比较,5%黑地黄丸含药血清+IGF-1R抑制剂组组划痕愈合率显著下降(P<0.05),证明IGF-1R抑制剂可抑制黑地黄丸含药血清对BMSCs的促迁移作用,提示黑地黄丸含药血清可能通过调节IGF-1信号传导促进BMSCs的迁移。
表1 5%黑地黄丸含药血清对BMSCs划痕愈合的影响

注:骨髓间充质干细胞(BMSCs);胰岛素样生长因子I受体(IGF-1R)
2.4 5%黑地黄丸含药血清增加BMSCs的细胞迁移数量
表2、图6示,与对照组比较,5%黑地黄丸含药血清组BMSCs迁移数量显著增加(P<0.05);与5%黄芪甲苷含药血清组比较,5%黑地黄丸含药血清在促进BMSCs迁移方面更具优势(P<0.05);与5%黑地黄丸含药血清组比较,5%黑地黄丸含药血清+IGF-1R抑制剂组BMSCs迁移数量显著减少(P<0.05),证明IGF-1R抑制剂可抑制黑地黄丸含药血清对BMSCs的促迁移作用,提示黑地黄丸含药血清可能通过调节IGF-1信号传导促进BMSCs的迁移。
表2 5%黑地黄丸含药血清对BMSCs迁移数量的影响

注:骨髓间充质干细胞(BMSCs);胰岛素样生长因子I受体(IGF-1R)
2.5 5%黑地黄丸含药血清促进BMSCs分泌IGF-1。
表3示,与对照组比较,5%黑地黄丸含药血清可显著增加细胞培养上清中IGF-1的含量(P<0.05),且效果优于5%黄芪甲苷含药血清(P<0.05)。
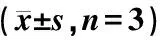
表3 细胞培养上清中IGF-1的含量
2.6 5%黑地黄丸含药血清影响BMSCs中IGF-1、SDF-1、CXCR4的蛋白表达。
表4、图7示,与对照组比较,5%黑地黄丸含药血清、5%黄芪甲苷含药血清可显著上调BMSCs中IGF-1的表达(P<0.05),同时使BMSCs表面趋化因子CXCR4高表达(P<0.05),并下调BMSCs中SDF-1的表达(P<0.05);与5%黑地黄丸含药血清组比较,5%黑地黄丸含药血清+IGF-1R抑制剂组CXCR4的蛋白表达量显著下调(P<0.05),SDF-1的表达上调(P<0.05)。提示黑地黄丸含药血清也可通过增加BMSCs内IGF-1的水平,促进IGF-1与IGF-1R的结合,增加其表面趋化因子CXCR4的表达,通过SDF-1/CXCR4轴促进BMSCs的迁移。
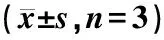
表4 5%黑地黄丸含药血清对BMSCs细胞内IGF-1、SDF-1、CXCR4蛋白表达的影响
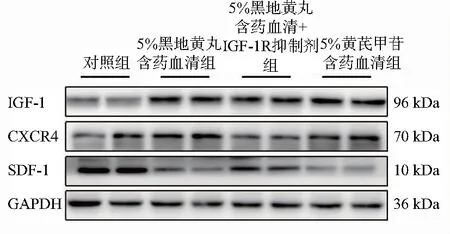
注:骨髓间充质干细胞(BMSCs);胰岛素样生长1因子受体(IGF-1R);趋化因子(CXCR4)受体4;基质细胞衍生因子-1(SDF-1);胰岛素样生长因子-1(IGF-1)
3 讨论
近年来中国成人慢性肾脏病(chronic kidney disease,CKD)患病率高[24],对其治疗目前尚缺乏行之有效的方法,肾脏替代疗法作为慢性肾衰竭阶段的主要治疗手段,虽可替代维持基础肾功能,但其疗效并不令人十分满意。因此肾脏本身的修复是治疗慢性肾脏疾病需重点关注的问题。BMSCs是一种多能干细胞,具有强大的自我更新能力、多向分化潜能以及免疫调节功能,并可分泌细胞因子、生长因子、抗氧化剂和促血管生成因子,以及刺激细胞增殖和血管生成、降低应激反应和受损细胞凋亡、调节局部和全身炎症和免疫反应的分子,有助于组织的修复[25-26]。因此BMSCs一度成为肾脏组织修复领域研究热点。目前BMSCs修复肾脏的途径可以概括为以下3点:(1)直接分化为肾脏受损细胞,修复受损肾组织,但这种途径目前存在极大争议。(2)BMSCs自分泌或旁分泌相关分子修复肾损伤:包括细胞因子、生长因子、抗氧化剂等。(3)BMSCs衍生的外泌体修复肾损伤。但无论何种途径,BMSCs顺利归巢至受损部位是BMSCs修复肾损伤的重要条件。
细胞表面关键受体数量不足可能是导致BMSCs无法有效归巢到目标组织的原因[27]。细胞表面趋化因子CXCR4是SDF-1的特异性受体,SDF-1与细胞表面CXCR4受体结合是参与BMSCs迁移归巢的主要信号通路[28]。IGF-1不但可以增加BMSCs细胞表面CXCR4的表达水平,还显著增加BMSCs对SDF-1的迁移反应[27]。用IGF-1预处理BMSCs可使其凋亡减少,并提高其迁移能力[17]。此外,黄芪甲苷已被国内外多项研究证实可改善肾功能[29],且可促进BMSCs分泌IGF-1[30],促进BMSCs迁移[31],故用作本研究的阳性对照药物。黑地黄丸出自《素问病机气宜保命集》,是补肾泻浊类的经典中药复方。课题组前期临床及基础研究发现,黑地黄丸可通过改善微炎症状态、降脂、改善肾性贫血、调节胃肠激素紊乱等多种途径[13,32-35]改善肾功能[36]。进一步研究显示该方可促进肾衰大鼠体内BMSCs的增殖,同时还可提高其分泌IGF-1的水平[13]。
基于以上前期基础,本研究结果进一步表明,黑地黄丸含药血清可增加细胞培养上清中及BMSCs内IGF-1的水平,同时可上调BMSCs内SDF-1的特异性受体CXCR4的表达,下调SDF-1的表达,进而从划痕愈合率和迁移数量两个维度促进BMSCs迁移。IGF-1R抑制剂NVP-AEW541可阻断黑地黄丸含药血清对BMSCs中CXCR4、SDF-1蛋白表达的调控,进而阻断BMSCs的迁移。证明了黑地黄丸含药血清是通过促进IGF-1与IGF-1R的结合,增加BMSCs表面趋化因子CXCR4的表达,进而调控SDF-1/CXCR4轴,促进BMSCs迁移。本研究从体外细胞实验层面首次证明了黑地黄丸可促进BMSCs的迁移,并初步探索了黑地黄丸促进BMSCs迁移的可能机制。本课题组将进一步探索黑地黄丸促进BMSCs归巢的机制及靶点,为中医药治疗慢性肾脏病提供更多靶点和研究思路。
