益肾达络饮对DPCPX干预下EAE小鼠H3K9ac、H4K5ac表达的影响❋
2023-11-03谢名宗何静文丁文婧尚晓玲
王 响,谢名宗,何静文,丁文婧,尚晓玲
(长春中医药大学,长春 130117)
多发性硬化(multiple sclerosis,MS)是一种自身免疫性脱髓鞘疾病,其病变主要累及中枢神经系统,具有复发率高,致残率高的特点,为患者及社会带来沉重的负担[1-2]。但发病机制尚不明晰,亦无治愈的特效药物。
中药复方益肾达络饮是在MS毒损督络、戕害肾阳及脑髓、败坏形体的病机理论下创立的[3]。临床研究表明,益肾达络饮可以显著减轻MS患者的神经功能缺损,降低临床复发次数[4]。实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)小鼠是研究MS的理想动物模型。前期实验研究发现益肾达络饮能有效调节EAE小鼠神经功能障碍,改善炎性病变,促进损伤后神经再生[5-10]。本研究旨在探讨益肾达络饮在腺苷A1受体(adenosine A1 receptor,A1AR)抑制剂1,3-二丙-8-环戊黄嘌呤(8-cyclopentyl-1,3- dipropylxanthine,DPCPX)干预下对EAE小鼠的治疗作用及对组蛋白H3第9位赖氨酸乙酰化(histone H3 lysine residue 9 acetylation,H3K9ac)和组蛋白H4第5位赖氨酸乙酰化(histone H4 lysine residue 5 acetylation,H4K5ac)表达的影响,从而窥析益肾达络饮治疗EAE的表观遗传学机制。
1 材料与方法
1.1 动物
SPF级雌性C57BL/6J小鼠,体质量16~20 g,6~8周龄,购于长春亿斯实验动物有限责任公司,实验动物许可证号:SCXK(吉)-2018-0007。饲养于长春中医药大学动物实验中心屏障系统内,给予普通饲料、洁净水自由进食,在温度20~22 ℃、相对湿度(50±10)%、12 h光照/12 h黑暗环境中饲养。本实验已通过长春中医药大学实验动物伦理委员会审查(批准编号:2020201)。造模前适应性饲养7 d。
1.2 药物
益肾达络饮由熟地黄、黑顺片、绵萆薢、鹿角胶、当归、羌活、石菖蒲、郁金、栀子、知母、豨莶草、生甘草12味中药组成,共142 g,购自吉林同仁大药房,将饮片放入砂锅中(除外鹿角胶),浸泡2 h,煮沸后转小火煎煮2 h,纱布过滤2次,煎煮浓缩,浓缩过程中加入鹿角胶不断搅拌,最后得浓缩药液71 mL,即配置成2 g生药/mL的中药药液。醋酸泼尼松片(国药准字092H12068)天津天药药业股份有限公司,30 mg(6片,5 mg/片)溶于77 mL蒸馏水,配制成0.39 mg/mL的药液。
1.3 主要试剂与仪器
髓鞘少突胶质细胞糖蛋白(Myelin oligodendrocyte glycoprotein,MOG)35-55多肽,货号190402-1,北京赛百盛基因技术有限公司;百日咳毒素,货号180,美国List Biological Laboratories公司;完全弗氏佐剂,货号F5881,美国Sigma公司;灭活结核杆菌,货号R19021,上海瑞楚生物科技有限公司;鼠源甘油醛3磷酸脱氢酶(glyceraldehyde3phosphate dehydrogenase,GAPDH)抗体、A1AR抗体、H3K9ac抗体、H4K5ac抗体、二抗羊抗鼠、二抗羊抗兔,货号分别为bsm-0978 M、bs-6649R、bs-3776R、bs-10721R、bs-40296G-HRP、bs-40295G-HRP,北京博奥森生物技术有限公司;DPCPX,货号ab120396,英国Abcam公司。
HBS-1096A型全波长酶标仪,南京德铁实验设备有限公司;JY600E型Western Blot凝胶电泳系统,北京君意东方电泳设备有限公司;WGD-20型凝胶成像仪,美国Bio-Rad公司;JB-L5型石蜡包埋机,武汉俊杰电子有限公司;RM2016型石蜡切片机,莱卡显微系统(上海)有限公司;Eclipse Ci-L型显微镜,尼康仪器有限公司。
1.4 模型制备
造模第1天除正常对照组外,其余组每只小鼠在背部皮下分四点,50 μL/点,共注射抗原乳剂200 μL(含MOG 250 μg,灭活结核杆菌800 μg,磷酸缓冲盐溶液(phosphate buffer saline,PBS)100 μL,完全弗氏佐剂100 μL,注射前将试剂混合反复吹打乳化,至滴入清水中聚而不散为乳化成功),分别于注射抗原乳剂30 min及48 h后腹腔注射百日咳溶液100 μL(含百日咳毒素500 ng)。
1.5 分组及干预方法
随机将60只C57BL/6J雌性小鼠平均分为6组,分别为模型组、正常对照组、西药组、中药组、DPCPX组、DPCPX+中药组。免疫第4天DPCPX组与DPCPX+中药组给予DPCPX 2 mg/kg腹腔注射[11]。免疫第8天开始,模型组、DPCPX组每天予0.9%氯化钠溶液 0.1 mL/10 g体重灌胃,西药组予醋酸泼尼松混悬液0.1 mL/10 g灌胃(灌胃前摇匀),中药组与DPCPX+中药组予益肾达络饮药液0.1 mL/10 g灌胃,连续给药14 d后取材。
1.6 神经功能评分
每日观察小鼠一般情况,评估每只小鼠的神经功能评分,采取Weaver 15分评分法为评分标准[12],即尾部无症状为0分,尾部半瘫1分,尾部全瘫2分;四肢无症状为0分,肢体力弱或者步态改变为1分,四肢不完全瘫痪2分,完全瘫痪为3分。尾部评分与四肢评分相加为小鼠的神经功能评分,死亡记为15分,神经功能评分≥1分为发病。
1.7 取材方法
Western Blot取材方法:颈椎脱臼后迅速取出脑和脊髓组织,速冻于液氮中标记备用。每组测定3只小鼠的蛋白表达情况。
免疫组化取材方法:1%戊巴比妥腹腔注射充分麻醉,固定小鼠,剪开胸腔,用0.9%氯化钠溶液心脏灌注至流出液体清亮,改用4%多聚甲醛灌注,待尾巴与四肢抽搐结束,取出完整的脑及脊髓,用4%多聚甲醛固定48 h。将脑按照纵向与横向的中轴线进行切割,平均分成四部分,脊髓按照颈胸腰骶进行切割,分成四部分,分别进行石蜡包埋。将组织切成2~3 mm薄片脱水、浸蜡、包埋,4 μm切片,每个蜡块选取3张切片进行检测,每组测定3只小鼠的脑与脊髓。
1.8 Western Blot检测脑与脊髓中A1AR、H3K9ac、H4K5ac的含量
分别提取脑与脊髓的总蛋白,二奎琳甲酸(bicinchoninic acid,BCA)法测定蛋白浓度,每孔上样40 μg,电泳,聚偏二氟乙烯(polyvinylidene fluoride,PVDF)转膜,5%脱脂奶粉封闭,分别添加H3K9ac(1:1 000)、H4K5ac(1:1 000)、A1AR(1:1 000)、GAPDH(1:5 000)一抗,4 ℃过夜,添加对应二抗,电化学发光(electro-chemi-luminescence,ECL)显影,Image J软件进行图片分析。
1.9 免疫组化观察脑与脊髓中H3K9ac、H4K5ac的表达情况
取石蜡切片,60 ℃烤片1 h,脱蜡至水,抗原修复,过氧化氢孵育,正常山羊血清封闭,抗体孵育,H3K9ac与H4K5ac抗体稀释比例为1:200,二抗羊抗兔稀释比例为1:1 000,二氨基联苯胺(diaminobenzidine,DAB)显色,脱水,透明,封片,显微镜下观察,拍照,Image J软件分析图像的平均光密度。
1.10 统计学方法
用GraphPad Prism 9.0.0对数据进行分析,统计各组数据均值及标准差,各组间进行单因素方差分析。P<0.05具有统计学意义。
2 结果
2.1 各组小鼠神经功能评分变化情况。
表1示,正常对照组未见神经功能异常,其他组于造模后陆续开始发病,逐渐出现尾部无力,尾部瘫痪拖地,四肢力弱,步态改变,甚至肢体瘫痪。与模型组比较,中药组、DPCPX+中药组、西药组平均最高神经功能评分与第21天神经功能评分均显著降低(P<0.05)。

表1 各组小鼠神经功能评分比较
2.2 Western Blot检测脑组织中A1AR、H3K9ac、H4K5ac的表达量
图1、表2示,与正常对照组比较,模型组A1AR表达量显著降低(P<0.01);H3K9ac、H4K5ac表达量显著上升(P<0.05)。与模型组比较,DPCPX组A1AR表达量显著降低(P<0.05),H3K9ac、H4K5ac表达量显著升高(P<0.01);中药组H3K9ac、H4K5ac表达量显著降低(P<0.05);DPCPX+中药组A1AR表达量显著升高(P<0.05),H3K9ac表达量显著升高(P<0.05),H4K5ac表达量显著降低(P<0.05);西药组H3K9ac表达量显著降低(P<0.01),H4K5ac表达量显著升高(P<0.05)。
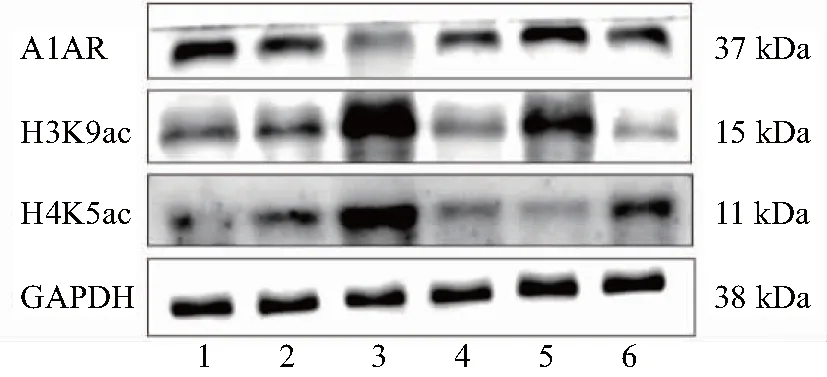
注:1.正常对照组;2.模型组;3.DPCPX组(经腺苷A1受体抑制剂1,3-二丙-8-环戊黄嘌呤干预组);4.中药组;5.DPCPX+中药组;6.西药组;腺苷A1受体(A1AR),组蛋白H3第9位赖氨酸乙酰化(H3K9ac),组蛋白H4第5位赖氨酸乙酰化(H4K5ac)。
表2 Western Blot检测各组小鼠脑组织中A1AR、H3K9ac、H4K5ac蛋白的表达
2.3 Western Blot检测脊髓组织中A1AR、H3K9ac、H4K5ac的表达量
图2表3示,与正常对照组比较,模型组A1AR表达量显著降低(P<0.01);H3K9ac、H4K5ac显著升高(P<0.05)。与模型组比较,DPCPX组H3K9ac、H4K5ac表达量显著升高(P<0.05);中药组A1AR表达量显著升高(P<0.05);DPCPX+中药组A1AR、H4K5ac显著升高(P<0.05);西药组A1AR表达量显著升高(P<0.05)。

注:1.正常对照组;2.模型组;3.DPCPX组(经腺苷A1受体抑制剂1,3-二丙-8-环戊黄嘌呤干预组);4.中药组;5.DPCPX+中药组;6.西药组;腺苷A1受体(A1AR),组蛋白H3第9位赖氨酸乙酰化(H3K9ac),组蛋白H4第5位赖氨酸乙酰化(H4K5ac)
表3 Western Blot检测各组小鼠脊髓中A1AR、H3K9ac、H4K5ac蛋白的表达
2.4 免疫组化观察各组小鼠脑组织中H3K9ac、H4K5ac的表达
图3、表4示,模型组和DPCPX组可见大部分神经元存在较重的胞体皱缩深染现象以及炎性细胞的聚集,中药组与西药组较模型组和DPCPX组轻微。H3K9ac、H4K5ac广泛表达于脑组织细胞内,呈棕黄色或棕褐色染色。与正常对照组比较,模型组H3K9ac、H4K5ac表达量显著升高(P<0.05);与模型组比较,中药组、西药组H3K9ac、H4K5ac表达量显著降低(P<0.05),DPCPX组H3K9ac、H4K5ac表达量显著升高(P<0.05)。

注:组蛋白H3第9位赖氨酸乙酰化(H3K9ac),组蛋白H4第5位赖氨酸乙酰化(H4K5ac),箭头所指为阳性细胞A. 正常对照组; B. 模型组; C. DPCPX组(经腺苷A1受体抑制剂1,3-二丙-8-环戊黄嘌呤干预组); D. 中药组; E. DPCPX+中药组; F. 西药组
表4 免疫组化检测各组小鼠脑组织中H3K9ac、H4K5ac蛋白的表达(光密度值,
2.5 免疫组化观察各组小鼠脊髓组织中H3K9ac、H4K5ac的表达
图4、表5示,模型组和DPCPX组可见神经元丢失,数量减少,炎性细胞聚集,胞体肿胀,胞体皱缩深染的现象;中药组、DPCPX+中药组、西药组较模型组和DPCPX组轻微。H3K9ac、H4K5ac广泛表达于脊髓细胞内,呈棕黄色或棕褐色染色。与正常对照组比较,模型组H3K9ac、H4K5ac表达量显著升高(P<0.05);与模型组比较,中药组、西药组H3K9ac、H4K5ac表达量显著降低(P<0.05),DPCPX组H3K9ac、H4K5ac表达量显著升高(P<0.05)。

注:组蛋白H3第9位赖氨酸乙酰化(H3K9ac),组蛋白H4第5位赖氨酸乙酰化(H4K5ac),箭头所指为阳性细胞A. 正常对照组;B. 模型组;C. DPCPX组(经腺苷A1受体抑制剂1,3-二丙-8-环戊黄嘌呤干预组);D. 中药组;E. DPCPX+中药组;F. 西药组
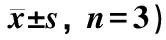
表5 免疫组化检测各组小鼠脊髓组织中H3K9ac、H4K5ac蛋白的表达(光密度值,
3 讨论
与单靶点的化学药物相比,中医治疗疾病以辨证施治、整体观念为基本指导,在防治MS这类多因素复杂疾病方面具有多靶点、多途径、多环节和多向性的独特优势。中医学根据MS的临床表现,多将其归于“痿证”“肌痹”等范畴。病机主要是在肾精不足的基础之上,湿浊内蕴,浊毒内生,毒损督脉,戕害脑髓,络损髓伤,败坏形体而发病,其基本病机是本虚标实,以肾虚为本,浊毒内蕴为标。根据此病机特点,创立益肾、解毒、通络法,制定中药复方益肾达络饮。本方是在中医古方地黄饮子基础之上化裁而来,方中温清并用,补泻兼施,充分体现出中医旨在调节机体达到和谐状态的整体、系统思想。
研究发现表观遗传学与包括MS在内的神经疾病[13]、自身免疫性疾病[14]等多种疾病的发病有着紧密关系。组蛋白修饰是一种非常重要的表观遗传机制,广泛调控基因转录和细胞功能[15]。组蛋白包括H2a、H2b、H3和H4组成的组蛋白8聚体和连接蛋白H1。目前已知的组蛋白修饰包括有乙酰化、泛素化、甲基化、类泛素化等[16]。其中乙酰化主要可以调控基因转录和细胞能量代谢。用组蛋白去乙酰化酶(histone deacetylases,HDAC)6抑制剂处理EAE小鼠,可以推迟疾病的发作并降低疾病的严重程度,同样HDAC3在周围神经雪旺细胞中对依赖性髓鞘形成的控制发挥了重要作用[17],提示EAE的发病与组蛋白乙酰化存在密切关系,组蛋白乙酰化可能是EAE发病的表观遗传机制,亦是EAE潜在的治疗路径。
研究发现,MS患者的外周血和大脑的单核细胞中A1AR表达降低[18-19]。此外,A1AR可以调节EAE中神经炎症和相关脱髓鞘的程度并且糖皮质激素可以上调神经元A1AR的表达,而A1AR的上调降低了EAE的神经功能症状和神经病理学的严重程度[20]。A1AR是一种具有抗炎功能的膜受体[21],其不仅可以发挥神经元保护作用,减少缺氧所致的胶质细胞凋亡,并且能够通过调节免疫活性来维持组织的完整性,参与多种神经系统疾病的发病与治疗[22],抑制A1AR的表达,可以导致炎症反应的扩大,导致少突胶质细胞变性,引起脱髓鞘和轴突缺失。而活化A1AR可以减轻少突胶质细胞的损害,维持髓鞘和轴突的完整。
随着研究的深入,中药对A1AR以及表观遗传的影响也越来越得到关注,研究证明异菝葜皂苷元(知母提取物)可能通过促进脑源性神经营养因子(brain derived neurotrophic factor,BDNF)基因启动子区域的组蛋白H3、H4乙酰化水平,从而调控BDNF基因的转录和表达,起到神经元保护的作用[23]。姜黄素可能降低组蛋白H3乙酰化修饰的水平,减轻海马组织结构的损伤,改善阿尔兹海默症大鼠的认知功能障碍[24]。芍药苷通过A1AR介导的表皮生长因子而促进缺血性损伤后皮质神经元的存活[25]。白果内酯可能通过激活A1AR信号通路,导致细胞骨架重构,改变细胞间紧密连接超微结构,从而可逆性改变血脑屏障的通透性[26]。基于以上研究,说明腺苷A1受体以及组蛋白乙酰化是中药治疗神经系统疾病的重要机制,所以本研究以A1AR为研究靶点,以组蛋白H3、H4乙酰化为研究线路,以期为益肾达络饮治疗MS提供现代科学依据,为研究中医药疗法治疗神经系统疾病提供一条新的思路。
本研究采用MOG多肽联合结核杆菌、百日咳毒素诱导EAE发病,运用DPCPX抑制机体内A1AR的表达,益肾达络饮按照小鼠体重0.2 g生药/10 g干预14 d[27-28]之后,发现在神经功能评分中,正常对照组未见异常,中药组与西药组评分低于模型组。因临床上MS患者大脑、脑干、小脑、脊髓可同时或相继受累,需要影像学确定病变部位,在动物实验上,EAE会累及整个中枢神经系统,具体病理的发生节段无法判断,故Western Blot和免疫组化皆选取全脑及全段脊髓进行检测。结果发现,中药干预可以有效缓解EAE的临床症状。测定脑及脊髓组织中A1AR的表达,发现EAE模型小鼠脑与脊髓中A1AR减少,并且给予DPCPX之后,A1AR进一步减少,而中药和激素的治疗可以升高A1AR,虽然其中中药组脑组织中的A1AR对比模型组无统计学意义,但DPCPX+中药组脑组织中A1AR的表达量显著高于DPCPX组与模型组,说明中药可以升高EAE小鼠体内A1AR的表达。即中药可以活化A1AR,导致EAE小鼠脑及脊髓中A1AR表达量上升,从而减轻EAE临床症状,发挥抗炎及神经保护的作用。
进一步研究益肾达络饮对于EAE小鼠表观遗传修饰的影响,发现EAE模型小鼠中H3K9ac、H4K5ac的表达量升高,拮抗A1AR之后H3K9ac、H4K5ac的水平进一步升高,而给予中药或激素治疗可以降低H3K9ac、H4K5ac的表达水平,其中Western Blot法检测脊髓组织中H3K9ac、H4K5ac的表达,中药组与模型组未发现统计学意义,其原因可能为样本量不够多,但免疫组化法检测脊髓组织中H3K9ac、H4K5ac的表达,中药组明显低于模型组。基于以上结果,提示减少组蛋白H3、H4的乙酰化可以改善EAE的疾病状态,活化A1AR可以降低组蛋白的乙酰化水平,所以益肾达络饮可能通过活化中枢神经细胞膜上的A1AR,改变了细胞内一系列的信号转导,将信号传导至细胞核内,导致下游基因表达发生改变,降低组蛋白H3、H4的乙酰化水平。即通过影响膜受体A1AR改变细胞核内的组蛋白修饰,启动调节基因转录的表观遗传学机制,从而改变EAE的症状。
神经炎症在某种程度上可视为湿浊之毒,结于脑络,损害脑髓,益肾达络饮通过活化A1AR从而抑制神经炎症,达到化浊通络解毒之效。表观遗传修饰是中医整体观,天人相应的一种体现,自然环境等变化可以引起机体基因表达调控的改变,益肾达络饮通过调节机体阴阳失衡,影响人体表观遗传机制,调节组蛋白修饰,从而达到治疗EAE的目的。中药治疗MS具有确切的疗效,但是其详细的作用机制尚需不断探索,本研究表明膜受体A1AR及其所影响的核内组蛋白修饰可能是机制之一,后续研究会进一步摸索中药的最佳用药剂量、中药对膜受体诱导的具体信号转导通路以及下游基因表达的影响,以期完善对益肾达络饮治疗MS的机制探索。
