基于过硫酸盐高级氧化技术降解抗生素的研究进展
2023-11-03杨直渝许镇浩张晓蝶
杨直渝, 朱 科, 许镇浩, 张晓蝶, 严 凯, 2, *
(1. 中山大学 环境科学与工程学院, 广东 广州 510006;2. 华南农业大学 岭南现代农业科学与技术广东省实验室, 广东 广州 510642)
0 引 言
为了满足当前我国社会发展的医疗健康需求,保证畜牧业、农业、水产养殖业的稳定发展,抗生素药物被批量生产,并用于生物体疾病的医治与防治[1-2]。在此过程中,因人类对抗生素药物的滥用及其在生物体内的不完全代谢,而导致大量的抗生素仍以母体分子结构的形式存在于生活废水、医疗废水、养殖废水等自然水体中[3]。这些残留的抗生素会对人体造成潜在伤害,因此亟需开发经济的、高效的、环境友好的处理工艺应对水体抗生素污染物[4-6]。
本综述将基于过硫酸盐高级氧化技术降解抗生素的研究进展,首先详细介绍国内抗生素药物污染状况,然后系统阐述过硫酸盐的活化体系,深入探讨过硫酸盐高级氧化技术对抗生素降解的机理,最后对存在的问题进行了分析,对未来研究方向进行了展望。
1 抗生素药物概述
1.1 抗生素使用现状
随着世界范围内医药行业的发展,2000年至2015年期间,以限定日剂量[15]表示的抗生素消费量增加了65%,抗生素消费率增加了39%。目前,我国的抗生素产能与消费体量均居世界前列[16-17]。在我国的医疗体系下,β-内酰胺类(BLAs)、喹诺酮类(FQs)、四环素类(TCs)、大环内酯类(MLs)以及磺胺类(SAs)等抗生素药物的应用最为广泛[18]。据报道,2013年中国的抗生素总用量约为16.2万t,人类消耗的抗生素约占抗生素总量的48%,其余部分由动物消耗。其中,SAs、TCs、FQs、MLs、BLAs和其他抗生素分别占总使用量的5%、7%、17%、26%、21%和24%。受人口密集程度、医疗业、制药业、农业发展水平等因素的影响,华东地区对上述五大类抗生素(其他抗生素除外)的消费量较大(38 800 t),西北地区的消费体量较小,仅有2 360 t[19-20]。
1.2 抗生素污染现状
中国已成为一个药品产量和使用量的大国,这可能会使抗生素在环境中显著存在。2005—2016年期间,在中国主要河流和海洋水样中共检测了94种抗生素。这些抗生素可分为五大类(包括SAs、FQs、TCs、MLs和β-Ls)和其他抗生素[21]。中国七大河流四海报告的抗生素覆盖率如图1所示,在河流和沿海水样中分别检测到88种和45种抗生素。水样中抗生素总含量依次为海河(Hai River,65),长江(Yangtze River,61),珠江和辽河(Pearl River and Liao River,39),黄海(Yellow Sea,33),南海和渤海(South China Sea and Bohai Sea,28),黄河(Yellow River,21),淮河(Huai River,7),松花江(Songhua River,5),东海(East China Sea,3)。此外,LIU等[22-25]系统综述了中国主要湖泊水环境的抗生素污染现状。在典型的湖泊地表水中(鄱阳湖、洞庭湖、太湖、滇池和巢湖等)共检测到37种抗生素,其中包括14种SAs、9种甲氧苄啶类(TMP)、5种FQs、5种TCs、6种MLs和2种林可酰胺类,检出抗生素的浓度范围为0~940 ng/L,并且发现FQs抗生素对湖泊具有较大的生态环境风险。
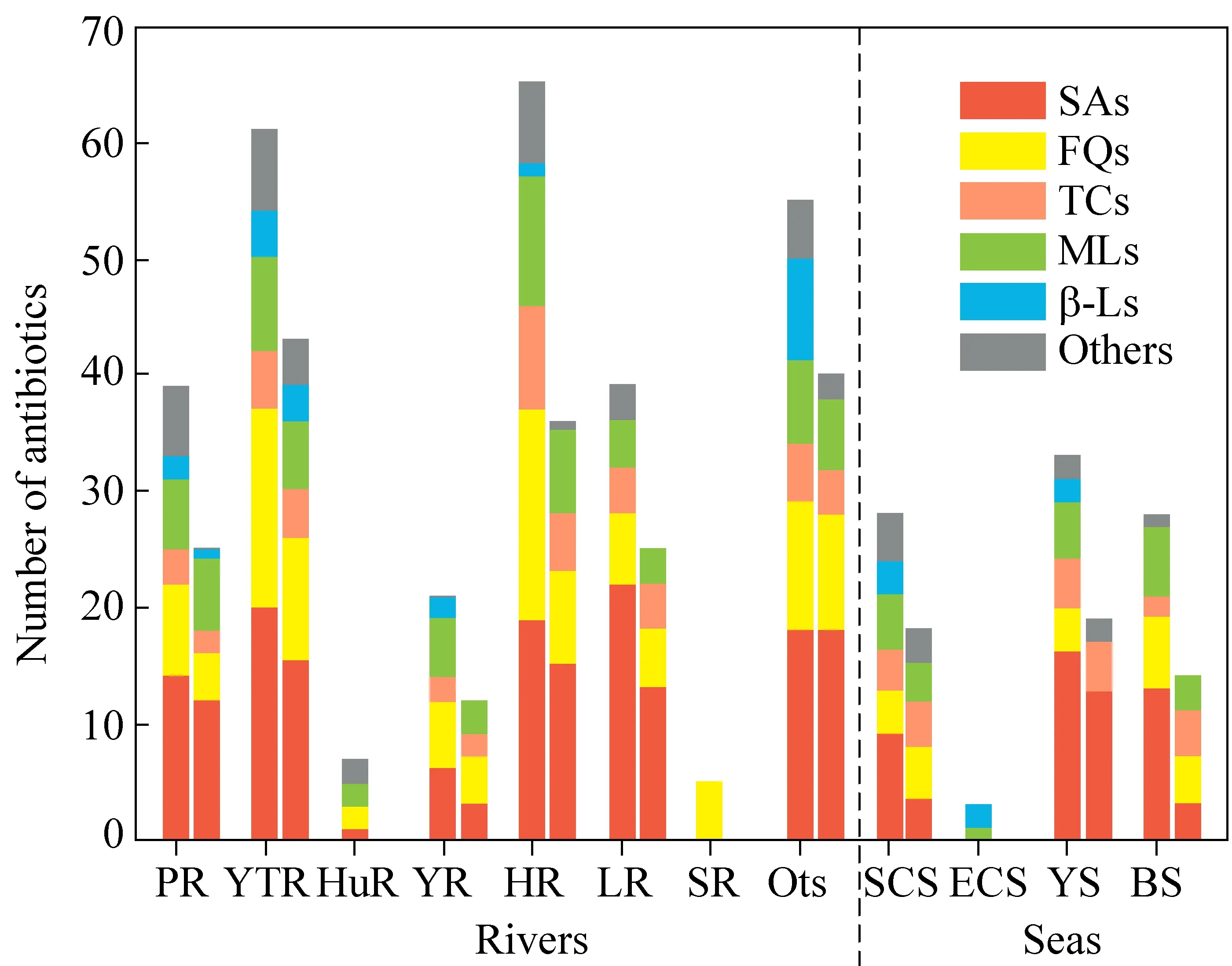
图1 中国主要河流和海洋中报告的抗生素数量[21]Fig. 1 Numbers of reported antibiotics in major rivers and sea in China[21]
1.3 抗生素的特性
在早期,抗生素被定义为微生物或高等植物在生命活动过程中产生的某些次级代谢产物,其对细菌具有抑制或灭杀作用,因此也被称为抗菌素。然而随着医学技术的不断进步,抗病毒、抗肿瘤等抗生素药物的出现,说明抗生素药物同样能够抑制病毒与癌细胞的生长、繁殖及代谢[26]。因而,科研人员进一步将抗生素的定义完善为:微生物在生产活动中,产生对其他病原性微生物具有抑制作用的一类化学物质即为抗生素(包括合成及半合成产品)。
目前,根据抗生素分子在化学结构上的差异,主要分为FQs、TCs、BLAs、MLs以及SAs等五大类药物抗生素[27]。抗生素一般为复杂的大分子结构,含有大量的功能官能团。在不同的pH条件下,抗生素可以是中性、阳离子、阴离子或两性离子的分子。因此,由于单个分子的功能不同,它们的理化和生物学性质、吸附行为、光反应性、抗生素活性和毒性等也可能随pH而变化,这也是在抗生素污染治理过程中需要关注的内容[28]。由于细菌和哺乳动物细胞的差异,特别是结构和代谢的差异,使得抗生素药物能够对细菌有机体选择性产生毒性,通常对宿主细胞不会造成明显损害[29-30]。
1.4 抗生素污染的来源及迁移途径
抗生素在生产源头、使用过程以及后续处理过程,都会造成不同程度的残留。如图2所示,可以将抗生素污染的来源及转移路径主要分为以下三条路线。

图2 抗生素污染来源及迁移路径[35]Fig. 2 The antibiotic contamination sources and migration paths[35]
一是抗生素生产过程的污染及迁移途径。抗生素生产企业为了满足全球不断增长的抗生素使用需求,不断地提升其产能的同时,也不断地排放着含有大量抗生素药物及制药原料的废水。这部分废水虽然通过污水处理系统进行处理,但是,由于抗生素分子本身的生化难降解性及生物毒性等特征,很难被现有的污水处理系统完全降解和矿化[31]。此外,传统的污水处理厂通常不设专门的抗生素处理模块,使得抗生素在传统污水处理厂中难以去除[32]。污水处理厂中残留的抗生素一部分通过出水排出,进入地表自然水体,进而通过地下渗流进入地下水。另一部分残留的抗生素及其衍生物吸附在生物污泥(活性污泥、颗粒污泥等)中[33]。含抗生素污泥经过堆肥、发酵等过程形成有机肥,其中的抗生素由施肥过程进入土壤环境中,最终通过地表径流及地下渗流进入地表水/地下水环境中[17]。
二是人类医疗活动产生的抗生素污染及迁移途径。生产的抗生素用以人类医疗活动时,由于人体对抗生素的不完全吸收与代谢,其中大部分通过尿液与粪便的形式,流入生活废水中。医院作为用药大户,在疾病医治过程中会产生大量含抗生素医疗废水。这部分废水中的抗生素同样会因污水处理厂的不完全降解,被排入自然水环境中。此外,我国农村地区分布较广,农村地区多以化粪池的形式对粪便与尿液进行资源化处理。因此,农村地区尿液与粪便中的抗生素多由堆肥、还田过程进入土壤环境中,进而通过地下渗流流入地下水环境。需要注意的是,对于以固体废物形式处理的未使用抗生素、过期抗生素、抗生素包装物,其中残留的抗生素会以垃圾渗滤液的形式进入水环境中[27]。
三是农业及养殖业产生的抗生素污染及迁移途径。农业、畜禽养殖、水产养殖、特种养殖等涉农行业对抗生素的消耗正成为水体抗生素污染的主要来源。尤其是对于发展中国家,农业作为支柱性产业,体量庞大。农民作为农业发展的主体,通常缺乏对应的专业知识技能,对于适用抗生素的种类及用量缺乏科学依据,这很容易造成施加抗生素的种类繁杂、用量不明、药效有限,进而过量施加抗生素的局面。特别对于水产养殖业,无法对养殖对象的药物摄入量实现定量控制,在实际养殖过程中往往需要过量投加,才能保证对疾病的医治与防治,最终导致大量的抗生素药物直接进入水体环境中[34]。
此外,陆地种植与畜禽养殖等产业也是抗生素污染的主要源头。陆地种植使用后的农用抗生素(杀菌剂、杀虫剂、除草剂),多沉积于土壤表面,由微生物代谢分解一部分,剩余部分通过水循环系统进入自然水体,还有少部分抗生素可由植物吸收,当含有抗生素的植物可被人类或动物食用时,抗生素分子又可通过食物链进一步迁移[36]。畜禽养殖所用抗生素主要残留于畜禽排泄物中,通过堆肥还田、地表径流、地下渗流等方式进入天然水/土壤环境中,造成抗生素污染。尽管如此,我国分布广泛的陆地养殖产业,其庞大的抗生素消费量,依旧对大部分江河流域造成了严重的抗生素污染[37-39]。
1.5 抗生素对环境的危害
自然界中,微生物长期暴露在高剂量抗生素的环境中,会加快抗生素抗性基因(ARG)和抗生素抗性细菌(ARB)的产生,加速抗生素抗性的传播,进一步使得抗生素药物在使用过程中药效减弱,甚至失效。从而对医疗业、农业、水产养殖业等行业造成严重威胁。耐药性的发展是微生物的正常进化过程,但是自然环境中长期存在的高剂量抗生素残留而产生的选择压力会加速耐药性的发展。世界卫生组织(WHO)建立的全球细菌耐药性监测网络,在2014年的监测报告中说明细菌耐药性的提高可能与较大的抗生素用量有关[40]。ZHANG等[41]通过对数线性回归分析证实了北京市温榆河流域中FQs、TCs和SAs的浓度与大肠杆菌对FQs(p<0.05)、TCs(p<0.05)和SAs(p<0.05)的耐药性密切相关。
除耐药性之外,抗生素对非目标生物的潜在生理效应也值得特别关注。ARISTILDE等[42]研究表明,喹诺酮类抗生素可能对光合生物产生生态毒理学影响。喹诺酮类抗生素中的喹诺酮环和仲氨基可作为光系统Ⅱ中的醌位抑制剂,从而抑制光合生物的光合作用,影响其生长发育。此外,大部分的喹诺酮类抗生素都具有遗传毒性,尤其是第三代和第四代喹诺酮类抗生素均会引起遗传毒性[43]。MARINA等[44]研究了红霉素、土霉素、磺胺甲恶唑、氧氟沙星、林可霉素、克拉霉素6种抗生素对水体生物的生态毒性。结果表明,氧氟沙星是唯一的遗传毒性化合物,磺胺甲恶唑、氧氟沙星和林可霉素具有致突变作用。在环境风险方面,大环内酯类化合物对水环境的危害最大。此外,环丙沙星、红霉素、磺胺甲恶唑等抗生素可对水蚤产生光毒性,破坏软体动物的免疫系统,还会影响鱼类早期的正常发育过程[45-46]。
2 过硫酸盐高级氧化技术
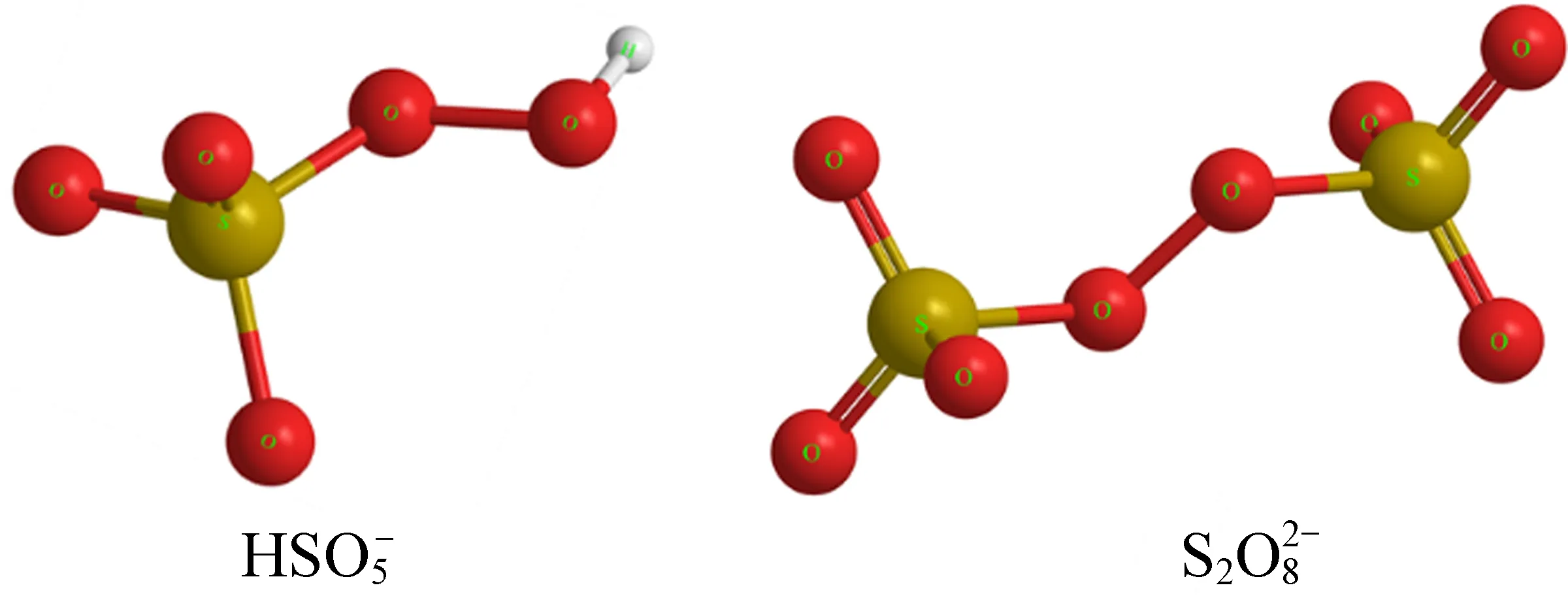
图3 PMS与PDS的分子结构图Fig. 3 The molecular structure of PMS and PDS
2.1 能量输入型的均相活化体系
2.1.1 热活化
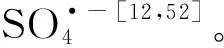
2.1.2 辐射活化

(1)
H2O + UV → ·H + ·OH
(2)
(3)
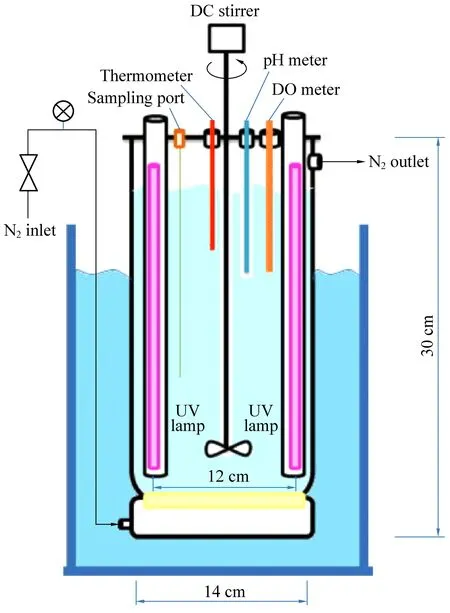
图4 降解PVA的光反应器[55]Fig. 4 photoreactor for degradation of PVA[55]
2.1.3 超声活化

以上能量输入型的均相活化方式虽然运行原理简单,运行方便,但在实际应用过程中均存在能耗高、设备成本高等局限性,经济效益与环境效益失衡,不具备大规模实际应用的潜力。
2.2 基于金属催化剂的非均相活化体系
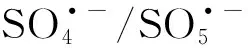
(4)
(5)
(6)
(7)

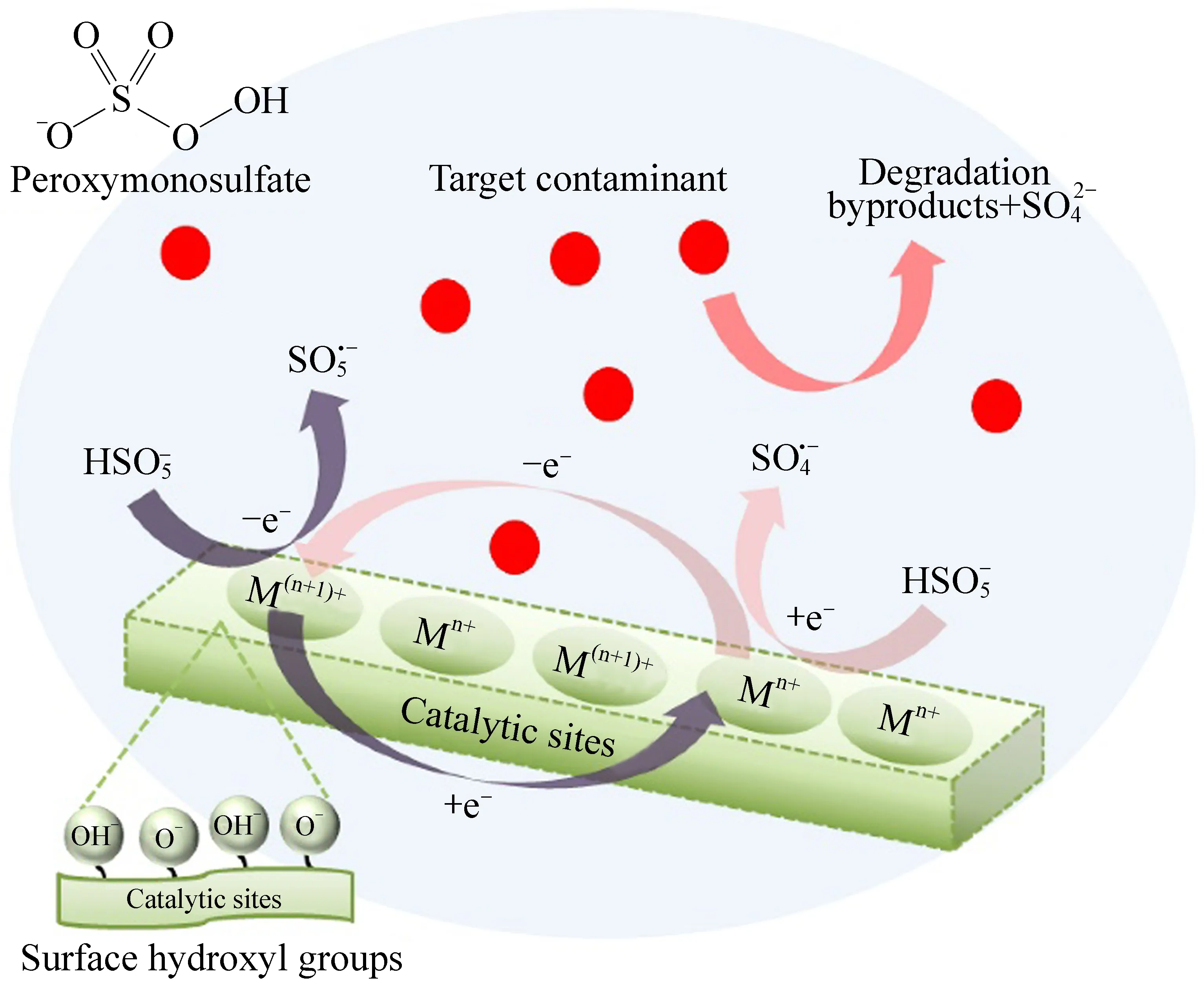
图5 PMS与非均相过渡金属催化剂的氧化还原反应[63]Fig. 5 The redox reaction involving PMS and heterogeneous transition metal catalyst[63]
Fe2++ Co3+→ Fe3++ Co2+(E°=1.04 V vs. NHE)
(8)

金属硫化物由于S2-的存在可作为电子供体促进金属离子的变价循环,在激活PMS时也有其独特的优势。XU等[72]建立了一种基于硫化铁(FeS)的PMS活化体系,用于氯霉素(CAP)、甲砜霉素(TAP)、环丙沙星(CIP)以及诺氟沙星(NOR)抗生素的降解(浓度均为30 μmol/L)。由于S2-可作为电子供体促进Fe(III)的连续还原和Fe(II)的再生,进一步提高PMS的激活效率。在FeS(0.6 g/L)/PMS(6 mM)系统中(初始pH=7),CAP、TAP、CIP以及NOR在120 min内的去除率分别达到93.5%、98.5%、100%和100%。
2.3 基于非金属催化剂的非均相活化体系
考虑到金属离子浸出等弊端,研究人员开始针对非金属催化剂激活PMS进行研究。如图6所示,非金属PMS活化剂研究最为广泛的是碳基材料(包括:活性炭(AC)、生物炭(BC)、氧化还原石墨烯(rGO)、碳纳米管(CNTs)等)。有研究表明当氧化还原石墨烯(rGO)用作PMS活化剂时,其中的含氧官能团(包括富电子的亲核酮基和喹啉基)可作为有效的活性位点,将PMS激活产生ROS降解污染物(式9,式10)。然而,相较于rGO与CNTs,多孔活性炭(AC)与生物炭(BC)更为廉价易得,具有较高的比表面积和丰富的PMS催化活性部位,如醌、酮、羰基和羧基等,使得其在PMS活化体系中的应用前景更为广泛。可在高效吸附污染物的同时,激活PMS产生ROS,进而直接在碳表面进行氧化降解反应,有效的减少污染物与ROS之间的传质距离,实现污染物的高效去除。一般来说,AC激活PMS的机制是由离域的电子介导,如式11和式12。然而,由于AC的强吸附能力,污染物降解过程形成中间副产物与积碳对其吸附性能的负面影响会更显著,并且羧基、羰基、醌、内酯和酚等催化活性位点易受到PMS和生成的ROS攻击氧化、失活。因此,AC的循环稳定性通常较差,在使用后需要热处理或者化学活化的方式,使其恢复吸附及催化活性。
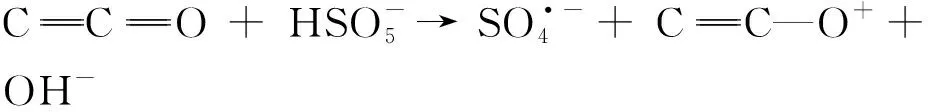
(9)
(10)
(11)
(12)
杂原子掺杂(例如氮(N)、磷(P)、硫(S)、硼(B))可进一步增强碳基催化剂的催化活性。杂原子掺杂碳基催化剂具有以下优势:(i)增加缺陷边缘;(ii)通过共轭提高π-电子迁移率;(iii)改变局部碳原子中的电子密度;(iv)引入新的催化活性位点和功能(如:选择性吸附位点);(v)增加表面亲水性,加速电子转移反应。有研究表明,N、S共掺杂rGO在PMS活化体系中降解苯酚的表观反应速率常数为(0.043 ± 0.002) min-1,分别是氧化石墨烯(GO)、rGO、S掺杂rGO和N掺杂rGO的86.6、22.8、19.7和4.5倍[73]。N掺杂单壁碳纳米管的PMS/PS催化活性是未掺杂单壁碳纳米管的2倍,因为N掺杂可以诱导非自由基氧化,并且掺杂的N原子可作为电子桥,有助于PMS氧化吸附水生成·OH进行催化氧化[74]。
2.4 基于金属-非金属复合催化剂的非均相活化体系
对于PMS活化体系而言,单独的应用金属催化剂或非金属催化剂都存在一定的弊端,主要包括:金属离子浸出导致的二次污染;金属催化剂制备过程的聚集导致金属活性位点利用率低;非金属催化剂的回收困难;非金属催化剂的催化活性较差和不稳定;催化活性位点易被氧化而失活等。如图7所示,为克服以上弊端,将金属/非金属催化剂进行合理的搭配形成的复合催化剂,成为一种可行的手段。其中,将金属催化剂负载于高比表面积、高稳定性的载体上,可有效抑制金属活性中心的聚集。同时,复合催化剂在一定程度上可延续载体的高比表面积特性,有利于后续ROS与污染物之间的传质反应。同时金属/非金属复合催化剂之间的强相互作用可进一步抑制反应过程中的金属离子浸出,保持复合催化剂的高活性与高稳定性。此外,当强磁性的金属氧化物与载体复合时,可提高复合催化剂的回收率,降低回收成本。
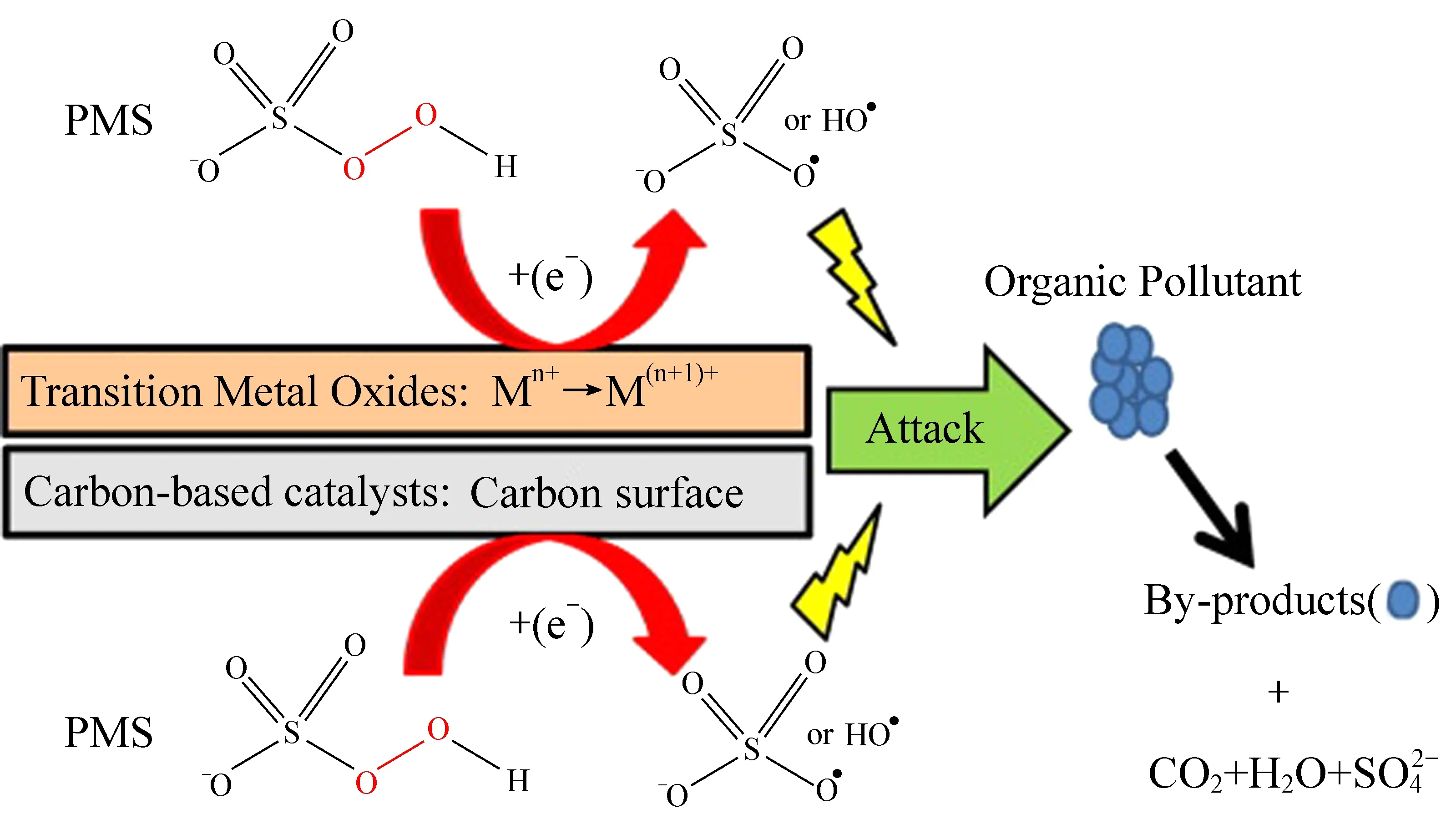
图7 金属-非金属复合催化剂活化PMS的方案[79]Fig. 7 The scheme of metal-nonmetallic composite catalyst activation of PMS[79]
目前,钴基碳材料是活化PMS降解水中有机污染物最有效的金属/非金属复合催化剂之一。LI等[76]以邻苯酞菁与三聚氰胺为前驱体,制备了一种N配位的Co基碳质材料。其中,N原子的强配位显著提高了Co的稳定性,减少了循环使用过程中的Co浸出(在pH为4~9范围内,Co浸出量仅为89.5~45.4 μg/L),并且前驱体中Co酞菁的存在有利于Co在碳基质中的均匀分布,提高其催化活性位点的利用率。其中Co修饰的N改性多孔炭活化PMS可在15 min实现苯甲酸的全部降解,远高于单独的N改性多孔炭的催化活性(<8%,反应15 min)。TAN等[77]采用柠檬酸盐燃烧法制备的多孔磁性CoFe2O4/硅藻土催化剂(CFD)。由于CFD的高比表面积、表面羟基分布广泛、良好的晶体分散性和丰富的表面活性中心,使得CFD活化PMS对双酚A(BPA)的降解性能优于纯CoFe2O4,并且CFD具有优异的磁性性能、较低的金属溶出率和良好的循环稳定性。XU等[78]发现石墨烯基CoFe2O4比单纯的CoFe2O4具有更强的PMS活化能力,对增塑剂的去除效率更高。得益于石墨烯载体的高比表面积能够有效的吸附水中污染物,实现污染物的预富集,提高了后续降解过程中ROS与污染物之间的传质效率。
3 过硫酸盐高级氧化技术的降解机理
如图8所示,通常过硫酸盐活化过程中产生的反应活性物质随活化方法而变化。目前提出的过硫酸盐高级氧化技术降解抗生素的机理主要有两种。一是自由基机制,包括羟基自由基、硫酸根自由基和超氧自自由基;二是非自由基机制,包括单线态氧、高价金属物种和介导电子转移机制。
3.1 自由基机制
3.1.1 羟基自由基
羟基自由基主要通过抽氢和羟基化降解有机污染物[81],而硫酸根自由基主要通过电子转移机制降解有机污染物[82]。例如,在羟基自由基驱动的过程中,脂肪族羧酸的第一步是氢的提取,这通常会导致碳中心自由基的形成,碳中心自由基可以进一步发生氧化反应。在硫酸根自由基驱动过程中,脂肪族羧酸首先发生电子抽离,通常会形成羧基,进而转化为烷基自由基和二氧化碳。同样,对于芳香族羧酸,羟基氧化过程通常发生羟基化,硫酸根基氧化过程通常发生脱羧[83]。
3.1.2 硫酸根自由基
与羟基自由基相比,硫酸根自由基具有更高的选择性。例如,羟基自由基与腐殖酸的反应速率约为104 L·mg·C-1,而硫酸根自由基与腐殖酸的反应速率约为103 L·mg·C-1[84]。此外,硫酸根自由基对芳香族化合物的取代基高度敏感[85],但是取代基的类型会影响芳香族化合物的反应途径。例如,当取代基作为电子供体时,硫酸根自由基第一步氧化后生成的芳基阳离子可以重新排列发生侧链氧化[86]。相比而言,当取代基可以作为电子受体时,卤芳基阳离子更容易脱卤。值得注意的是,虽然羟基自由基(2.6 V)和硫酸根自由基(2.6~3.1 V)具有相似的氧化还原电位,但有机化合物与羟基自由基(108~109 M-1·s-1)的反应速率通常高于与硫酸根自由基(106~107 M-1·s-1)的反应速率[87]。
3.1.3 超氧自由基
超氧自由基可以通过最初的氢提取步骤诱导有机物的降解,这通常导致碳基自由基的形成。碳基自由基能与氧结合形成过氧中间体。随后,过氧中间体的分解可导致降解产物的形成[88]。一些研究报道了超氧自由基是降解有机化合物如双酚A和染料的主要活性物质。此外,超氧自由基可以破坏碳原子和氯原子之间的键,从而形成脱氯产物[89]。
3.2 非自由基机制
3.2.1 单线态氧
单线态氧是一种高度选择性的氧化物种,可通过亲电攻击和电子抽离氧化不饱和有机化合物。研究表明单线态氧能与烯烃发生反应,且降解产物随烯烃结构的不同而不同。对于含有给电子基团的酚类化合物,单线态氧可以作为电子受体形成超氧自由基。同时,酚类化合物可产生相应的酚自由基,这些酚自由基可进一步与氧结合或重排生成类醌和开环产物[90]。
3.2.2 高价金属物种
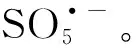
(13)
(14)
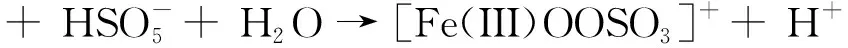
(15)
(16)

(17)
3.2.3 介导电子转移机制
氧化剂PMS/PDS首先可以在催化剂的活性位点上形成亚稳态复合物,然后污染物将电子通过复合体等“平台”传递给氧化剂而被氧化去除。DUAN等[94]报道了在N掺杂的碳纳米管/PMS系统中形成表面受限的ROS,它可以通过导电隧道的电子提取直接攻击污染物。在这些反应中,PMS首先由石墨碳中的共轭π体系吸附以产生亚稳态复合物,从而通过电子转移直接攻击污染物。此外,DUAN等[95]制备了原子级的Fe分散在g-C3N4上,通过活化PMS降解邻苯基苯酚。经过一系列实验,单原子Fe-N-C/PMS体系表现出了一种不同于普通铁基催化剂的电子转移介导机制。特别是,PMS可以稳定地吸附在单原子Fe—N—C键上,而不是自发分解。孤立的铁位点锚定在g-C3N4上可以通过减少催化剂的带隙来增强电子转移,提高PMS的利用效率。DFT进一步揭示了具有N、O不饱和配位的高度分散的Fe可以作为PMS活化和吸附的反应位点。有趣的是,除了氧化剂的高利用率,介导电子转移机制也表现出优异的耐盐性。
4 结语与展望
基于过硫酸盐的高级氧化技术(SR-AOPs)是一种新兴的高级氧化手段,可以通过不同方法来活化过硫酸盐产生ROS高效降解水中抗生素。虽然目前可以使用许多方法来激活PMS/PDS,但实际应用还有很长的路要走。在未来研究中,仍需聚焦以下几个方面开展探索:(1)目前的研究工作多在实验室模拟废水中进行,虽然已取得较好的降解效果,但是对于复杂多变的实际废水,该体系的适用性还是有待研究。所以需进一步探究其对实际医药废水以及畜禽养殖废水中抗生素药物的降解效果。(2)实际水体中的抗生素药物污染浓度通常达到ng/L或μg/L级别。低浓度的抗生素药物不利于ROS与污染物之间的传质接触。因此,需对这类具有高危害性的痕量抗生素污染物进行预富集,更好发挥降解体系的优势。(3)尽管SR-AOPs较宽的pH适用范围是一个优势,但提高矿化率和降低毒性是去除污染物的关键指标。因此,为了达到适当的矿化率,低毒性的产物以及高的去除效率等指标,需要进行更多的优化研究。(4)SR-AOPs可能会形成有毒的中间产物,或者氧化剂和催化剂残留在反应溶液中,会对水体造成不利影响。可以进一步优化工艺中使用的化学氧化剂和催化剂的剂量,以免影响后续步骤。(5)自由基途径矿化能力强,而非自由基途径反应过程温和、抗干扰能力强及特异性高,对于催化剂设计,可能需要根据不同的水质,以更加合理地控制活化途径。(6)活化PS/PMS体系与其他处理技术(如辐射、臭氧和超声等)相结合,提升SR-AOPs的处理效能。(7)废水处理中所需的高浓度过硫酸盐氧化剂导致水体中有大量的硫酸根离子生成,需要研究和关注。
