健脾益心方对心肌梗死大鼠炎症及心室重塑的影响
2023-11-03向密路迎冬张洋辛来运崔向宁
向密,路迎冬,张洋,辛来运,崔向宁
中国中医科学院广安门医院,北京 100053
心肌梗死(myocardial infarction,MI)是由冠状动脉缺血缺氧导致的心肌组织损伤或缺血性坏死,其发病率和病死率高,病情进展迅速,预后差[1]。心肌重构由MI后一系列病理改变引起或加重,病理表现为心肌肥厚和纤维化,导致心功能障碍、心力衰竭、恶性心律失常,甚至心源性死亡[2-4]。尽管多种技术广泛应用于临床治疗,但仍缺乏更有效的方法[5]。
研究发现,炎症反应参与心肌损伤的发展变化,炎症细胞可通过细胞表型转化、分泌细胞因子和生长因子等影响心脏炎症、梗死面积和心肌纤维化,加重心肌损伤,导致心室重塑,损害心功能[6]。中药可通过多成分、多靶点、多途径综合干预,一定程度上控制炎症反应和心室肥大,抑制急性MI后心室重塑[7]。心脾失调是病理产物“痰”“瘀”产生的直接病因,作为后天之本的脾是MI及MI后心力衰竭发病的重要脏腑。故推测可用祛湿化饮法治疗MI,拟健脾益心方。该方由益气补虚之保元汤[8]与健脾利湿之苓桂术甘汤[9]化裁,有益气健脾、利水行瘀功效,可显著改善心力衰竭患者临床症状、活动耐量及生活质量,改善心功能,减轻炎症[10]。本研究通过左冠状动脉前降支结扎法建立MI大鼠模型,并予健脾益心方干预,观察其对大鼠炎症及心室重塑的影响,明确该方治疗MI 的作用机制。
1 实验材料
1.1 动物
SPF级雄性SD大鼠27只,体质量200~220 g,北京华阜康生物科技股份有限公司提供,动物生产许可证号SCXK(京)2020-0004。饲养于中国中医科学院广安门医院实验动物中心SPF级实验环境,温度20~25 ℃,湿度40%~60%,自然光照循环,自由摄食饮水。实验过程按照《实验动物管理和使用规定》进行,并经中国中医科学院广安门医院动物伦理委员会审批(IACUC-GAMH-2022-041)。
1.2 药物
健脾益心方(黄芪30 g,人参10 g,桂枝10 g,茯苓30 g,麸炒白术15 g,泽泻30 g,丹参20 g,大腹皮15 g,葶苈子15 g,当归15 g),饮片由中国中医科学院广安门医院中药房提供,均符合《中华人民共和国药典》规定。按用量取上述中药饮片,加入蒸馏水浸泡30 min,煎煮30 min,过滤,残渣加蒸馏水,继续煎煮30 min,过滤,合并2次滤液,浓缩成含原药材1.9 g/mL药液,分装后置于4 ℃冰箱保存备用。
1.3 主要试剂与仪器
HE 染色试剂盒,货号G1120,北京索莱宝;Masson染色试剂盒,货号BA4079B,珠海贝索生物;4%多聚甲醛,货号P1110,北京索莱宝;TUNEL染色试剂盒,货号11684795910,瑞士Roche;RIPA 裂解液,货号R0010,北京索莱宝;BCA蛋白定量试剂盒,货号PC0020,北京索莱宝;ECL 发光液,货号1705062,美国Bio-Rad;凝胶制备试剂盒,货号161-0183,美国Bio-Rad;10×TBST缓冲液,货号T1081,北京索莱宝;5×蛋白上样缓冲液,货号P1040,北京索莱宝;5×Tris-甘氨酸电泳缓冲液,货号T1070,北京索莱 宝; Bcl-2 抗 体, 货 号26593-1-AP, 美 国Proteintech;Bax 抗体,货号WL01637,沈阳万类生物;细胞色素c(Cytc)抗体,货号11940S,美国CST;Cleaved Caspase-3 抗体,货号9664S,美国CST;NOD 样受体蛋白3(NLRP3)抗体,货号R30750,美国NSJBIO;凋亡相关斑点样蛋白(ASC)抗体,货号DF6304,美国Affinity Biosciences;Caspase-1抗体,货号sc-392736,美国Santa Cruz;核因子(NF)-κB p50抗体,货号ab32360,英国Abcam;白细胞介素(IL)-6抗体,货号ab9324,英国Abcam;IL-1β抗体,货号AF5103,美国Affinity Biosciences;辣根过氧化物酶标记羊抗兔IgG,货号bs-40295GHRP,北京博奥森;辣根过氧化物酶标记山羊抗小鼠IgG,货号A0216,上海碧云天。
ALC-V8S 小动物呼吸机,上海奥尔科特;Vevo2100超高分辨率动物专用超声成像系统,加拿大Visual Sonics;CKX53 荧光显微镜,日本Olympus;Mini-PROTEAN 凝胶电泳系统,美国Bio-Rad;DocTMXR+凝胶成像系统,美国Bio-Rad;BY-R20高速离心机,北京白洋医疗器械有限公司;Milli-Q Advantage A10超纯水系统,美国Millipore;Spark®多功能酶标仪,上海Tecan;EG1150 包埋机,德国Leica;SM2010R病理切片机,德国Leica。
2 实验方法
2.1 造模、分组及给药
随机选取18只大鼠,采用左冠状动脉前降支结扎法制备MI模型[11-13]。大鼠腹腔注射戊巴比妥钠40 mg/kg麻醉,气管插管,侧开胸暴露心脏,用5-0手术缝合线在左冠状动脉前降支距左心耳边缘下2~3 mm处结扎,稳定后可见心脏表面变白。关胸,缝合皮肤。次日检测大鼠术后24 h心电图,根据病理性Q波判断造模是否成功。另取9只作为假手术组,操作相同,但缝合线仅穿过左冠状动脉,不结扎。术后将存活且造模成功的大鼠随机分为模型组和健脾益心方组,每组9只。
造模成功后开始给药,按人与大鼠换算系数计算给药剂量,健脾益心方组予健脾益心方药液19.95 g/kg灌胃,灌胃体积10.5 mL/kg,每日1次,连续4周。假手术组和模型组予等体积生理盐水灌胃。
2.2 超声心动图检测
给药结束后,通过无创超声心动图评估大鼠心脏结构和功能。称量大鼠体质量,腹腔注射戊巴比妥钠(40 mg/kg)麻醉后,于乳头肌水平记录左室长轴二维超声心动图,测量左室射血分数(LVEF)、左室短轴缩短率(LVFS)、左室舒张末期前壁厚度(LVAWd)、左室收缩末期前壁厚度(LVAWs)、左室舒张末期内径(LVIDd)、左室收缩末期内径(LVIDs)、左室舒张末期容积(LVEDV)和左室收缩末期容积(LVESV)。以上参数均测量3 个心动周期,取平均值作为最终结果。
2.3 标本采集
超声心动图检测后,于大鼠腹部纵向切口,逐层打开腹腔,轻轻拨开腹腔脏器后进行腹主动脉取血。采血后迅速打开大鼠胸腔,取出心脏,去除其他附着物,用冷生理盐水冲洗干净,称量心脏质量,计算心脏质量比(心脏质量/体质量),评估心脏肥大情况。在最大横径处横切成2部分,心底部分用4%多聚甲醛固定,用于组织病理形态观察和免疫组化检测,心尖部分置于-80 ℃保存,用于Western blot检测。
2.4 心肌组织病理观察
心肌组织经4%多聚甲醛固定过夜后,脱水透明,石蜡包埋,切成4 μm切片,分别行HE 和Masson 染色,光学显微镜下观察心肌组织病理变化,用Image J软件计算心肌纤维化面积比(阳性染色面积÷总面积×100%),评估心肌纤维化严重程度。
2.5 TUNEL染色
心肌组织石蜡切片先用二甲苯浸洗5 min×2次,梯度乙醇(100%、95%、90%、80%、70%)分别浸泡3 min,PBS漂洗3次,加Proteinase K工作液处理,待玻片干后,加TUNEL 反应液50 μL,PBS 漂洗3 次,荧光显微镜下观察,采用Image J软件分析心肌细胞凋亡率(凋亡细胞数÷总细胞数×100%)。
2.6 Western blot检测
取心肌组织,加入RIPA裂解液提取蛋白,BCA法进行定量分析。以20 μg蛋白上样,经10%凝胶电泳分离,将蛋白转移至PVDF膜,用5%脱脂奶粉室温封闭2 h,加Cytc一抗(1∶1 000)、Cleaved Caspase-3一抗(1∶1 000)、Bax 一抗(1∶700)、Bcl-2 一抗(1∶500)、NLRP3一抗(1∶500)、ASC一抗(1∶1 000)、Caspase-1一抗(1∶500)、IL-1β一抗(1∶1 000)、IL-6一抗(1∶1 000)和NF-κB p50一抗(1∶5 000),4 ℃孵育过夜。次日将膜与二抗(1∶10 000)在室温孵育1 h。ECL法曝光,凝胶成像系统成像,使用Image J软件进行分析,以GAPDH或β-tubulin为内参,计算目的蛋白相对灰度值。
2.7 免疫组化染色
石蜡切片加热煮沸3 min热修复抗原,置于60 ℃烤片2 h,脱蜡后,二甲苯和乙醇水合,PBS和双蒸馏水冲洗,滴加Bax 一抗(1∶60)和Bcl-2 一抗(1∶500),4 ℃孵育过夜,加二抗37 ℃孵育30 min,DAB显色,中性树胶封片,镜下观察并拍照。每张切片随机取3个视野,采用Image J软件分析阳性染色面积,计算阳性面积比。
3 统计学方法
采用GraphPad Prism 8.0统计软件进行分析。计量资料以±s表示,多组间比较采用方差分析。P<0.05表示差异有统计学意义。
4 结果
4.1 健脾益心方对模型大鼠心脏结构和功能的影响
与假手术组比较,模型组大鼠LVEF、LVFS、LVAWd、 LVAWs 显 著 减 少(P<0.01), LVIDd、LVIDs、LVEDV、LVESV 显著增加(P<0.01);与模型组比较,健脾益心方组大鼠LVEF、LVFS、LVAWd、LVAWs 显著增加,LVIDs、LVESV 显著减少(P<0.01)。见表1。
表1 各组大鼠心脏结构和功能指标比较(±s)

表1 各组大鼠心脏结构和功能指标比较(±s)
注:与假手术组比较,**P<0.01;与模型组比较,##P<0.01
LVESV/μL 41.4± 23.8 266.2±115.1**107.9± 70.8##组别假手术组模型组健脾益心方组只数9 9 9 LVEF/%75.8±12.0 29.3± 5.6**61.1±15.5##LVFS/%46.7±11.8 14.4± 2.9**35.0±12.5##LVAWd/mm 2.3±1.1 1.2±0.3**2.2±0.4##LVAWs/mm 3.4±0.5 1.2±0.3**2.9±0.7##LVIDd/mm 5.8±0.6 8.1±1.6**6.9±1.1 LVIDs/mm 3.1±0.8 7.0±1.5**4.6±1.4##LVEDV/μL 170.5± 38.8 371.7±143.0**256.1± 97.0
4.2 健脾益心方对模型大鼠心脏肥大的影响
与假手术组比较,模型组心脏外观及心脏质量比均表明心脏肥大(P<0.01);与模型组比较,健脾益心方组大鼠心脏肥大明显减轻(P<0.05)。见图1、表2。
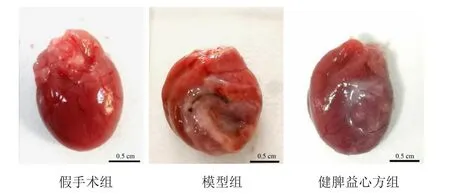
图1 各组大鼠心脏形态
表2 各组大鼠心脏质量比比较(±s,mg/g)

表2 各组大鼠心脏质量比比较(±s,mg/g)
注:与假手术组比较,**P<0.01;与模型组比较,#P<0.05
心脏质量比3.58±0.14 4.36±0.55**3.85±0.44#组别假手术组模型组健脾益心方组只数9 9 9
4.3 健脾益心方对模型大鼠心肌组织病理形态的影响
假手术组大鼠心肌细胞形态正常,心肌纤维排列整齐、结构完整;与假手术组比较,模型组大鼠心肌组织梗死边缘区细胞排列不规则甚至坏死,有明显炎性细胞浸润,心肌纤维化面积显著增加(P<0.01);与模型组比较,健脾益心方组大鼠心肌组织病理损伤明显减轻,心肌纤维化面积显著减少(P<0.05)。见图2、表3。
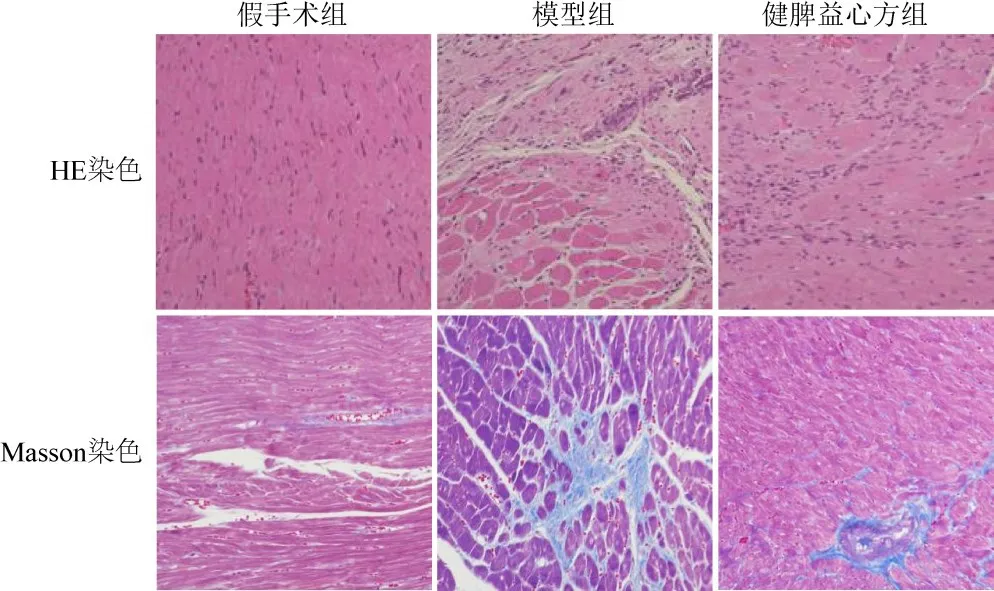
图2 各组大鼠心肌组织形态(×200)
表3 各组大鼠心肌组织纤维化面积比比较(±s,%)
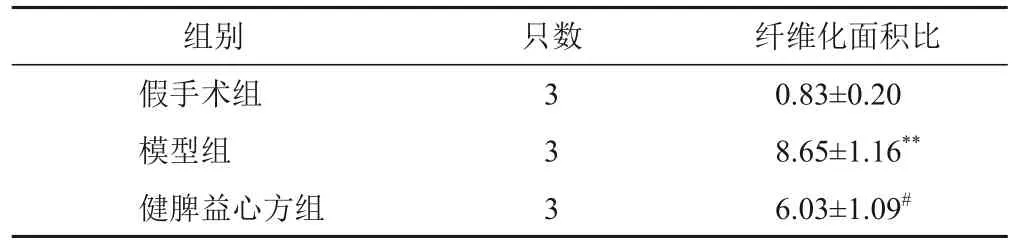
表3 各组大鼠心肌组织纤维化面积比比较(±s,%)
注:与假手术组比较,**P<0.01;与模型组比较,#P<0.05
纤维化面积比0.83±0.20 8.65±1.16**6.03±1.09#组别假手术组模型组健脾益心方组只数3 3 3
4.4 健脾益心方对模型大鼠心肌细胞凋亡的影响
TUNEL染色蓝色为细胞核,绿色为凋亡细胞。与假手术组比较,模型组大鼠心肌细胞凋亡率显著升高(P<0.01);与模型组比较,健脾益心方组大鼠心肌细胞凋亡率显著降低(P<0.01)。见图3、表4。
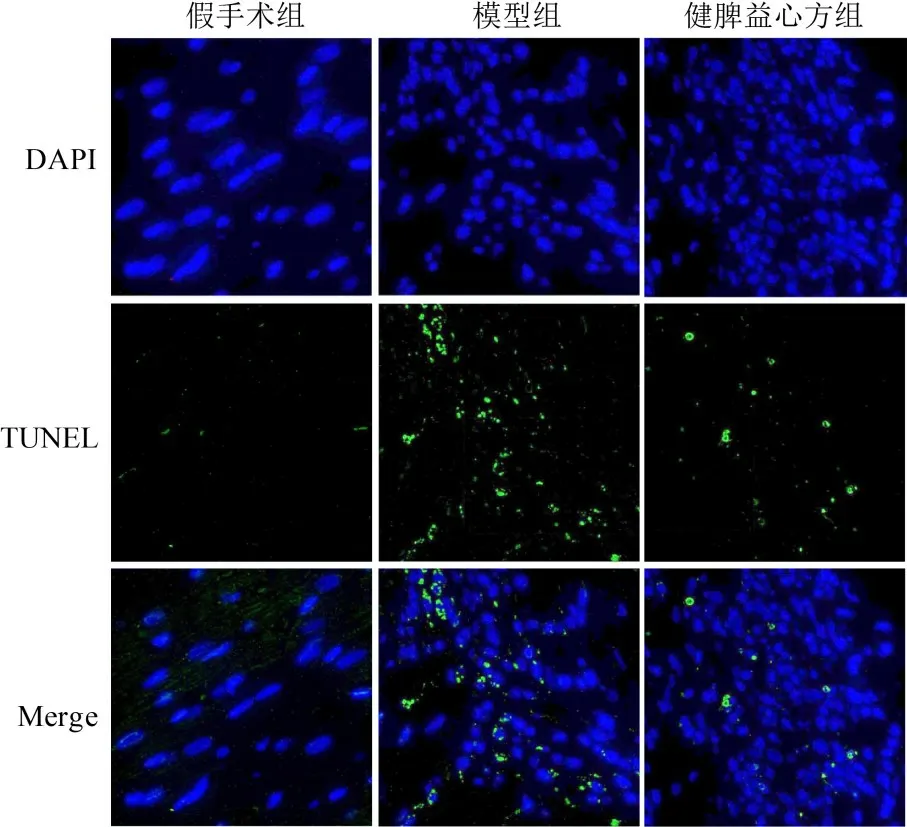
图3 各组大鼠心肌细胞凋亡阳性表达(TUNEL染色,×200)
表4 各组大鼠心肌细胞凋亡率比较(±s,%)

表4 各组大鼠心肌细胞凋亡率比较(±s,%)
注:与假手术组比较,**P<0.01;与模型组比较,##P<0.01
凋亡率11.01± 8.63 54.61±22.61**22.45± 7.97##组别假手术组模型组健脾益心方组只数3 3 3
4.5 健脾益心方对模型大鼠心肌组织凋亡相关蛋白表达的影响
Western blot结果显示,与假手术组比较,模型组大鼠心肌组织Bax、Cytc、Cleaved Caspase-3蛋白表达显著升高,Bcl-2 蛋白表达显著降低(P<0.05,P<0.01);与模型组比较,健脾益心方组大鼠心肌组织Bax、Cytc、Cleaved Caspase-3 蛋白显著降低,Bcl-2蛋白表达显著升高(P<0.05,P<0.01)。见图4、表5。
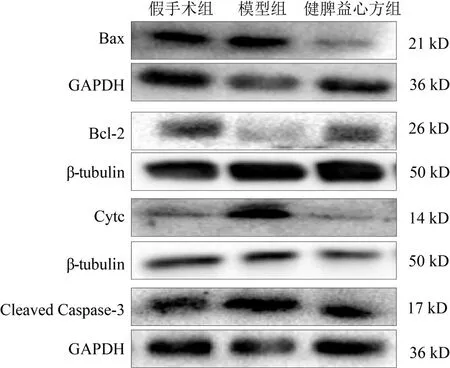
图4 各组大鼠心肌组织Bax、Bcl-2、Cytc、Cleaved Caspase-3蛋白免疫印迹
表5 各组大鼠心肌组织Bax、Bcl-2、Cytc、Cleaved Caspase-3蛋白表达比较(±s,相对灰度值)
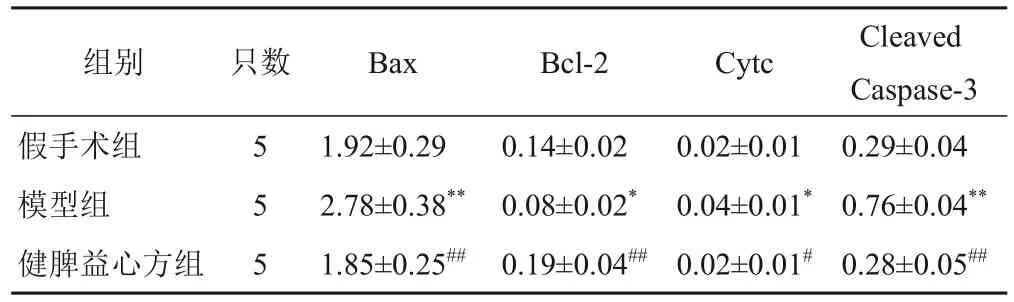
表5 各组大鼠心肌组织Bax、Bcl-2、Cytc、Cleaved Caspase-3蛋白表达比较(±s,相对灰度值)
注:与假手术组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01
组别假手术组模型组健脾益心方组Cleaved Caspase-3 0.29±0.04 0.76±0.04**0.28±0.05##只数5 5 5 Bax 1.92±0.29 2.78±0.38**1.85±0.25##Bcl-2 0.14±0.02 0.08±0.02*0.19±0.04##Cytc 0.02±0.01 0.04±0.01*0.02±0.01#
免疫组化结果显示,与假手术组比较,模型组大鼠心肌组织Bax 表达显著升高,Bcl-2 表达显著降低(P<0.05,P<0.01);与模型组比较,健脾益心方组大鼠心肌组织Bax 表达显著降低,Bcl-2 表达显著升高(P<0.05)。见图5、表6。
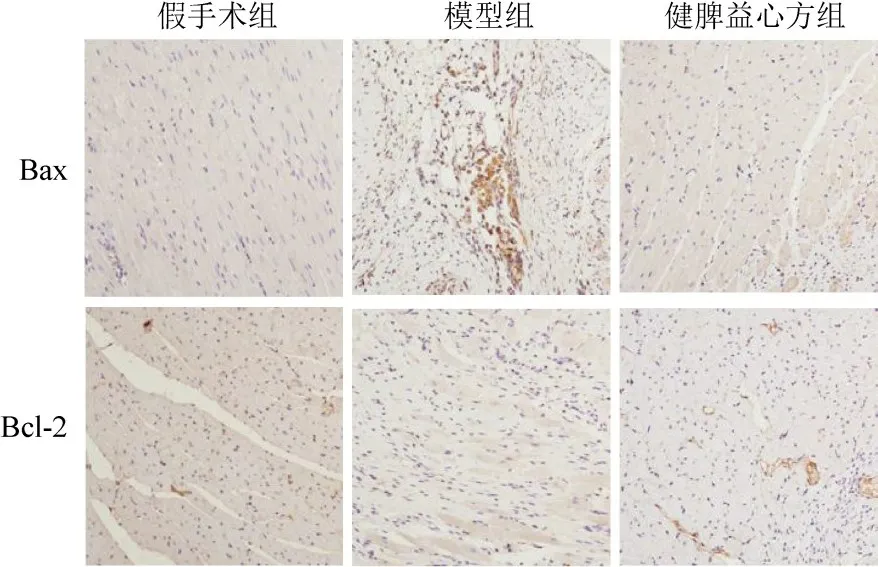
图5 各组大鼠心肌组织Bax、Bcl-2阳性表达(免疫组化染色,×200)
表6 各组大鼠心肌组织Bax、Bcl-2表达比较(±s,%)
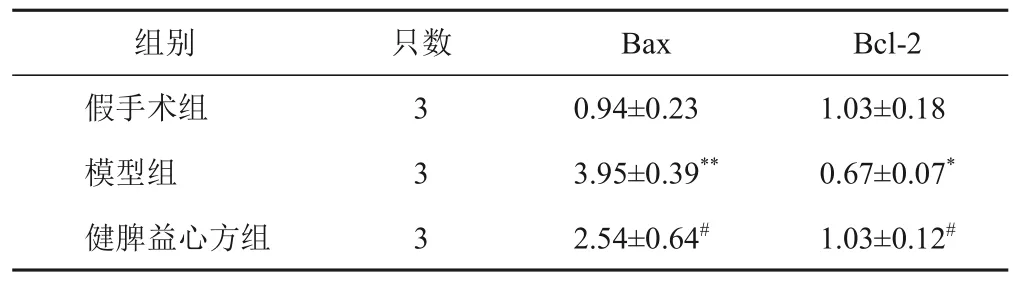
表6 各组大鼠心肌组织Bax、Bcl-2表达比较(±s,%)
注:与假手术组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05
Bcl-2 1.03±0.18 0.67±0.07*1.03±0.12#组别假手术组模型组健脾益心方组只数3 3 3 Bax 0.94±0.23 3.95±0.39**2.54±0.64#
4.6 健脾益心方对模型大鼠心肌组织炎症相关蛋白表达的影响
与假手术组比较,模型组大鼠心肌组织NLRP3、Caspase-1、ASC、IL-1β、IL-6、NF-κB p50 蛋白表达显著升高,差异有统计学意义(P<0.05,P<0.01);与模型组比较,健脾益心方组大鼠上述蛋白表达显著降低,差异有统计学意义(P<0.05,P<0.01)。见图6、表7。

图6 各组大鼠心肌组织NLRP3、Caspase-1、ASC、IL-1β、IL-6、NF-κB p50蛋白免疫印迹
表7 各组大鼠心肌组织NLRP3、Caspase-1、ASC、IL-1β、IL-6、NF-κB p50蛋白表达比较(±s,相对灰度值)
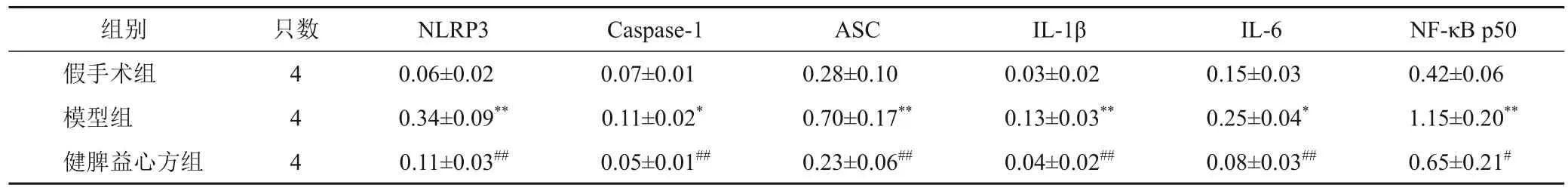
表7 各组大鼠心肌组织NLRP3、Caspase-1、ASC、IL-1β、IL-6、NF-κB p50蛋白表达比较(±s,相对灰度值)
注:与假手术组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01
NF-κB p50 0.42±0.06 1.15±0.20**0.65±0.21#组别假手术组模型组健脾益心方组只数4 4 4 NLRP3 0.06±0.02 0.34±0.09**0.11±0.03##Caspase-1 0.07±0.01 0.11±0.02*0.05±0.01##ASC 0.28±0.10 0.70±0.17**0.23±0.06##IL-1β 0.03±0.02 0.13±0.03**0.04±0.02##IL-6 0.15±0.03 0.25±0.04*0.08±0.03##
5 讨论
根据临床症状,MI可归属中医学“胸痹”“真心痛”等范畴,为本虚标实之证,心之气血阴阳亏虚,致血瘀、气滞、寒凝、痰浊等痹阻心脉,其中气虚痰瘀为主要病机。“心脾相关”理论为从脾治疗心系疾病奠定理论基础[14-16],脾胃调节免疫炎症的功能被越来越多学者接受。“四季脾旺不受邪”“脾为之卫”强调脾气可抵抗外邪入侵[17]。因此,脾可能通过调节炎症反应实现对MI后心室重塑的保护作用。健脾益心方中黄芪、人参、麸炒白术、茯苓益气健脾,白术、茯苓兼以运化水湿,丹参、当归活血通脉,桂枝温心阳、扶脾阳以助运化,泽泻、大腹皮、葶苈子祛湿利水。诸药合用,调理中焦以助上焦,使脾气得运,痰饮得化,心脉气血调和。
MI后出现心脏结构异常,心功能下降,在超声心动图上主要表现为心脏舒缩功能(LVEF、LVFS)和心室壁厚度(LVAWd、LVAWs)下降,以及心室内径(LVIDd、LVIDs)和容积(LVEDV、LVESV)增加。本实验通过超声心动图评价大鼠心脏功能及形态变化,结果显示,与假手术组比较,模型组大鼠LVEF、LVFS、 LVAWd、 LVAWs 均 显 著 减 少, LVIDd、LVIDs、LVEDV、LVESV显著增加,提示冠状动脉结扎导致左心室收缩及舒张功能障碍,左室壁变薄,左心室扩张;与模型组比较,健脾益心方组大鼠LVEF、LVFS、LVAWd、LVAWs 明显增加,LVIDs、LVESV明显减少,提示健脾益心方能有效改善大鼠心脏结构及功能障碍。
课题组前期采用液相色谱-质谱法鉴定出健脾益心方中7个化合物,包括2-异丙基-8-甲基菲-3,4-二酮、丹参新醌d、富马碱、山柰酚、木犀草素、β-谷甾醇、丹参酮ⅡA。研究表明,山柰酚通过抑制STING/NF-κB通路[18]、调节miR-15b/Bcl-2/TLR4[19]等介导炎症,对心脏/心肌细胞损伤发挥保护作用。木犀草素是一种黄酮类化合物,可通过减少心肌缺血面积、抑制心肌细胞凋亡和减轻炎症改善心肌缺血[20],还可减轻阿霉素诱导的心脏毒性[21]。β-谷甾醇可能通过抑制炎症反应和氧化应激减轻心脏坏死和细胞凋亡[22]。
细胞凋亡是一种基因调控的细胞死亡形式,参与心肌损伤病理演变过程,导致梗死灶扩张[23]、心室重塑[24]、心功能障碍,甚至心力衰竭[25-26]。抑制心肌细胞凋亡可缓解缺血缺氧引起的心肌损伤[27]。Bcl-2、Bax、Cytc及Cleaved Caspase-3在细胞凋亡中发挥重要作用:线粒体外膜破裂导致Cytc从膜间隙释放到细胞质[28],与凋亡蛋白酶激活因子和Caspase-9形成凋亡小体,触发Caspase-3 激活,最终导致细胞凋亡[29-30]。Bcl-2可阻断Cytc和凋亡诱导因子释放[31]。Bax能增加线粒体外膜通透性,促进凋亡因子释放[32]。本研究TUNEL染色与蛋白检测结果显示,模型大鼠心肌组织损伤明显,心肌细胞凋亡率显著升高,健脾益心方可抑制心肌细胞凋亡,调控凋亡相关蛋白表达至接近正常水平。NLRP3炎症小体由ASC、NLRP3和Caspase-1蛋白组成,在应激状态下可被激活[27,33]。NLRP3炎症小体通过调节IL-1β、IL-6、IL-18等促炎因子释放发挥炎症作用,不仅促进细胞凋亡的发生,而且加重心肌细胞功能障碍,引发心室重塑和心力衰竭[34-35]。NF-κB是炎症因子表达的主要转录因子,在充血性心力衰竭和心肌肥厚等多种心脏疾病中被激活[36]。NF-κB p50为NF-κB成员之一,具有DNA结合、二聚化及核转位等功能,生理条件下,NF-κB多以p50-p65异源二聚体形式与其抑制因子IκB结合并保持静息状态[37]。研究表明,NF-κB通路在NLRP3炎症小体的调控中发挥重要作用[38-39]。IL-1β 作为关键的促炎因子,主要由Caspase-1 激活,活化后的IL-1β 可启动NF-κB 通路,进而促进IL-6、肿瘤坏死因子-α等炎症因子表达[40]。肿瘤坏死因子-α表达增加不仅促进IL-1β分泌,而且可激活细胞内Caspase信号通路,参与不可逆的凋亡途径[40]。本研究中模型组大鼠心肌组织NLRP3、Caspase-1、ASC、IL-1β、IL-6、NF-κB p50蛋白表达显著升高,经健脾益心方干预后,心肌组织NLRP3、Caspase-1、ASC、IL-1β、IL-6、NF-κB p50蛋白表达显著降低,表明其可通过抑制炎症相关蛋白表达,改善模型大鼠心肌组织炎症反应,进而改善心肌结构。
综上,健脾益心方可减轻MI大鼠心肌损伤,改善心脏结构与功能,抑制心室重塑。其心肌保护作用可能是通过下调炎症反应,从而抑制心肌细胞凋亡实现。本研究仅对炎症反应及细胞凋亡的部分机制进行探索,今后将进一步优化实验条件,对多种炎症因子在心肌损伤中的协同、拮抗或其他作用机制及健脾益心方的干预靶点进行深入研究。
