芍药汤通过PPARγ调控TGF-β1/Smads信号通路对溃疡性结肠炎湿热内蕴证肠纤维化上皮间质转化的影响
2023-11-03吴东升李嫣红阳玉婷谢念佳张彧芦易曹晖
吴东升 ,李嫣红 ,阳玉婷 ,谢念佳 ,张彧 ,芦易 ,曹晖
1.湖南中医药大学第一附属医院,湖南 长沙 410007; 2.湖南中医药大学,湖南 长沙 410208
溃疡性结肠炎(ulcerative colitis,UC)是一种以黏膜和黏膜下层炎症为特征的慢性疾病,局限于结肠,并伴有隐窝和隐窝脓肿[1],属于炎症性肠病(inflammatory bowel disease,IBD)的一种。由于长期慢性肠道炎症刺激,患者UC相关结直肠癌发病率和病死率逐渐增加[2]。UC病程长,治疗难度大,患者可能需要终身治疗[3]。目前UC治疗策略主要通过免疫抑制控制疾病进展,包括美沙拉嗪、糖皮质激素、硫唑嘌呤和生物制剂等,但大多数UC患者症状无法持续缓解[4]。此外,由于生活方式和饮食结构的变化,全球UC患者数量迅速增加,亟需探索安全有效的治疗措施[5]。肠纤维化是IBD发展过程中不可避免的过程,被认为是肠道组织对于慢性炎症和过度损伤的、不可逆的伤口愈合反应。UC患者肠纤维化可导致肠壁硬度增加,引起如结肠动力异常、肛门直肠功能障碍、直肠急迫和尿失禁等临床表现,严重影响生活质量[6]。防治甚至逆转肠纤维化已成为临床治疗UC亟待解决的问题[7]。上皮间质转化(EMT)是肠纤维化形成的重要机制之一[8],EMT在UC肠纤维化中的作用和调控机制目前尚未完全阐明,研究表明,TGF-β/Smads信号通路在调节EMT中发挥重要作用[9],从TGF-β/Smads信号通路研究EMT在肠纤维化形成中的作用可能为UC肠纤维化的治疗提供新靶点。过氧化物酶体增殖物激活物受体(PPAR)γ通过抑制TGF-β/Smads活化,减少促炎因子转录及表达,从而下调过度免疫反应,PPARγ过表达可抑制组织纤维化的发展,对组织纤维化有保护作用[10]。
芍药汤出自《素问病机气宜保命集》,是临床治疗UC的代表方之一,具有清热燥湿、调气和血等功效。课题组前期研究表明,芍药汤可以调节肠道免疫功能,通过下调促炎因子和上调抗炎因子调节Th17/Treg平衡,减轻肠道炎症[11-16]。本实验建立UC湿热内蕴证大鼠模型,观察芍药汤通过PPARγ调控TGF-β1/Smads信号通路对UC肠纤维化EMT的影响,进一步明确其治疗UC的作用机制。
1 实验材料
1.1 动物
60只雄性SD大鼠(160±10)g,购自湖南斯莱克景达实验动物有限公司,动物许可证号SCXK(湘)2019-0004,动物质量合格证号430727211101295026。饲养于温度24~26 ºC、湿度40%~60%环境。本实验经湖南中医药大学第一附属医院动物伦理委员会审批(ZYFY20210615)。
1.2 药物及制备
芍药汤(白芍30 g,当归、黄连、黄芩各15 g,大黄9 g,槟榔、木香、甘草各6 g,肉桂5 g),饮片购自湖南中医药大学第一附属医院中药房,经该院邓桂明主任药师鉴定为正品。所有饮片混匀,加8倍量双蒸水浸泡2 h,大火煮沸后用小火煎煮0.5 h,重复1次(加6倍量双蒸水),合并煎液,1 500 r/min(离心半径13.5 cm)离心10 min,过滤,滤液浓缩至原药材浓度为1.1 g/mL,置于4 ℃冰箱保存备用。美沙拉嗪缓释颗粒,上海爱的发制药有限公司,批号210401,0.5 g/袋。精密称取美沙拉嗪缓释颗粒4.2 g,研成细粉后溶于10 mL蒸馏水,配制成0.42 g/mL美沙拉嗪溶液。
1.3 主要试剂与仪器
2,4,6 -三硝基苯磺酸(TNBS,德国Sigma 公司,批号3LBD6811V),HE染色试剂盒(上海碧云天,批号C0105),兔抗鼠白细胞介素(IL)-6、IL-10 抗体(北京博奥森生物,批号分别为BS-4539R、bs-6761R),α-平滑肌肌动蛋白(α-SMA)、E-钙黏蛋白抗体(Alpha Applied Bioscience 公 司, 批 号 分 别 为A23873、A13873),PPARγ、转化生长因子(TGF)-β1、p-Smad抗体(湖南艾方生物科技有限公司,批号分别为AF11066、AF03634、AF00903),兔抗鼠β-actin抗体(Immunoway公司,批号为YM3028),辣根过氧化物酶标记羊抗兔IgG(武汉赛维尔有限公司,批号GB25301)。KD-BM BL型组织包埋机(浙江金华科迪仪器设备有限公司),WD-9405C 型电泳仪、DYCZ-24DN型转膜仪(北京六一仪器厂),RM2235型精密轮转切片机(德国Leica公司),YD-AB型组织摊烤片机(浙江益迪医疗设备有限公司)。
2 实验方法
2.1 造模
60只大鼠随机抽取10只作为正常组,剩余50只采用复合病因(高糖高脂饮食+湿热环境+免疫干预+TNBS)建立UC湿热内蕴证大鼠模型。在普通饲料喂养基础上,予大鼠200 g/L蜂蜜水自由饮用,油脂15 g/kg与52%白酒20 mL/kg交替灌胃20 d,并置于人工气候箱(温度35 ℃、湿度95%,6 h/d),造模第6、20日于腹股沟、背部及左、右侧足跖皮下注射40 mg/kg抗原乳化液,第21 日大鼠禁食不禁水24 h,麻醉后用石蜡油润滑0.4 mm直径聚乙烯软管插入直肠,深度8 cm,注入5%TNBS(75 mg/kg)+50%乙醇0.25 mL,再将大鼠提尾倒置60 s,使药液充分停留[11]。造模第28日,观察大鼠毛发、精神状况、活动量、大便性状、便血情况、饮食量、体质量变化等,取2只大鼠HE染色观察结肠黏膜病理改变及炎症程度,综合判断造模是否成功。
2.2 分组及给药
采用随机数字表法将40只成模大鼠随机分为模型组、西药对照组(美沙拉嗪)和芍药汤低、中、高剂量组,每组8只。造模第28日开始给药,芍药汤低、中、高剂量组给药剂量分别为11.1、22.2、44.4 g/kg,西药对照组为0.42 g/kg,灌胃体积10 mL/kg,正常组和模型组灌胃等体积生理盐水,连续14 d。
2.3 标本采集
末次给药后禁食24 h,3%戊巴比妥钠30 mg/kg腹腔注射麻醉大鼠,低温迅速剖取距肛门上约8~10 cm结肠组织,以生理盐水冲洗,滤纸吸干,取0.5 cm结肠组织放于4%多聚甲醛中,剩余结肠组织于-80 ℃冰箱保存。
2.4 结肠形态观察
自肛门处向上取结肠(8±2)cm,沿纵轴剪开,用生理盐水冲洗干净,肉眼观察结肠黏膜形态。
2.5 免疫组化检测
剪取0.5 cm结肠组织,放入4%多聚甲醛中固定,石蜡包埋,制片,切片二甲苯溶液脱蜡,梯度乙醇水化,柠檬酸盐抗原修复溶液处理,用0.5%Triton X-100透化20 min,3%H2O2溶液孵育,5%牛血清白蛋白封闭20 min,滴加IL-6、IL-10、α-SMA、E-钙黏蛋白一抗(1∶500),37 ℃孵育1 h,PBS洗涤,切片加羊抗兔IgG(1∶1 000),37 ℃孵育20 min,经DAB显色、复染、脱水、透明、封片后,显微镜下观察并拍照,阳性表达为棕黄色颗粒,采用Image-Pro Plus软件测定积分光密度和阳性表达面积,计算平均光密度(积分光密度/阳性表达面积)。
2.6 Western blot检测
结肠组织用裂解缓冲液提取蛋白,通过12%SDS-聚丙烯酰胺凝胶电泳分离,转膜,5%BSA室温封闭1 h,按1∶1 000加入PPARγ、TGF-β1、p-Smad一抗,4 ℃孵育过夜,按1∶2 000加入辣根过氧化物酶标记羊抗兔IgG,室温孵育1 h,暗室曝光,用显影、定影试剂进行显影和定影。Image J软件测定目的蛋白与内参蛋白(β-actin)灰度值,以二者比值表示目的蛋白相对表达量。
3 统计学方法
采用SPSS25.0统计软件进行分析。计量资料以±s表示,先进行正态性、方差齐性检验,两两比较方差齐用LSD检验,方差不齐用非参数秩和检验;多组间比较采用Kruskal-Wallis检验。P<0.05表示差异有统计学意义。
4 结果
4.1 芍药汤对模型大鼠一般状况及结肠组织损伤的影响
干预结束后,正常组大鼠一般状况良好,摄食、饮水量正常,毛发光泽,活动敏捷,大便正常;模型组大鼠精神沉郁,摄食、饮水量减少,毛发欠光泽,活动减少,精神萎靡,喜蜷缩、扎堆,大便不成形、臭秽、黏腻夹带少许脓血,尿黄,肛温升高,符合湿热内蕴证相关表现;各给药组大鼠症状好转,精神状态恢复,摄食、饮水量增加,脓血便减少甚至消失,活动量增加,小便较清澈,肛温降低。结肠组织肉眼观察可见,模型组部分肠管狭窄或肠壁增厚变硬,血管纹理模糊,结肠黏膜严重充血、水肿、糜烂,部分可见小溃疡;西药对照组及芍药汤低、中、高剂量组结肠黏膜损伤情况明显改善,结肠黏膜表面欠光滑,肠黏膜水肿、糜烂减轻。见图1。

图1 各组大鼠结肠组织形态
4.2 芍药汤对模型大鼠结肠组织白细胞介素-6、白细胞介素-10、α-平滑肌肌动蛋白、E-钙黏蛋白表达的影响
与空白组比较,模型组大鼠结肠组织IL-6、α-SMA表达明显升高(P<0.01),IL-10、E-钙黏蛋白表达明显降低(P<0.01);与模型组比较,各给药组大鼠结肠组织IL-6、α-SMA表达明显降低(P<0.01),IL-10、E-钙黏蛋白表达明显升高(P<0.05,P<0.01);与芍药汤低剂量组比较,芍药汤高剂量组IL-6、α-SMA表达明显降低(P<0.05,P<0.01),IL-10、E-钙黏蛋白表达明显升高(P<0.05)。见表1、图2~图5。
表1 各组大鼠结肠组织IL-6、IL-10、α-SMA、E-钙黏蛋白表达比较(±s,平均光密度)

表1 各组大鼠结肠组织IL-6、IL-10、α-SMA、E-钙黏蛋白表达比较(±s,平均光密度)
注:与正常组比较,##P<0.01;与模型组比较,&P<0.05,&&P<0.01;与芍药汤低剂量组比较,*P<0.05,**P<0.01
E-钙黏蛋白0.004 0±0.000 6 0.001 7±0.000 5##0.002 7±0.000 3&&0.002 5±0.000 6&0.002 9±0.000 5&&0.003 3±0.000 8&&*组别正常组模型组西药对照组芍药汤低剂量组芍药汤中剂量组芍药汤高剂量组只数8 8 8 8 8 8 IL-6 0.034 1±0.001 7 0.040 8±0.003 1##0.024 1±0.003 2&&0.023 4±0.002 0&&0.019 0±0.001 3&&0.017 5±0.001 7&&*IL-10 0.016 9±0.000 9 0.007 6±0.000 7##0.012 2±0.000 5&&0.011 2±0.001 3&&0.012 3±0.001 7&&0.014 1±0.000 6&&*α-SMA 0.014 6±0.001 1 0.031 3±0.002 8##0.022 9±0.002 6&&0.025 4±0.000 8&&0.020 8±0.002 0&&*0.016 0±0.001 3&&**
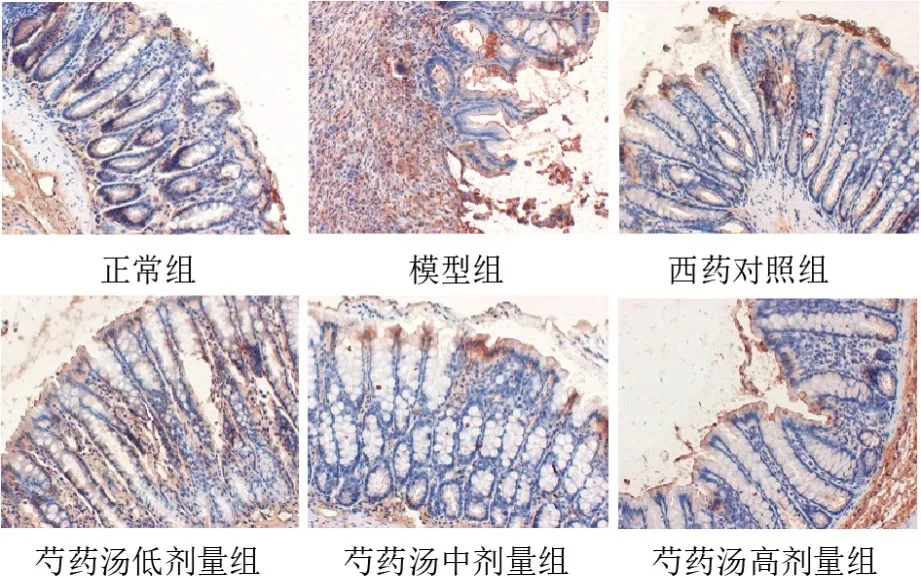
图2 各组大鼠结肠组织IL-6阳性表达(免疫组化染色,×200)

图3 各组大鼠结肠组织IL-10阳性表达(免疫组化染色,×200)
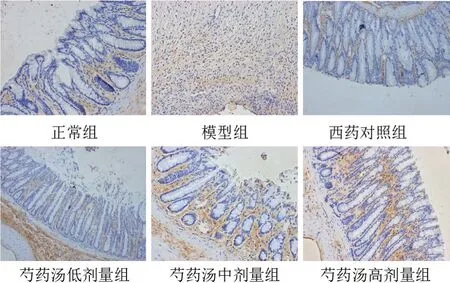
图4 各组大鼠结肠组织α-SMA阳性表达(免疫组化染色,×200)
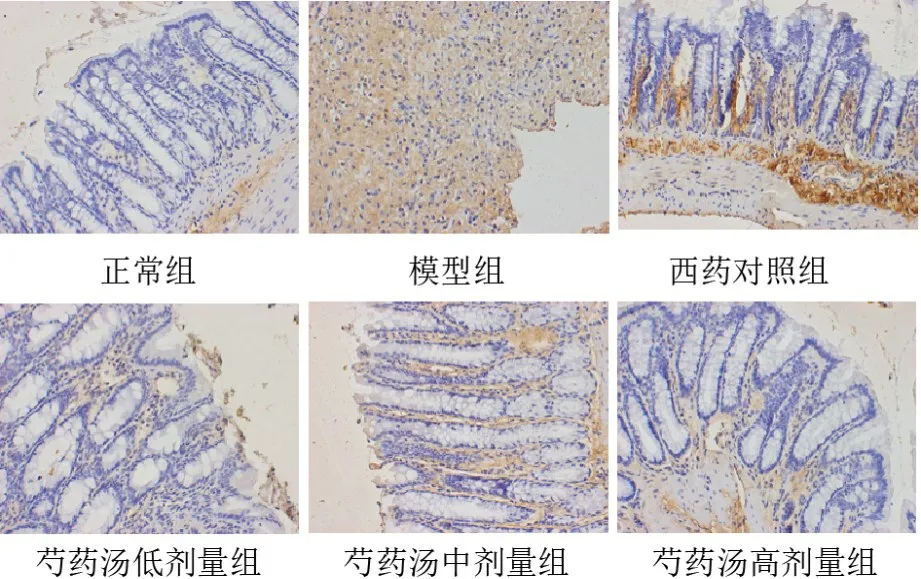
图5 各组大鼠结肠组织E-钙黏蛋白阳性表达(免疫组化染色,×200)
4.3 芍药汤对模型大鼠结肠组织过氧化物酶体增殖物激活物受体γ、转化生长因子-β1、p-Smad蛋白表达的影响
与正常组比较,模型组大鼠结肠组织PPARγ蛋白表达明显降低(P<0.01),TGF-β1、p-Smad蛋白表达明显升高(P<0.01);与模型组比较,各给药组结肠组织PPARγ 蛋白表达明显升高(P<0.01),TGF-β1、p-Smad蛋白表达明显降低(P<0.01);与芍药汤低剂量组比较,芍药汤中、高剂量组PPARγ蛋白表达明显升高(P<0.05,P<0.01),芍药汤高剂量组TGF-β1蛋白表达降低(P<0.05),芍药汤中剂量组p-Smad蛋白表达降低(P<0.05)。见图6、表2。
表2 各组大鼠结肠组织PPARγ、TGF-β1、p-Smad蛋白表达比较(±s)

表2 各组大鼠结肠组织PPARγ、TGF-β1、p-Smad蛋白表达比较(±s)
注:与正常组比较,##P<0.01;与模型组比较,&&P<0.01;与芍药汤低剂量组比较,*P<0.05,**P<0.01
组别正常组模型组西药对照组芍药汤低剂量组芍药汤中剂量组芍药汤高剂量组p-Smad 0.243±0.025 0.359±0.017##0.303±0.024&&0.286±0.022&&0.256±0.007&&*0.269±0.011&&只数8 8 8 8 8 8 PPARγ 0.405±0.041 0.213±0.042##0.337±0.053&&0.328±0.026&&0.361±0.024&&*0.395±0.026&&**TGF-β1 0.322±0.035 0.697±0.099##0.483±0.077&&0.554±0.077&&0.488±0.091&&0.431±0.027&&*
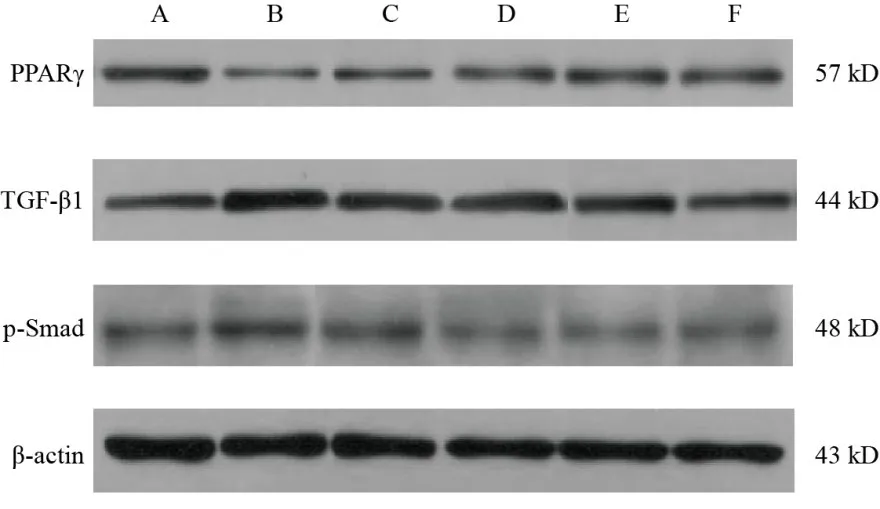
图6 各组大鼠结肠组织PPARγ、TGF-β1、p-Smad蛋白免疫印迹
5 讨论
反复肠道炎症可触发IBD患者黏膜愈合反应,导致细胞外基质(ECM)在肠道内沉积,形成肠纤维化[17]。研究发现,UC患者结肠切除标本大多存在一定程度的黏膜下纤维化[18-19]。研究表明,EMT与肠纤维化有关[20],EMT是上皮细胞的表型转变,是一种复杂的动态现象,伴随着上皮细胞标志物如E-钙黏蛋白丧失和间充质特征蛋白包括α-SMA增加。在EMT过程中,上皮细胞失去紧密连接转变成间质细胞,产生大量ECM沉积在肠内,导致肠腔变窄[21]。目前普遍认为,EMT 可通过诱导ECM 产生促进肠纤维化形成[22-23]。
UC属中医学“泄泻”“痢疾”等范畴,湿热内蕴证是其急性期的主要证型,其实质可能为湿热胶结,潜伏于内,致湿热蕴肠,脂膜血络受伤,气血不调。湿为阴邪,其性重浊黏滞,以致UC缠绵难愈;热为阳邪,其性炎上,易致疮疡,热破血行,可致UC痢下赤白脓血。芍药汤为清热剂,可清脏腑热、清热燥湿、调气和血等,是临床治疗UC湿热内蕴证的代表方,方中以黄连、黄芩为君药,取其清热燥湿之功,入大肠除病因,并配以大黄,清中有泄,泄中有清,使湿热积滞从大便去。本研究中,模型组大鼠精神萎靡,喜蜷缩、扎堆,大便不成形、臭秽,黏腻夹带少许脓血,尿黄,肛温升高,符合湿热内蕴证相关表现。结肠组织肉眼可见纤维化程度较为明显,同时促炎因子IL-6表达升高,抗炎因子IL-10表达降低,EMT标志蛋白α-SMA表达明显升高,E-钙黏蛋白表达明显降低,提示复合病因(高糖高脂饮食+湿热环境+免疫干预+TNBS)造模引起湿热蕴结,致气血不畅,郁结成块,促进UC大鼠肠纤维化进展。与模型组比较,各给药组大鼠湿热内蕴证表现减少甚至消失,结肠组织肉眼可见纤维化程度明显减轻,IL-6、α-SMA表达降低,IL-10、E-钙黏蛋白表达升高,提示芍药汤可减轻肠道炎症,抑制EMT,从而抑制肠纤维化进展。
实验研究表明,TGF-β/Smads通路在促进肠纤维化中起着至关重要的作用[24]。TGF-β被视为EMT的最佳表征启动子,Smad3 缺失或Smad7 过表达能破坏TGF-β/Smads信号通路,抑制组织纤维化[25]。PPARγ是核受体,被认为是参与组织纤维化的新分子,PPARγ过表达可抑制组织纤维化[26]。此外,PPARγ激动剂可减弱包括肠道在内的多个器官的纤维化,而这些抗纤维化作用被PPARγ选择性拮抗剂消除[27-28]。本研究发现,模型组大鼠结肠组织PPARγ蛋白表达较正常组明显降低,TGF-β1、p-Smad蛋白表达明显升高;各给药组结肠组织PPARγ蛋白表达较模型组明显升高,TGF-β1、p-Smad蛋白表达明显降低,提示芍药汤可能通过上调PPARγ 表达,下调TGF-β、p-Smad 蛋白表达,抑制EMT,从而抑制UC湿热内蕴证大鼠肠纤维化进展。
综上所述,芍药汤可减轻UC湿热内蕴证大鼠肠纤维化,并呈一定剂量依赖性,其可能通过促进PPARγ表达,抑制TGF-β1/Smads信号通路,抑制EMT,进而发挥抗纤维化作用。
