基于曲妥珠单抗联合奈达铂探讨其对人表皮生长因子受体-2阳性乳腺癌疗效及安全性影响的临床研究
2023-11-03陈建敦广东同江医院广东佛山528300
陈建敦(广东同江医院,广东 佛山 528300)
乳腺癌是全球范围内女性最常见的恶性肿瘤之一,其中表皮生长因子受体-2(HER-2)阳性乳腺癌是一种特殊亚型。HER-2阳性乳腺癌的特点是肿瘤细胞过度表达HER-2受体,与肿瘤的侵袭性和预后不良相关。曲妥珠单抗是一种靶向HER-2的单克隆抗体,已被广泛应用于HER-2阳性乳腺癌的治疗[1]。然而,曲妥珠单抗单药治疗存在一定的局限性,如药物耐药性和疗效限制。奈达铂是一种铂类化合物,已在多种肿瘤治疗中显示出一定的抗肿瘤活性。因此,联合应用曲妥珠单抗和奈达铂可能具有协同效应,提高对HER-2阳性乳腺癌的治疗效果[2]。本研究的目的是评估基于曲妥珠单抗联合奈达铂治疗HER-2阳性乳腺癌的疗效和安全性。通过观察患者的疾病缓解率、生存期和不良事件发生情况,评估该联合治疗方案对患者的疗效和生活质量的影响。研究结果将为临床医生提供指导,为HER-2阳性乳腺癌患者的个体化治疗提供依据,改善其预后和生存质量。
1 资料与方法
1.1 一般资料 选取2022年1月-2023年7月收集的HER-2阳性乳腺癌患者80例为研究对象,按照入院顺序编号,采用PEMS3.1forWindows“完全随机设计程序”产生随机数字(受试对象总数=80,处理组数=2,每组例数相等)。按入组先后顺序随机分为对照组和观察组。观察组40例,年龄27-67岁,平均年龄(39.54±3.68)岁;对照组40例,年龄29-66岁,平均年龄(40.16±3.94)岁;将上述基线资料录入统计学软件,两组患者比较,差异无统计学意义(P>0.05)。本研究获得医院医学伦理委员会的审批,可以进行临床试验。
纳入标准:①通过组织活检及影像学检查确诊为HER-2阳性乳腺癌;②患者必须处于一线治疗的可行性范围内,即尚未接受其他治疗方案,或者之前接受的治疗方案已完成;③患者的身体状况足够好,能够承受联合治疗的毒副作用;④患者及家属签署知情同意书。
排除标准:①患者对曲妥珠单抗、奈达铂或其他相关药物存在严重过敏反应的风险;②患者存在严重心脏病(如心衰、心肌梗死等)或其他心血管疾病;③患者存在严重肝功能损害(如肝硬化、严重肝功能衰竭)或严重肾功能损害;④患者处于孕期或正在哺乳期。
1.2 治疗方法 对照组:曲妥珠单抗静脉滴注,首次剂量为8mg·kg-1,以后剂量为6mg·kg-1,每3周1次,共治疗6个周期。观察组:在对照组基础上联合奈达铂(规格:10mg)静脉滴注,剂量90mg·m-2,每3周1次,治疗6个周期。
1.3 观察指标 ①临床疗效:完全缓解(CR):在治疗期间,患者的肿瘤完全消失,没有任何残留的可见肿瘤,至少维持4周没有肿瘤活动的证据;部分缓解(PR):在治疗期间,患者的肿瘤有不同程度的缩小(≥30%),至少维持4周;稳定疾病(SD):在治疗期间,患者的肿瘤大小和进展情况保持相对稳定,没有明显的缩小或增大;疾病进展(PD):在治疗期间,患者的肿瘤出现明显的增大(≥20%)或有新的肿瘤出现。
②血清肿瘤标志物变化:分别于治疗前后采集患者空腹静脉血3-5mL,离心后分离血清,检测糖抗原153(CA153)、血清癌胚抗原(CEA)、细胞间黏附分子-1(ICAM-1)水平等。
③血清T细胞亚群水平:分别于治疗前后采集患者空腹静脉血2-3mL,离心取上清液,采用碱性磷酸酶法检测血清T细胞亚群(CD3+、CD4+、CD8+)水平。
1.4 统计学方法 采用SPSS26.0统计软件处理分析数据。计量资料以均数±标准差表示,采用独立样本t检验;计数资料以例数和百分率表示,行χ2检验或秩和检验,以P<0.05表示差异有统计学意义。
2 结果
2.1 两组患者临床疗效对比 观察组治疗总有效率(82.50%)、疾病控制率(9 5.0 0%)均显著高于对照组(5 5.0 0%、77.50%),且差异均有统计学意义(χ2=5.126,P=0.035;χ2=7.215,P=0.013),见表1。

表1 两组患者临床疗效对比[n(%)]
2.2 两组治疗前后血清肿瘤标志物变化对比 治疗前,两组患者的血清肿瘤标志物水平差异无统计学意义(P>0.05);治疗后,两组患者CA153、CEA、ICAM-1水平均有所降低,差异均有统计学意义(P<0.05),且观察组降低水平显著优于对照组,见表2。
表2 两组治疗前后血清肿瘤标志物CA153、CEA、ICAM-1水平对比(±s)

表2 两组治疗前后血清肿瘤标志物CA153、CEA、ICAM-1水平对比(±s)
组别 n CA153 CEA ICAM-1治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组 40 73.15±18.29 43.25±14.68 22.16±8.12 13.25±5.17 1165.28±385.25 820.96±219.02观察组 40 73.54±18.16 30.25±10.54 22.19±7.98 7.66±3.18 1180.58±388.48 655.24±226.48 t 0.812 5.124 0.815 3.151 0.954 3.157 P 0.619 0.000 0.314 0.000 0.618 0.001
2.3 两组治疗前后血清T细胞亚群水平对比 治疗前,两组患者血清T细胞亚群水平比较,差异无统计学意义(P>0.05);治疗后,对照组患者的CD3+、CD4+水平均高于观察组,差异均有统计学意义(P<0.05),对照组的CD8+水平低于观察组,差异有统计学意义(P<0.05)。见表3。
表3 两组治疗前后血清T细胞亚群水平CD3+、CD4+、CD8+水平对比(±s,%)
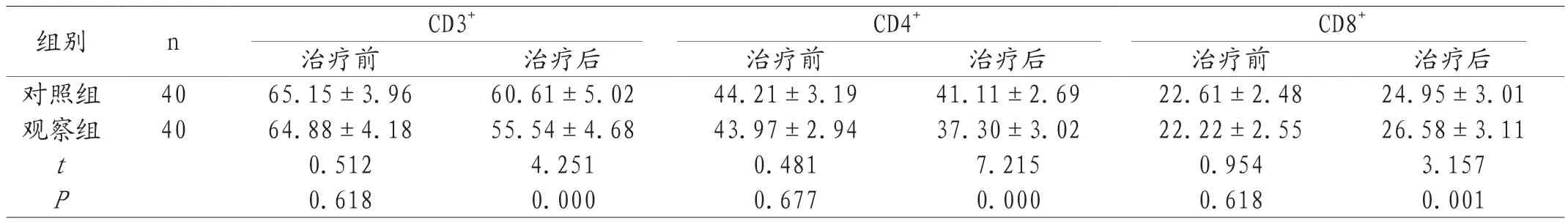
表3 两组治疗前后血清T细胞亚群水平CD3+、CD4+、CD8+水平对比(±s,%)
组别 n CD3+ CD4+ CD8+治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组 40 65.15±3.96 60.61±5.02 44.21±3.19 41.11±2.69 22.61±2.48 24.95±3.01观察组 40 64.88±4.18 55.54±4.68 43.97±2.94 37.30±3.02 22.22±2.55 26.58±3.11 t 0.512 4.251 0.481 7.215 0.954 3.157 P 0.618 0.000 0.677 0.000 0.618 0.001
3 讨论
临床上对乳腺癌的主要治疗方法包括手术、放疗、化疗、内分泌治疗和靶向治疗等。手术是治疗早期乳腺癌的主要方法,可以通过乳房保留手术或全乳切除手术来切除病变组织。放疗可以通过高能放射线照射乳房区域,减少残留的癌细胞。化疗可以使用化学药物杀死癌细胞,通常用于晚期或转移性乳腺癌的治疗。内分泌治疗通过干扰女性激素对乳腺癌的影响来治疗激素受体阳性的乳腺癌。靶向治疗可以通过干扰乳腺癌细胞的信号传导通路来治疗HER-2阳性的乳腺癌[3]。HER-2阳性乳腺癌是乳腺癌中过度表达人类表皮生长因子受体2(HER-2)蛋白的一种亚型。HER-2是一种受体蛋白,位于细胞表面,与细胞的生长和分裂有关。在HER-2阳性乳腺癌中,癌细胞会过度表达HER-2受体蛋白,导致异常增殖和增加生长的信号,这使得HER-2阳性乳腺癌比其他类型的乳腺癌更具侵袭性和复发率。HER-2阳性乳腺癌约占所有乳腺癌病例的15%-20%,是乳腺癌的一种重要亚型。目前,针对HER-2阳性乳腺癌的治疗主要包括抗HER-2药物和化疗药物。抗HER-2药物包括曲妥珠单抗、帕妥珠单抗、三嗪铂等,可阻断HER-2的生长和增殖信号通路,从而抑制癌细胞的生长。同时,化疗药物也是治疗HER-2阳性乳腺癌的重要手段[4]。
曲妥珠单抗联合奈达铂是一种新型的治疗HER-2阳性乳腺癌的方法,其原理是利用曲妥珠单抗抑制HER-2阳性乳腺癌细胞的增殖和生长,同时奈达铂通过诱导肿瘤细胞凋亡,起到杀灭肿瘤细胞的作用[5]。本次研究发现,观察组治疗总有效率(82.50%)、疾病控制率(95.00%)均显著高于对照组(55.00%、77.50%),说明采用曲妥珠单抗联合奈达铂治疗HER-2阳性乳腺癌效果更好。同时研究发现,观察组患者血清CEA、CA125、CA153水平低于对照组,且治疗后对照组患者的CD3+、CD4+水平均显著高于观察组,CD8+水平显著低于观察组,说明采取曲妥珠单抗联合奈达铂治疗HER-2阳性乳腺癌对患者的免疫抑制程度更轻。分析原因在于曲妥珠单抗是一种靶向HER-2阳性乳腺癌的单克隆抗体,与HER-2受体结合,阻止其信号通路的激活,从而抑制肿瘤细胞的增殖和生长。奈达铂是一种铂类药物,可以与DNA结合,干扰DNA的合成和修复,从而诱导肿瘤细胞凋亡,起到杀灭肿瘤细胞的作用。曲妥珠单抗联合奈达铂治疗HER-2阳性乳腺癌,可以通过两种不同机制协同作用,达到更好的治疗效果。此外,两种药物的药物代谢和排泄方式不同,可以减少药物耐受性的发生。
综上所述,曲妥珠单抗联合顺铂化疗能显著提高HER-2阳性乳腺癌患者的临床疗效,同时可以减轻体内免疫抑制和炎性反应程度,对临床治疗具有重要的参考价值。