重症监护室老年重症患者应用营养支持优化疗法的临床观察
2023-11-02费榕顾永梅王煦
费榕,顾永梅,王煦
1. 海安市人民医院重症医学科, 江苏海安, 226600; 2. 海安市人民医院重症医学科中医康复科, 江苏海安 226600
重症监护室(intensive care unit, ICU)又称为加强监护病房综合治疗室,治疗、护理和康复可以同步进行,其提供的护理、治疗服务较普通病房更周全[1]。ICU收治患者的病情普遍处于危急状态,病情较严重且免疫力低,患者需要给予全方位密切观察和处理。ICU重症患者普遍存在碳水化合物代谢异常、脂肪代谢紊乱、蛋白质分解加速和胃肠道功能受阻等异常变化,这些机能异常均可导致重症患者出现营养不良,影响患者治疗和康复[2-3]。老年患者自身免疫力较弱,同时常伴有慢性基础病,可导致老年ICU重症患者营养不良风险更高,因此营养支持是老年ICU重症患者重要支持手段之一[4]。常规的营养支持主要指肠内营养支持,肠内营养支持疗法能够为危重症患者给予营养物质补给,有利于维持患者机体代谢正常运转,调节代谢紊乱[5]。营养支持优化疗法是根据患者自身情况进行个性化的营养支持手段,在满足患者机体基本消耗的同时,还能尽可能降低患者器官负担,有利于ICU重症患者的机能恢复和预后改善。淋巴细胞数是血液中淋巴细胞的总数,具有抵抗病毒、细菌等作用,能反映机体的免疫力状况[6]。白蛋白是由肝脏合成的参与营养物质、代谢废物运输的蛋白质,还具有维持血液渗透压等作用[7]。目前,关于营养支持优化疗法对老年ICU重症患者淋巴细胞计数、血清白蛋白和BMI等影响的研究尚存不足。因此,本研究选取本院ICU收治的老年重症患者为研究对象,探讨老年ICU重症患者营养支持优化疗法对淋巴细胞计数、血清白蛋白、 BMI等的影响,旨在为其临床诊治提供依据。
1 资料与方法
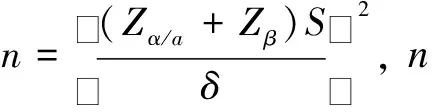
1.2一般资料本研究采取前瞻性、单中心、对照研究设计方案。选取2022年1月—2022年12月于海安市人民医院ICU收治的老年重症患者82例,根据数字表法随机分为:观察组(n=41)和对照组(n=41)。观察组中男性22例,女性19例;年龄61~80岁,平均年龄(70.3±5.0)岁;致病原因:重症肺炎18例,重症感染14例,严重心衰9例。对照组中男21例,女20例;年龄60~80岁,平均年龄(70.5±4.7)岁;致病因素:重症肺炎15例,重症感染16例,严重心衰10例。2组患者性别构成、年龄和致病因素构成等差异均无统计学意义(P>0.05),具有可比性。
1.3纳入和排除标准纳入标准: (1)患者年龄≥60岁; (2)住进ICU的患者; (3)发病前无意识、精神障碍疾病史; (4)入院前无合并感染性疾病; (5)患者或其家属对本研究均知情,签署知情同意书。符合上述全部标准的病例纳入本研究。排除标准: (1)患有先天性疾病; (2)治疗期间死亡; (3)预估患者救治后可能出现长期昏迷或意识、精神障碍等; (4)恶性肿瘤; (5)消化道损伤。具备以上任意1项标准的病例即排除。本研究获得本医院医学伦理委员会批准(伦理学批号为HKL2022168)。
1.4治疗方法2组患者均给予抗感染、酸碱平衡、电解质纠正和机械通气等常规治疗和对症治疗。(1)对照组患者采取常规肠内营养支持:患者进入ICU后,留置胃管作为营养支持干预方式,根据患者情况(肠内营养耐受性、热量需求)准备营养液,根据患者情况选取性给予流质食物,流质食物包括米汤、奶等,热量控制在6.26~12.0 MJ/d,营养液控制在1 000~2 000 mL/d,通过微量泵葡萄糖、氨基酸、维生素、脂肪乳剂等物质静脉输送,速度为65~100 mL/h,其余营养物质可以混合加入聚乙烯袋中给予患者静脉滴注。(2)观察组患者给予肠内营养支持优化疗法,肠内营养方式与对照组相同,肠内营养液给予原则为由稀至浓、由少至多,如入ICU治疗前2 d给予低剂量蛋白(<0.8 g/kg·d),待患者病情稳定后可逐渐增加总蛋白摄入量至1.2~2.0 g/kg·d;营养液的温度控制在35~37 ℃,预防患者腹泻、痉挛;整个过程采取无菌标准操作,患者床头上抬45 °,以半卧位进行营养支持以预防误吸;每2 h观察一次胃液残留量,若连续4 h胃液残留量>50 mL/次,则肠内营养液泵入速度减为原来流速一半,若1 h后仍是胃液残留量>50 mL/次,采取遵医嘱应用胃动力药物,胃肠减压,需要时放置小肠管;早期每隔2 h监测一次血糖,待血糖稳定后降低至每隔2 h监测一次血糖,以确保患者血糖波动范围为5~12 mmol/L,若患者血糖高出参考范围时改用低糖营养液或给予胰岛素,出现血糖降低时需要缓慢停用要素饮食。
1.5观察指标与方法于治疗前、治疗7 d时,进行指标观察: (1)采取患者清晨空腹静脉血5 mL,使用血细胞检测仪监测淋巴细胞计数,使用生化分析仪检测血清白蛋白、 C反应蛋白(C-reactive protein, CRP)、白介素-6(interleukin-6, IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α); (2)统计患者BMI变化; (3)使用急性生理学及慢性健康状况(acute physiology and chronic health conditions, APACHE Ⅱ)评分系统[8]评估患者病情恢复情况, APACHE Ⅱ总分范围0~71分,分值越高患者病情恢复越差; (4)超声心动图检测左室射血分数(left ventricular ejection fraction, LVEF)、左室收缩末期内径(left ventricular end systolic diameter, LVESD)、左室舒张末期内径(left ventricular end diastolic diameter, LVEDD); (5)统计患者的机械通气时间、入住ICU时间和住院时间; (6)记录患者治疗期间并发症发生情况,并发症包括腹胀、胃潴留、便秘和吸入性肺炎等。并发症总发生率=并发症例数/总例数×100%。

2 结果
2.12组患者淋巴细胞计数、血清白蛋白和BMI比较治疗前, 2组患者淋巴细胞计数、血清白蛋白水平和BMI差异均无统计学意义(P>0.05)。治疗7 d时, 2组患者淋巴细胞计数高于同组治疗前(P<0.05),观察组血清白蛋白水平高于同组治疗前(P<0.05);观察组患者淋巴细胞计数、血清白蛋白水平和BMI均高于对照组(P<0.05)。见表1。

表1 2组患者淋巴细胞计数、血清白蛋白和BMI比较
2.22组患者APACHEⅡ评分比较治疗前, 2组患者APACHE Ⅱ评分差异无统计学意义(P>0.05);治疗7 d时, 2组患者APACHE Ⅱ评分均低于同组治疗前(P<0.05),观察组患者APACHE Ⅱ评分低于对照组(P<0.05)。见表2。

表2 2组患者APACHE Ⅱ评分比较分)
2.32组患者LVEF、LVESD和LVEDD值比较治疗前, 2组患者LVEF、 LVESD和LVEDD值差异无统计学意义(P>0.05);治疗7 d时, 2组患者LVESD值均低于同组治疗前(P<0.05), 2组患者LVEF、 LVESD和LVEDD值差异均无统计学意义(P>0.05)。见表3。

表3 2组患者LVEF、 LVESD和LVEDD值比较
2.42组患者血清CRP、IL-6和TNF-α水平比较治疗前, 2组患者血清CRP、 IL-6和TNF-α水平差异均无统计学意义(P>0.05);治疗7 d时, 2组患者的CRP、 IL-6和TNF-α水平均低于同组治疗前(P<0.05),观察组患者CRP、 IL-6和TNF-α水平均低于对照组(P<0.05)。见表4。

表4 2组患者血清CRP、 IL-6和TNF-α水平比较
2.52组患者机械通气时间、入住ICU时间和住院时间比较观察组患者机械通气时间、入住ICU时间和住院时间均少于对照组(P<0.05)。见表5。

表5 2组患者机械通气时间、入住ICU时间和住院时间比较
2.62组患者并发症比较观察组患者出现腹胀、胃潴留各1例;对照组患者中腹胀2例、胃潴留3例、便秘1例、吸入性肺炎1例。观察组并发症总发生率低于对照组(P<0.05)。见表6。
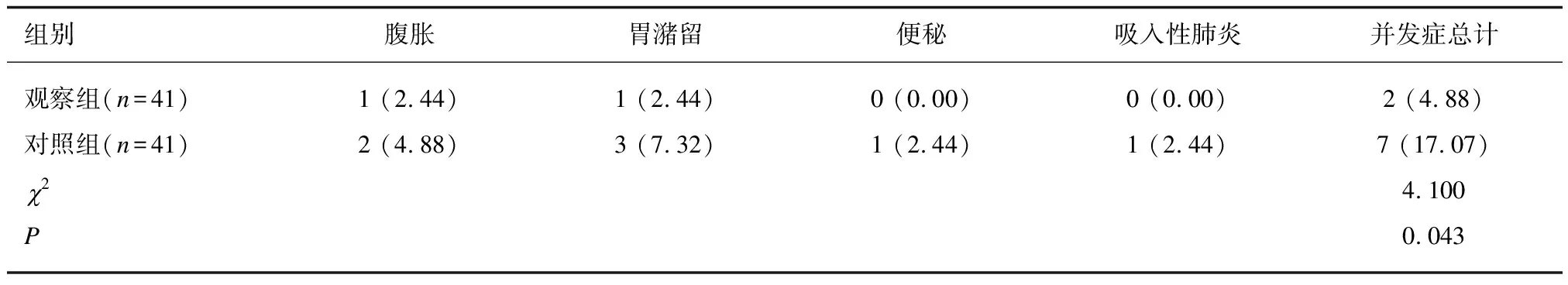
表6 2组患者并发症发生比较[例(%)]
3 讨论
老年ICU重症患者由于受到病情影响和身体功能降低,机体处于高代谢水平状态,导致老年ICU重症患者在接受治疗过程中需要补充足够的营养物质,改善患者的神经调节,恢复能量代谢平衡,有助于患者的病情缓解,改善患者预后[9-10]。本研究结果显示, 2种营养支持治疗7 d时患者的淋巴细胞计数较治疗前呈明显升高趋势, APACHE Ⅱ评分较治疗前呈明显降低趋势,观察组患者治疗7 d时的血清白蛋白水平高于其治疗前,与文献[11]研究结果趋势相似;此外,观察组患者治疗7 d时的淋巴细胞计数、血清白蛋白水平和BMI均明显高于对照组,而APACHE Ⅱ评分明显低于对照组。淋巴细胞是机体免疫应答功能的重要细胞成分,具有调节免疫的作用,淋巴细胞计数偏低提示免疫力降低[12]。白蛋白对血浆胶体渗透压有维持和调节作用,还对免疫球蛋白有保护作用,能够增强机体免疫力[13]。APACHE Ⅱ评分是急性生理评分、年龄评分、慢性生理评分构成的评分系统,能够帮助医生客观判断患者病情和评估患者预后情况,有利于制定更加准确、有效的治疗方案[14]。肠内营养支持是依靠患者肠黏膜的吸收功能,将其作为补充营养物质的途径,不仅能够给予患者及时补充营养,同时还能够增加患者肠黏膜的血流量,对肠道进行刺激产生激素、消化液,从而加快患者肠上皮组织的修复,防止患者因营养不良导致疾病进一步出现恶化,营养支持优化根据患者的自身情况进行个性化营养液泵入,由稀到浓、少到多,能够帮助ICU重症患者肠胃逐渐适应,从而能够更好的预防腹胀、感染以及肠功能不全等疾病的发生,能够在一定程度上增强患者自身的免疫力[15-16]。
肠内营养支持优化能够帮助ICU患者获得充分的营养并有效降低住院期间营养不良发生率[17], ICU重症患者自身病情危重,机体消耗负担增大,及时给予营养支持可以缓解机体过度消耗,但早期给予过量肠内营养物质,会加重脏器负担,加重机体炎症应激反应。本研究结果显示2种营养支持治疗7 d时患者LVESD值、 CRP、 IL-6和TNF-α水平较治疗前降低,并且观察组患者CRP、 IL-6和TNF-α水平降低趋势更明显,与文献[18]研究结果趋势相似,说明肠内营养支持优化疗法能够缓解ICU重症患者机体炎症反应,根据患者自身情况给予优化肠内营养支持,在改善患者营养状态的同时还可以提高患者的免疫能力,改善体内炎症代谢和器官损伤,缓解病情[19]。有研究[20]表明在静脉营养支持增加肠内营养支持能够有效减缓胃癌患者腹腔化疗对患者营养状况的影响,不仅可以降低不良反应发生率,还能加快患者肠道恢复,缩短住院时间。本研究结果显示,采取肠内营养支持优化疗法的老年ICU重症患者的机械通气时间、入住ICU时间和住院时间均明显短于行常规肠内营养支持的患者,并且治疗期间并发症总发生率也降低,说明给予老年ICU重症患者肠内营养支持优化法有助于缩短患者住院时间和降低并发症。
肠内营养支持有利能保证患者所需营养物质得到充分补足,营养物质能有效防止细菌移位,有助于改善患者的免疫功能和胃肠功能恢复[21]。肠内营养支持的应用是有条件的,需要患者的肠道功能没有太大损伤,而且远端的肠管没有梗阻现象,否则不能使用[22]。在给予患者进行肠内营养支持时,应当按照由少到多、慢到快、稀到浓的原则进行营养剂的给予,保证肠道能够有适应的过程,降低不良事件的发生[23]。在给予患者肠内营养支持时要加强对患者的监测,首先要明确导管在患者体外的位置,并定期进行检查确定导管无移位现象的出现。如果发现异常要及时进行调整,防止营养剂因管腔折叠、弯曲等因素影响返回进入食管,引起误吸。ICU重症患者大部分的胃肠排空功能不良,导致胃潴留的发生率较高,在给予患者肠内营养支持要求患者45 °半卧位,胃肠道耐受性差的患者需要适当的降低营养剂的输入量以及注入速度等。
综上所述,给予老年ICU重症患者肠内营养支持优化疗法更能提高患者的免疫力,缓解机体炎症反应,促进患者病情恢复,还能降低患者治疗期间并发症,缩短老年ICU重症患者的机械通气时间、入住ICU时间和住院时间,能够有效地改善患者的预后情况,因而其具有一定临床应用价值。但是本研究仍存在着许多不足之处,纳入的患者类型不够全面,具有一定的限制性,所以在后期的研究中将增加观察指标、扩大样本量,使其结果更加准确,从而能够为其临床治疗提供有力的依据。
