高强度间歇运动通过miR-124-3p/ERN1轴抑制吸烟相关的老年慢性阻塞性肺疾病炎症反应的机制
2023-11-02刘盼盼曾海珠张美兰章华丽高宏昌王雨濛陈果赵蕾
刘盼盼,曾海珠,张美兰,章华丽,高宏昌,王雨濛,陈果,赵蕾
1. 上海浦东新区公利医院呼吸与危重症医学科,上海 200135; 2. 上海浦东新区公利医院急诊科,上海 200135
慢性阻塞性肺疾病(COPD)是全球前三大死因之一[1],我国60岁以上人群中的患病率已超过27%[2],老年COPD患者往往合并高血压、心功能不全、糖尿病及肌少症等多系统疾病,尽管现有治疗取得了一定进展,但在提高生活质量、降低死亡率方面仍没有突破,运动训练可改善运动耐力、调剂免疫功能[3],在老年COPD中开展运动训练可协同改善机体多系统病变[4]。
运动训练作为一种炎症反应的应激因子,可以增强机体的抗炎能力,增加抗炎症因子表达[5-6]。利用转录组学技术对老年COPD患者运动前后的差异基因进行富集分析发现,这些基因主要富集在炎症反应相关通路中,且有多种微小RNA (microRNA, miRNA)被证明参与肺部炎症反应[7-9]。其中miR-124-3p,被发现在COPD合并肺动脉高压的患者中表达水平上调且与肺部炎症反应相关[10-11]。然而, miR-124-3p在COPD运动训练治疗中的作用和潜在机制尚不清楚。通过生物信息学分析发现ERN1(Endoplasmic Reticulum To Nucleus Signaling 1, ERN1)与miR-124-3p之间存在相互关系。因此,本研究通过分析COPD患者运动训练前后miR-124-3p, ERN1以及其他分子标志物的表达水平改变及两者之间的靶向关系,确定miR-124-3p/ERN1轴对COPD的调节机制,旨在为运动训练改善老年COPD患者预后的作用机制提供可靠的试验基础。
1 资料与方法
1.1一般资料选择2020年11月15日—2021年11月30日于浦东新区公利医院呼吸科诊治的150例患者作为研究对象,分为非吸烟组(非吸烟且肺功能正常者,n=50)和吸烟非COPD组(吸烟且肺功能正常者,n=50)、 COPD组(COPD患者,n=50)。所有研究对象纳入标准:年龄≥60岁;意识清楚,能够执行治疗指令;完成肺功能检测,根据GOLD(慢性阻塞性肺病全球倡议),若FEV1/FVC>70%,则根据吸烟史分别纳入非吸烟组和吸烟组(各50例);而吸入支气管舒张剂后, FEV1/FVC<70%,排除其他肺部疾患则纳入COPD组(50例)。排除标准:患有不稳定型心绞痛、药物未控制的充血性心力衰竭和高血压病、近期心肌梗塞、重度肺动脉高压、既往有运动后晕厥史、影响运动的骨关节病、肝肾衰竭晚期、认知功能障碍。
所有入组者均在清晨8点空腹采集5 mL静脉血,其中COPD患者分别于运动前和运动12周后抽取。血样用乙二胺四乙酸(EDTA)抽真空管进行存储,用梯度离心法分离出外周血白细胞及血清,储存在-80 ℃的条件下备用。所有受试者均签署知情同意书,本研究经上海市浦东新区公利医院临床医学伦理委员会批准(伦理批号[2020]临审第014号)。
1.2高强度间歇运动训练功率及方案实施按照COPD患者的心肺运动功能,制定适合该个体的高强度运动(即△50%功率),△50%功率=(无氧阈测定功率+极限运动测定功率)/2-功率递增速率×0.75±10。运动方案[12]:每天1 h(分2~3次完成),每周5次,共12周。运动期间无法维持转速 (55~65 r·min-1)或肺部出现明显哮鸣音或Borg疲劳评分大于14则需暂停运动,等待下一个开始指令。
1.3香烟颗粒制备及细胞培养用恒速真空泵将卷烟烟雾抽吸到10 mL RPMI1640介质中,通过0.22μm过滤器进行灭菌。获得的CSE溶液在1 h内用于试验。气道上皮细胞(16HBE)购自中科院上海细胞研究所,使用添加10%牛血清和1%青霉素/链霉素的RPMI1640培养基,在37 ℃ 5% CO2培养箱中培养及转染。
1.4细胞培养及转染气道上皮细胞(16HBE)购自中科院上海细胞研究所,使用添加10%牛血清和1%青霉素/链霉素的RPMI1640培养基,在37 ℃ 5% CO2培养箱中培养。利用pcDNA, pcDNA-ERN1及miR-124-3p模拟物, miR-124-3p抑制剂分别调节ERN1或miR-124-3p的表达水平,在细胞对数生长期转染到16HBE细胞中。该序列购自GenePharma (Shanghai, China)。转染试剂为lipofectamine 3 000 (Invitrogen, Carlsbad, CA, USA),按照试剂盒说明书进行操作。
1.5qRT-PCR检测提取总RNA,利用逆反应试剂盒合成cDNA后在7500实时PCR系统上使用SYBR green I Mater Mix试剂盒(Invitrog)进行qRT-PCR。通过相对定量(2-△△Ct法)计算倍数变化。PCR引物描述如下: miR-124-3p:正向5′-ATGTTCACAGCGGACCTTGAT-3′和反向5′-TTCACCGCGTGCCTTAATTG-3′; ERN1:正向5′-GAGATGTGGCCCTGAAACCT-3′和反向5′-AGCAAGCTCATCCGGTGAAA-3′; β-actin:正向5′-GCCAACCGTGAAAAGAT-3′和反向5′-AGAGCATAGCCCTCGTAGAT-3′; U6:正向5′-CTCGCTTCGGCAGCACA-3′和反向5′-AACGCTTCACGAATTTGCGT-3′。
1.6酶联免疫吸附试验(ELISA)通过测定细胞培养上清中促炎细胞因子的水平来分析细胞模型的炎症反应。ELISA试剂盒(博斯特生物技术公司,中国武汉)用于检测白细胞介素(IL)-1β、 IL-6、 IL-8和肿瘤坏死因子(TNF)-α的水平,按照参照试剂盒说明书进行操作。
1.7细胞活性及凋亡测定将对数生长期的16HBE细胞接种于96孔板中,每孔2×103培养48 h后,加入10 μLCCK-8试剂(上海Beyotime),避光孵育2 h后使用Bio-Rad酶标仪测定吸光度值(波长490 nm)。使用FITC-AnnexinV凋亡检测试剂盒(BD)测定细胞凋亡,按照说明书步骤将不同处理后的细胞收集离心,用PBS冲洗后在室温下用膜联蛋白V(AnnexinV)和碘化丙啶(PI)在室温下避光孵育10 min,用FACS Calibur流式细胞仪(BD)检测细胞凋亡率。

2 结果
2.13组人口学特点比较非吸烟组、吸烟组、 COPD组年龄、性别构成、 BMI及吸烟史等差异无统计学意义(P>0.05);组间两两比较, FEV1/预计值、 FEV1/FVC差异均有统计学意义(P<0.001); COPD组肺功能1级3例, 2级27例, 3级20例。
2.2COPD患者血清miR-124-3p及相关炎症因子表达水平比较与非吸烟组比较,吸烟组患者血清miR-124-3p表达水平降低,而COPD组则更低(P<0.001,图1A)。肺功能3级患者血清miR-124-3p的表达较1~2级患者明显降低(P<0.001,图1B),但是miR-124-3p的表达水平与肺功能无明显相关性(r=-0.1148,P>0.05)。COPD患者血清TNF-α、 IL-6表达水平高于吸烟组及非吸烟组(P<0.05),提示运动可下调TNF-α、 IL-6表达水平(图1C)。

注: (A) 吸烟非COPD组与非吸烟组比较, miR124-3p低表达,与非吸烟组比较, COPD组的miR124-3P表达水平更低。(B)肺功能3级COPD患者的血清miR124-3p低于1~2级的患者。(C) 与非吸烟组相比, COPD组外周血中的TNF-α表达增高,而吸烟组, COPD运动训练后的表达差异无统计学意义(P>0.05);与吸烟组比较, COPD患者的TNF-α表达水平增高,运动训练后降低(###P<0.001)。COPD:慢阻肺患者; COPD+Exercise: COPD患者运动训练后; Non-smokers:非吸烟的肺功能正常者; Smokers:吸烟的肺功能正常者。与非吸烟组比较,**P<0.001;与肺功能1-2级组比较,***P<0.001;与吸烟组比较,##P<0.001;与COPD组比较,###P<0.001。
2.3miR-124-3p过表达可减轻香烟烟雾诱导的16HBE细胞凋亡和炎症反应随着CSE浓度的增加,细胞内及培养基中miR-124-3p水平逐渐降低,浓度为2%和4%时miR-124-3p水平被显著抑制(图2A-B),后续细胞试验采用2% CSE处理24 h。转染miR-124-3p模拟物后,细胞及培养液中miR-124-3p水平显著升高,而转染抑制剂后,细胞miR-124-3p水平则相反(P<0.01,图2C)。miR-124-3p过表达显著促进细胞活力,抑制烟雾诱导的细胞凋亡(P<0.001,图2D~E, G~L)。CSE促进16HBE细胞释放IL-6、 IL-8、 IL-1β和TNF-α,而miR-124-3p过表达逆转了以上趋势(P<0.001,图F)。这说明miR-124-3p过表达可抑制CSE诱导的16HBE细胞凋亡和炎症反应。
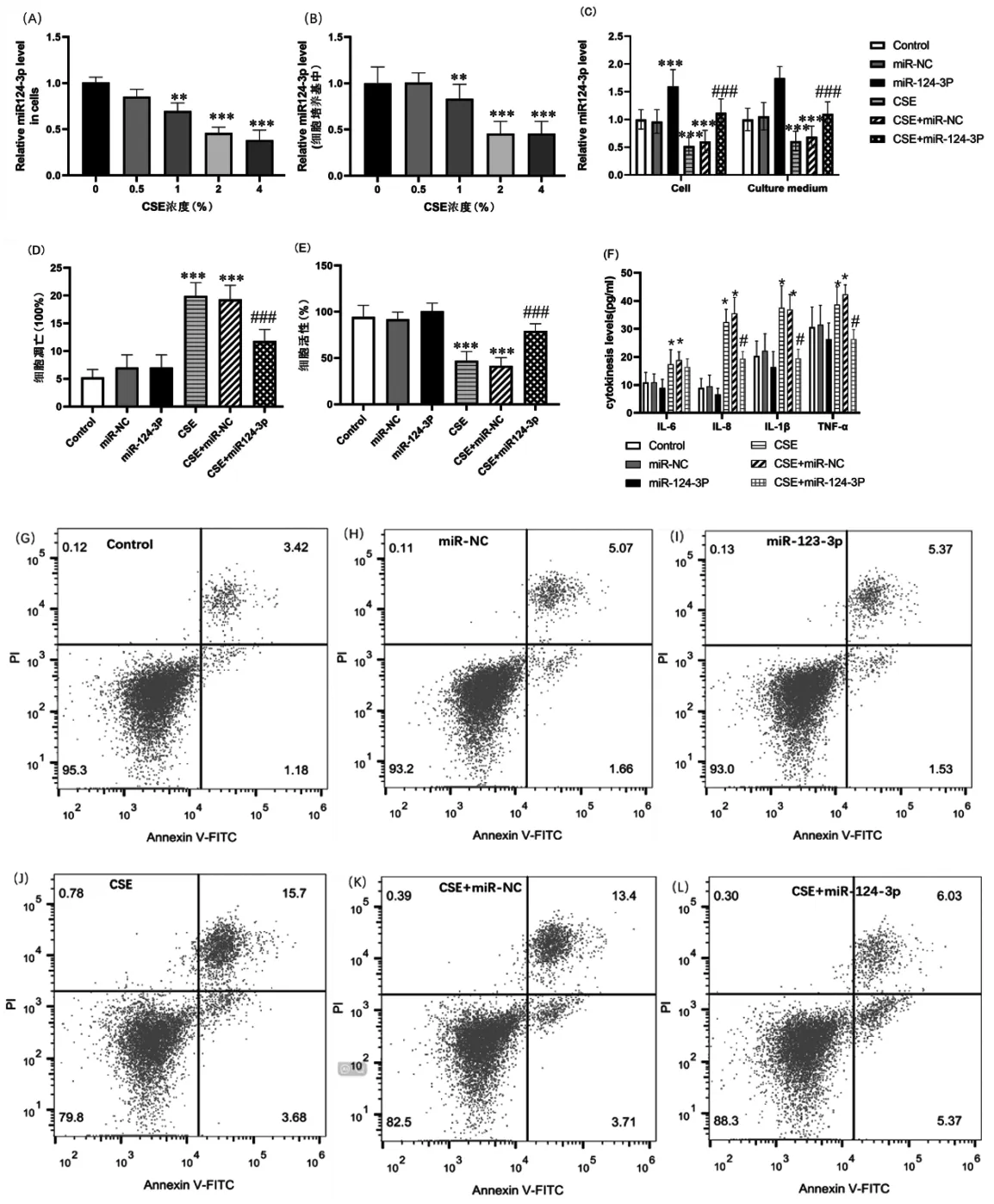
注: (A-B)细胞中及培养液中miR124-3P水平随CSE浓度降低。(C) miR124-3P模拟物转染细胞后,细胞内和细胞培养液中其表达水平均显著上调。(D)和(E) miR124-3P过表达可促进细胞活力,抑制烟雾诱导的细胞凋亡。(F) 烟雾可促进16HBE细胞释放IL-6、 IL-8、 IL-1β和TNF-α,而miR124-3P过表达可逆转这种作用。(G-L)烟雾刺激诱导细胞凋亡增多, miR124-3P过表达可逆转这种作用。与对照组比较, *P<0.05, **P<0.01, ***P<0.001, #P<0.05;与CSE组比较, ###P<0.001。
2.4ERN1是miR-124-3p的下游靶点,可通ceRNA网络调控发挥作用miR-124-3p与ERN1 3’UTR之间存在互补序列(图3A)。荧光素酶报告表明,转染miR-124-3p模拟物显著促进了与ERN1-Wt共转染的细胞的荧光素酶活性,而转染miR-124-3p抑制剂则具有相反的效果(图3B), ERN1-Mut细胞的荧光素酶活性不受miR-124-3p表达水平的影响(图3B)。在CSE处理的16HBE细胞中转染miR-124-3p模拟物后ERN1显著下调,而转染miR-124-3p抑制剂后其表达显著上调(P<0.001,图3C)。与非吸烟者相比, ERN1在吸烟者中表达较高, COPD中ERN1的表达较吸烟者更高(图3D)。而运动训练后COPD中ERN1水平降低,且与miR-124-3p水平呈负相关(r=-0.644,P<0.001)。
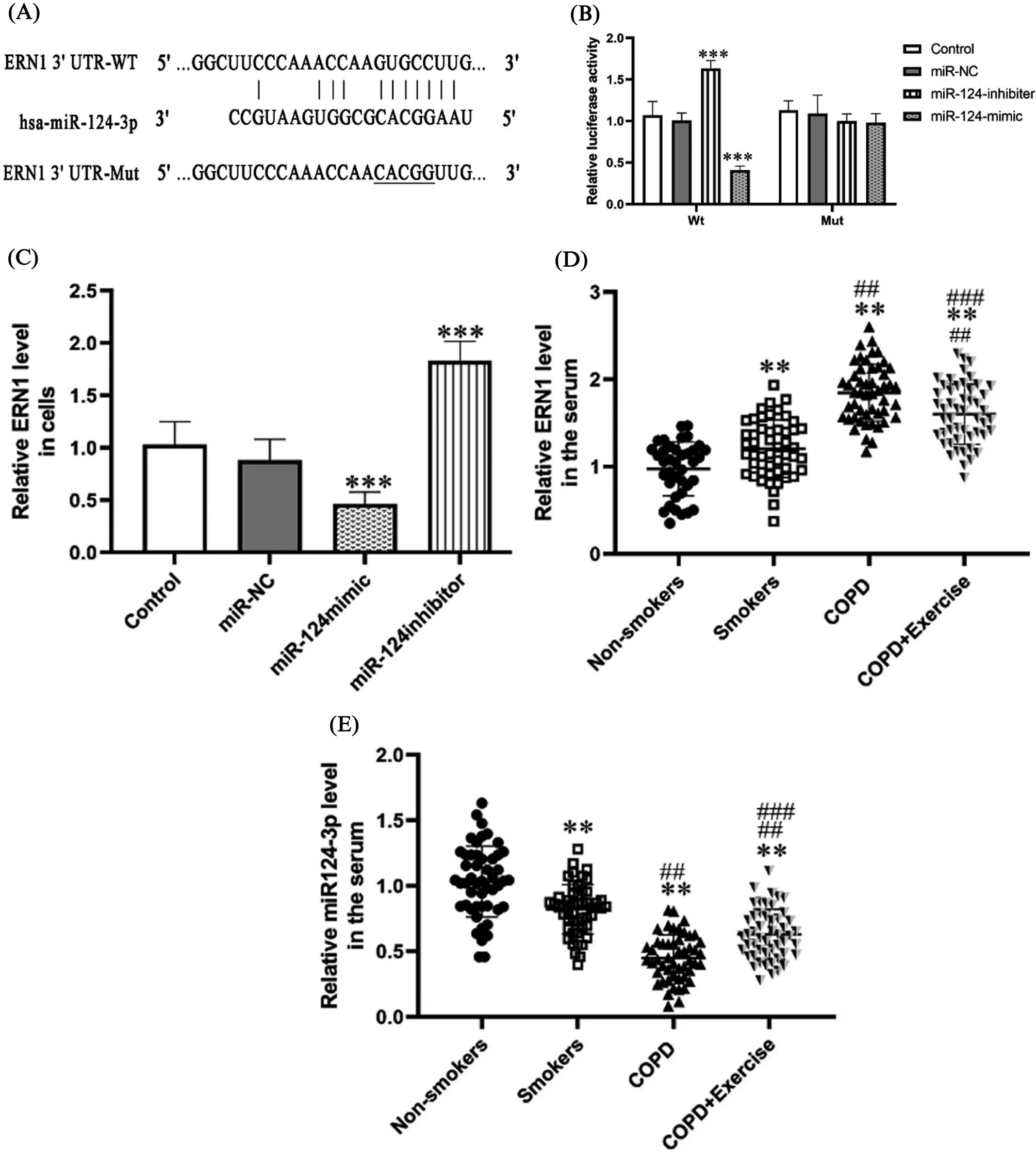
注: (A)miR-124-3p与ERN1的3 ’-UTR互补序列。(B)野生型和突变型的细胞中荧光素酶活性的差异。(C)不同处理条件下的ERN1 mRNA表达水平。(D-E)不同血清样本中ERN1 mRNA水平以及miR-124-3p的表达水平。与对照组和非吸烟组比较, ***P<0.001;与吸烟组比较, ##P<0.05;与COPD组比较, ###P<0.001。
3 讨论
老年COPD患者存在多系统共病,导致其生活质量降低,而规律的中高等强度运动可减轻机体抗炎反应、调节免疫代谢状态,在老年COPD患者中推广运动训练是减轻医疗负担改善预后的重要措施,但运动训练的作用机制不明。因此明确运动训练是否通过ceRNA网络发挥作用将为COPD康复治疗提供理论基础。miR-124-3p产生于多种细胞,其可调节肺血管内皮细胞增殖和炎症[13]。CSE处理的16HBE细胞和细胞培养液中miR-124-3P水平均降低和炎症因子增高,说明miR-124-3p参与了吸烟相关的COPD发展。过表达miR-124-3p降低ERN1及相关炎症因子的水平,而miR-124-3p下调则反之,结合荧光素酶试验证实ERN1作为miR-124-3p的下游靶点通过ceRNA网络发挥作用。同时,与非吸烟者相比, ERN1在吸烟者中表达较高, miR-124水平减少;而COPD又较吸烟组更明显,这与CSE处理的16HBE细胞中观察到的结果一致(图2E),而运动训练则可逆转miR-124的下调及ERN1的升高趋势,这说明运动可能通过靶向miR-124-3p抑制ERN1表达,减轻吸烟相关COPD气道炎症。
此研究探索了在老年COPD患者中实施高强度运动训练前后外周血中miR-124-3p, ERN1及炎症因子的表达水平变化,通过体外试验验证miR-124-3p与ERN1的靶向关系,及其参与运动调节COPD机体炎症的作用机制。但本研究仅在细胞水平进行机制探讨,因此存在以下局限:首先本研究仅以烟雾刺激的角度探讨了miR-124-3p对机体炎症的调控,还需进一步小鼠模型验证;其次仅验证了调节miR-124-3p对炎症因子的影响,未验证ERN1是否可直接调节炎症因子表达,仍需要进一步的动物实验及组织表达水平检测对此结果行进一步验证。
