miRNA-223在老年人非酒精性脂肪肝患者中的表达变化及诊断价值
2023-11-02张颖童依丽刘雪静潘逸茹保志军
张颖,童依丽,刘雪静,潘逸茹,保志军, 2
1. 复旦大学附属华东医院消化科,上海 200040; 2. 上海市老年医学临床重点实验室,上海 200040; 3. 复旦大学附属华东医院检验科,上海 200040
非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)是一类与胰岛素抵抗(insulin resistance, IR)密切相关的代谢应激性肝损伤性疾病[1],可进一步发展为非酒精性脂肪性肝硬化以及原发性肝癌。NAFLD的发病具有显著的年龄相关性,流行病学调查结果显示,我国NAFLD患病率为20.09%, 60岁以上的老年人群患病率高达44.43%[2]。然而对老年NAFLD的认识及其危害性并没有得到足够重视,寻找一个简便有效的诊断方法进行早期干预治疗尤为重要。
微小RNA(microRNA, miRNA)作为一种重要的转录后调节因子,在肝脏脂质代谢、胰岛素抵抗以及衰老等生物学过程中发挥特有的调控作用[3]。高通量测序结果发现并证实, miR-223在衰老NAFLD大鼠肝组织中的表达显著上调[4]。但是关于miR-223在胰岛素抵抗中的应用研究报道较少。本研究基于前期实验结果,探讨分析血清miR-223在老年NAFLD患者中的表达变化及其潜在的临床意义和诊断价值,为老年人NAFLD的早期诊断和早期预防提供理论依据。
1 资料和方法
1.1研究对象2019年5月—2020年10月复旦大学附属华东医院消化科和老年科具备完整病史资料的非酒精性脂肪肝门诊和住院病例(NAFLD组),年龄≥65岁,共80例,诊断标准和排除标准参照《非酒精性脂肪性肝病诊疗指南(2018年更新版)》[1]。选择我院同期体检的非脂肪肝老年人80例为对照组。所有受试者均经B超检查,并测量身高、体重,计算体质量指数(BMI)(BMI=体重/身高2)。其中NAFLD组男57例(71.3%),女23例(28.7%),年龄65~89岁,平均(76.3±5.4岁);对照组男60例(75.0%),女20例(25.0%),年龄65~88岁,平均(75.5±6.0岁)。2组性别、年龄无统计学差异(P>0.05),具有可比性(表1)。本研究经复旦大学附属华东医院伦理委员会审查批准(20170078),入组人群均知情同意。
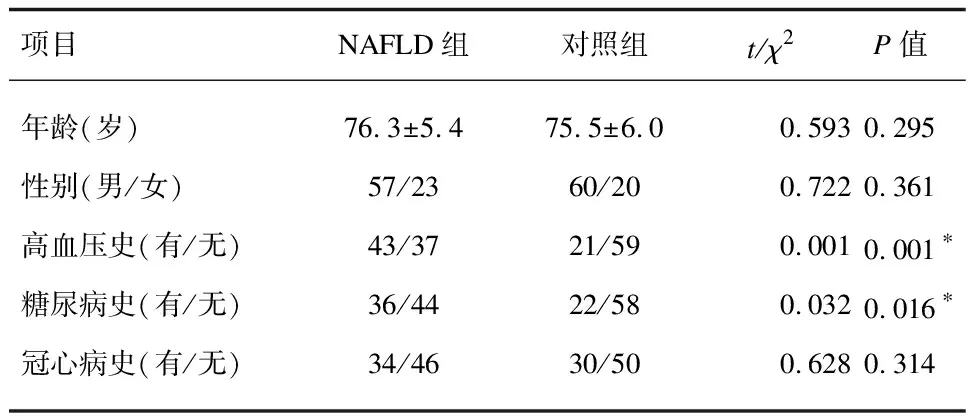
表1 2组一般资料比较(n=80)
1.2标本采集及常规生化检测清晨空腹采血, 3500rpm离心10min,取上清液,全自动生化分析仪检测肝功能(ALT、 GGT)、血糖(FPG)、血脂(TG、 Ch、 LDL、 HDL)。剩余血清-80 ℃保存以备用。
1.3瞬时弹性成像技术(Fibroscan)检测受试者取仰卧位,右手抱头, Fibroscan-520机型检测仪(Echosens公司,法国)测定受控衰减参数(controlled attenuation parameters, CAP)。由同一名经验丰富的临床医师使用M型探头在患者右侧腋中线第7~9肋间进行测量,连续有效检测10次,取中位数为最终测定结果。
1.4实时定量PCR法检测血清miR-223表达水平按血清RNA抽提试剂盒(TIANGEN公司,北京)操作说明书提取总RNA, NanoDrop超微量分光光度计(Thermo公司,美国)检测RNA浓度,吸光度(OD260/OD280)比值在1.8~2.0时,说明提取的RNA纯度高,无蛋白质残余。按逆转录试剂盒(TaKaRa公司,日本)说明书进行逆转录, cDNA保存于-20℃。引物由上海生工生物工程有限公司合成。引物序列为:F: 5′-ACACTCCAGCTGGGTGTCAGTTTGTCAAAT-3′, R: 5′-CTCAAGTGTCGTGGAGTCGGCAA-3′, GADPH为内参。将逆转录产物稀释至2倍作为模板进行实时定量PCR检测,反应体系为20 μl。反应条件:50 ℃预变性30 s, 95 ℃ 15 s, 60 ℃ 30 s, 72 ℃ 30 s,共40个循环。实时定量PCR结果以Ct值(Cycle threshold)表示, miR-223相对表达量采用2-ΔΔCT法计算。每个样本重复3次。

2 结果
2.1一般资料比较表1可见老年NAFLD组合并高血压、糖尿病者高于健康对照组,差异有统计学意义(P<0.05)。
2.2血清生化指标比较与健康对照组相比, NAFLD组BMI、 ALT、 GGT、 TG、 Ch、 FBG增高(P<0.05), HDL降低,差异有统计学意义(P<0.05)。见表2。
表2 2组各项检测指标比较
2.3Fibroscan检测结果比较NAFLD组CAP值高于对照组,差异有统计学意义(t=11.895,P=0.001)。见表2。
ALT丙氨酸氨基转移酶, GGT γ-谷氨酰转肽酶, TG甘油三酯, Ch胆固醇, LDL低密度脂蛋白, HDL高密度脂蛋白, FBG空腹血糖。
2.4miR-223在2组患者血清中的表达变化实时定量PCR结果显示, NAFLD组患者血清miRNA-223表达水平高于对照组,差异有统计学意义(0.92±0.60) vs (0.40±0.29),t=3.175,P=0.003)见图1。

图1 miR-223在老年NAFLD患者血清中的表达
2.5miR-223与各指标的相关性分析Pearson相关分析结果显示, miRNA-223与TG(r=0.387), LDL(r=0.363), HDL(r=0.394)呈正相关(P<0.05),而与年龄(r=0.121), BMI(r=-0.151), ALT(r=-0.109), GGT(r=-0.157), Ch(r=-0.108), FBG(r=-0.280), CAP(r=0.109)无相关性(P>0.05),见表3。

表3 miR-223与各指标的相关性分析
2.6血清miR-223对老年人NAFLD的诊断价值ROC曲线分析结果显示, AUC为0.809(95%CI: 0.675~0.943,P=0.001),见图2。
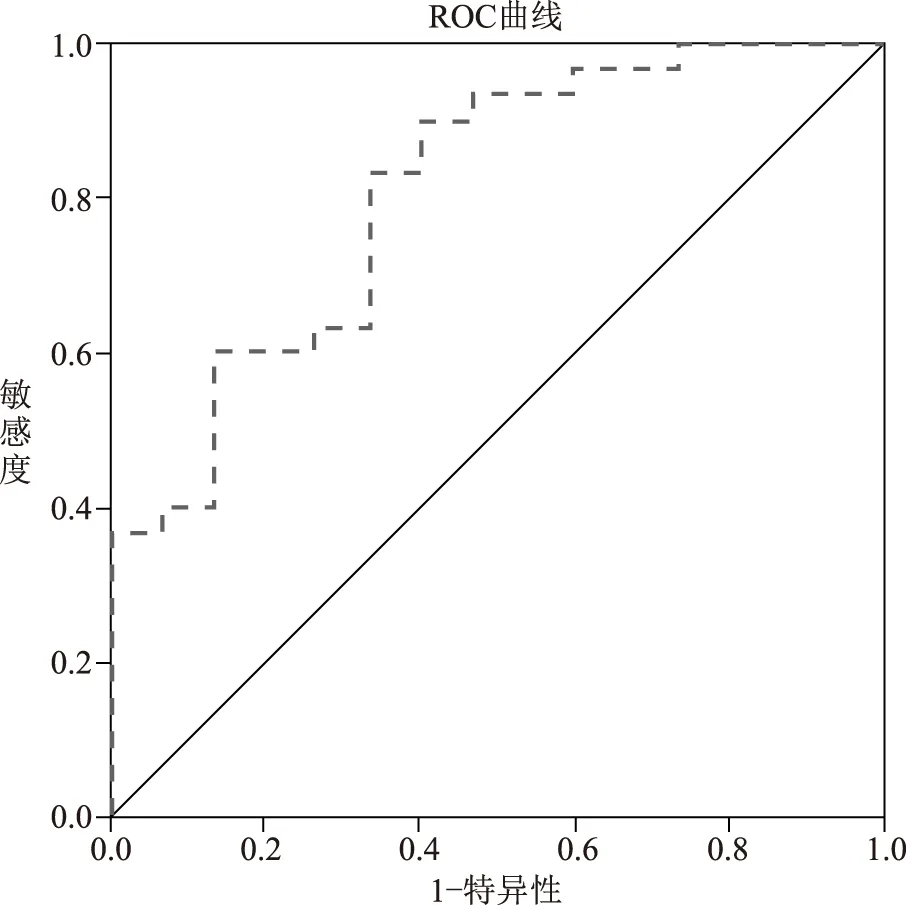
图2 ROC曲线图
3 讨论
miRNAs是一类大小为21~23nt (nucleotide)的单链小分子RNA,与靶基因mRNA 3′端非翻译区(3′UTR)完全或不完全互补结合,在转录或转录后水平对mRNA进行转录抑制或促使其降解,影响目标mRNA的稳定性及翻译,从而达到调控靶基因表达的目的[3]。已有报道证实, miR-34a、 miR-155、 miR-122在人类NAFLD肝组织中表达异常,这些miRNAs可能通过打破胰岛素代谢以及调节胆固醇和脂肪酸之间的平衡,参与了NAFLD的发生与发展[3,5,6]。但是这些研究样本量少,缺乏对老年NAFLD患者的独立研究以及长期随访追踪,存在一定程度的局限性。
本课题组在前期的动物实验中已经发现并证实[4], miR-223在衰老大鼠脂肪肝组织中表达明显上调。miR-223定位于X染色体,最早在造血系统得到确认,在促进造血干细胞的增殖分化中起了重要的调控作用[5]。后续研究陆续报道, miR-223在胃癌、肝癌、卵巢癌等肿瘤组织,以及类风湿性关节炎、骨关节炎等免疫炎症性疾病等多种疾病中同样起着重要的调控作用[7-8]。然而关于miR-223在NAFLD以及胰岛素抵抗中的作用报道甚少,仅有几篇文章提示miR-223在人类和肥胖小鼠中有异常表达[9-10]。
本组课题研究结果表明,老年NAFLD组患者BMI、 CAP值以及血清ALT、 GGT、 TG、 Ch、 FBG水平高于对照组(P<0.05),提示老年NAFLD患者存在明显的胰岛素抵抗。血清miRNA-223在NAFLD患者中呈现高表达水平(P=0.003),提示miRNA-223与老年人胰岛素抵抗密切相关,可能参与了老年人NAFLD的发生发展,这与我们前期动物实验的结果相符[4,11]。进一步所做的直线相关性分析表明,血清miRNA-223的表达与老年NAFLD组TG、 LDL以及HDL水平呈显著正相关(P<0.05),提示老年NAFLD患者血脂水平的异常可能受到了血清miR-223的调控,血清miRNA-223或可成为老年NAFLD患者更为敏感的检测指标,为老年人脂肪肝的无创性筛查提供了新的手段。CAP值作为评估肝脏脂肪变的重要参数,在评估包括NAFLD在内的各种慢性肝脏疾病的脂肪变方面已得到广泛认可[12],但是本组研究结果并未发现miR-223的表达与CAP值有显著相关性(r=0.109,P>0.05)。ROC曲线分析结果显示AUC为0.809 (P=0.001),进一步证实血清miR-223对老年NAFLD患者有诊断意义。
综上所述, miR-223在老年NAFLD患者血清中表达显著升高,并与TG、 LDL、 HDL呈正相关性。miR-223在循环血液中稳定性表达的特点预示着其可能成为诊断老年人非酒精性脂肪肝的潜在标志物,为老年人早期诊断和早期预防NAFLD提供理论依据。本课题组尚未对患者进行长期追踪随访,后续研究需要更多的样本量来进行综合有效地评估,并进一步积极探索miR-223在调控衰老机体脂肪肝变中的发生发展机制。
