附子白绢病拮抗细菌的分离鉴定及发酵条件优化
2023-11-02施春兰汤永玉叶坤浩曾舒泉张永科何霞红魏朝霞曾华兰叶鹏盛吴国星
施春兰 汤永玉 叶坤浩 曾舒泉 张永科 何霞红 魏朝霞 曾华兰 叶鹏盛 吴国星





DOI:10.3969/j.issn.2095-1191.2023.06.013
摘要:【目的】從黄粉甲中分离获得对附子白绢病病原菌具有较好抑制作用的拮抗细菌,为附子白绢病的生物防治提供菌种资源。【方法】以罹病黄粉甲为材料,通过稀释涂布法和平板对峙法分离并筛选对附子白绢病菌具有拮抗作用的细菌,通过形态结构、生理生化特征及16S rDNA序列分析等对拮抗细菌进行种类鉴定;以拮抗细菌发酵液在600 nm波长下的OD值为指标,采用单因素试验的方法对拮抗细菌的培养基组分以及发酵条件进行优化;通过室内盆栽试验明确拮抗细菌对附子白绢病的防治效果。【结果】采用稀释涂布法从罹病黄粉甲中分离获得4株细菌,经平板对峙法筛选获得对附子白绢病菌具有较好拮抗效果的菌株TS1,该菌对齐整小核菌菌丝生长的抑制率可达68.03%。根据菌株TS1的菌落形态结构、生理生化特征及16S rDNA序列分析结果,确定菌株TS1为枯草芽孢杆菌(Bacillus subtilis)。菌株TS1的优化培养基配方:蛋白胨10.0 g/L、酵母浸粉5.0 g/L、麦芽糖15.0 g/L;最佳发酵条件:装液量30 mL、初始接种量0.50%、转速210 r/min、培养温度42 ℃、初始pH 9、培养时间48 h。室内盆栽保护和治疗试验结果表明,菌株TS1对附子白绢病的平均防治效果分别为49.39%和62.97%。【结论】优化的发酵方案可用于快速、大批量培养菌株TS1菌悬液。菌株TS1对附子白绢病有较好的防治效果,具有开发成附子白绢病生防菌的潜力。
关键词:黄粉甲;内生细菌;枯草芽孢杆菌;齐整小核菌;发酵条件;防治效果
中图分类号:S435.672 文献标志码:A 文章编号:2095-1191(2023)06-1720-12
Isolation, identification and fermentation conditions optimization of antagonistic bacteria against southern blight on
Aconitum carmichaeli
SHI Chun-lan1, TANG Yong-yu1, YE Kun-hao1, ZENG Shu-quan1, ZHANG Yong-ke1, HE Xia-hong1, WEI Zhao-xia1, ZENG Hua-lan2, YE Peng-sheng2, WU Guo-xing1*
(1College of Plant Protection,Yunnan Agricultural University,Kunming,Yunnan 650201,China; 2Institute of Industrial Crop Breeding and Cultivation,Sichuan Academy of Agricultural Sciences,Chengdu,Sichuan 610066,China)
Abstract:【Objective】This study screened and obtained antagonistic bacteria with good inhibitory effect on the pathogen of southern blight on Aconitum carmichaeli from Tenebrio moliter, so as to provide strain resources for the biological control of southern blight on A. carmichaeli. 【Method】Using diseased T. moliter as the material, the bacteria with antagonistic effect on southern blight on A. carmichaeli was isolated and screened by dilution coating and plate confrontation methods. The antagonistic bacteria was identified by morphological, physiological and biochemical characteristics and 16S rDNA sequence. With the OD value of bacterial fermentation broth at 600 nm as the index, the culture medium components and fermentation conditions of antagonistic bacteria were optimized by single factor experiment. The control effect of antagonistic bacteria on southern blight on A. carmichaeli was confirmed by pot experiment in laboratory. 【Result】Four strains of bacteria were obtained from T. moliter by dilution coating method. And TS1 strain with greater antagonistic effect against southern blight on A. carmichaeli was obtained by plate confrontation method, with an average inhibitory rate for Sclerotium rolfsii mycelial growth of 68.03%. The TS1 strain was identified as Bacillus subtilis based on its morphological, physiological and biochemical characteristics and the result of 16S rDNA sequence analysis. The optimized medium formula was peptone 10.0 g/L, yeast extraction powder 5.0 g/L and maltose 15.0 g/L. The optimal fermentation conditions were 30 mL of liquid, 0.50% of initial inoculum, 210 r/min of rotation speed, 42 ℃ of temperature, initial pH 9, and 48 h of incubation. The results of laboratory pot experiment and experimental treatment showed that the average control efficiency of TS1 strain against southern blight on A. carmichaeli were 49.39% and 62.97% respectively. 【Conclusion】The optimized fermentation scheme can be used to rapidly culture TS1 strain suspensions in large quantities. TS1 strain has a good control effect on southern blight on A. carmichaeli and has the potential to be developed into a biocontrol bacterium for southern blight on A. carmichaeli.
Key words: Tenebrio moliter; endogenous bacteria; Bacillus subtilis; Sclerotium rolfsii; fermentation conditions; control effect
Foundation items: Sichuan Provincial Regional Innovation Cooperation Project (2021YFQ0022); Yunnan Science and Technology Planning Project (202105AC160037)
0 引言
【研究意义】附子(Aconitum carmichaeli)是双子叶植物纲原始植物花被亚纲毛茛目毛茛科金莲花亚科乌头属植物,可形成块根,可作为块根类植物的代表(李玉龙,2019)。附子在我国有很高的药用价值,在四川、陕西和云南均有种植,其加工品有回阳、温理逐寒、止痛等功效(陈芳,2007)。附子白绢病是由齐整小核菌(Sclerotium rolfsii)引起的土传性真菌病害,主要危害附子的根茎部,对我国附子的产量和质量产生较大影响,与霜霉病、根腐病及病毒病混发严重时减产率可达50%以上(唐莉等,2004)。此外,齐整小核菌还会侵染辣椒、魔芋和花生等作物,宿主十分广泛,可侵染500种以上的植物物种(Iquebal et al.,2017),造成严重的经济损失。目前,对于白绢病的防治以化学药剂井冈霉素、噻呋酰胺、氟酰胺和异菌脲等杀菌剂为主,但由于长期不规范用药,造成环境污染、农药残留、病原菌抗性增强等一系列问题。因此,利用绿色高效生防菌进行生物防治对附子的安全无公害生产具有重要意义。【前人研究进展】目前,已报道防治附子白绢病的生防菌主要有芽孢杆菌(Bacillus sp.)、假单胞杆菌(Pseudomonas adaceae)、绿粘帚霉(Gliocladium virens)、木霉菌(Trichoderma)、青霉菌(Penicillium)、根瘤菌(Rhizobium)和链霉菌(Streptomycetaceae)等(李敏等,2022)。其中,枯草芽孢杆菌(B. subtilis)和木霉菌等生防菌已作为菌剂广泛投入市场,实现商品化(阮盈盈和刘峰,2020)。宋漳和陈辉(2002)从百合根部分离得到1株绿色木霉T02,用其对齐整小核菌进行抑菌试验,结果显示其拮抗系数为2~3;刘任等(2005)用甲醇法、乙醇法、超声波水法和碱法等4种方法对哈茨木霉(T. harzianum)T2菌株分生孢子中的抗菌物质进行提取,并通过抑菌试验测定各种粗提物对齐整小核菌的抑菌活性,发现其活性均较好,其对齐整小核菌的抑制活性可达82.2%;文毅(2010)从鱼腥草根际分离得到枯草芽孢杆菌B8,该菌对附子白绢病的盆栽防效可达56.8%;胡朝晖等(2017)从蚕沙发酵肥中分离得到枯草芽孢杆菌、荧光假单胞菌(Psdeuomnoda fluoerncnet)、类芽孢杆菌(Paenibacillus ash)和黄杆菌(Flavobacterium mizutaii),其中枯草芽孢杆菌对齐整小核菌的抑菌率可达67.6%;Thampi和Bhai(2017)从黑胡椒根际土壤中分离得到3株链霉菌菌株IISRBPAct1、IISRBPAct25和 IISRBPAct42,其中菌株IISRBPAct1对齐整小核菌表现出90%以上的抑制作用;Volpiano等(2018)从菜豆根结中分离得到16株对齐整小核菌菌丝生长抑制率超过84%的根瘤菌菌株,这些拮抗菌株可产生高达36.5 μg/mL的IAA,同时验证了IAA产生与菌丝体抑制之间的直接相关性;Li等(2019)发现灰黄青霉(P. griseofulvum)菌株CF3不仅可以抑制齐整小核菌菌丝生长,还能抑制菌核的形成和萌发;何俊烺等(2021)分别用哈茨木霉和绿色木霉(T. virid)对齐整小核菌进行平板对峙,结果表明2株菌株对齐整小核菌的抑菌率分别为56.72%和58.01%;李界秋等(2022)从桑树中分离得到贝莱斯芽孢杆菌(B. velezensi)NN04,该菌对齐整小核菌的抑菌活性可达74.81%。可见,齐整小核菌的拮抗菌大多来源于土壤或植物体内,利用昆虫内生菌进行病害防治的报道极少,常见的对昆虫肠道微生物的研究则更多集中于微生物与昆虫之間的关系等方面,在植物病害防治方面的相关研究较少(郭军等,2015;魏晓莹等,2019)。【本研究切入点】目前齐整小核菌拮抗菌株的获取对象多局限于土壤或植物,其他来源的报道较少。黄粉甲是一种杂食性昆虫,危害五谷杂粮、麦麸、果皮及天然纤维,且可降解PE;黄粉甲生存环境多样,对环境的适应性较强(刘玉升等,2010;丁梦琪,2021),其抗逆性较强可能是一些共生菌在发挥重要作用;罹病黄粉甲致病菌在致病时其体内菌群发生变化,有益共生菌发挥作用对抗致病菌,此时容易分离到重要的生防菌。【拟解决的关键问题】通过稀释涂布法和平板对峙法从罹病黄粉甲中分离获得对附子白绢病菌具有高效拮抗作用的细菌,通过形态和生理生化特征及16S rDNA序列分析等对拮抗细菌进行种类鉴定,并研究拮抗菌株的最佳发酵条件及对附子白绢病的室内防治效果,为后续拮抗菌株的开发利用提供数据,也为附子白绢病生防菌的来源及其生物防治提供参考。
1 材料与方法
1. 1 试验材料
1. 1. 1 供试菌株 拮抗细菌:从罹病黄粉甲中分离筛选获得。病原菌:齐整小核菌,由云南农业大学昆虫毒理学实验室自行分离并鉴定。
1. 1. 2 供试培养基 营养琼脂培养基(NA):牛肉膏3.0 g/L、蛋白胨10.0 g/L、NaCl 5.0 g/L、琼脂1.5 g/L,121 ℃灭菌20 min;马铃薯培养基(PDA):马铃薯20.0 g/L、葡萄糖2.0 g/L、琼脂1.5 g/L,121 ℃灭菌30 min;蛋白胨酵母蔗糖培养基(YSP):蛋白胨10.0 g/L、酵母浸粉5.0 g/L、蔗糖20.0 g/L、琼脂15.0 g/L,115 ℃灭菌30 min;牛肉膏酵母葡萄糖培养基(NYBD):牛肉膏8.0 g/L、酵母浸粉5.0 g/L、葡萄糖10.0 g/L、琼脂15.0 g/L,115 ℃灭菌30 min;细菌基础培养基(CM):葡萄糖5.0 g/L、(NH4)2SO4 2.0 g/L、柠檬酸钠1.0 g/L、MgSO4·7H2O 2.0 g/L、K2HPO4 4.0 g/L、KH2PO4 6.0 g/L、琼脂15.0 g/L,121 ℃灭菌20 min;蛋白胨酵母培养基(LB):蛋白胨10.0 g/L、酵母浸粉5.0 g/L、氯化钠10.0 g/L、琼脂15.0 g/L,121 ℃灭菌20 min。
1. 1. 3 主要仪器和试剂 超净工作台(江苏安泰空气技术有限公司)、冰箱(青岛海尔股份有限公司)、高压灭菌锅(ZEALWAY GR85DA)、-80 ℃超低温冰箱(Thermo 906)、SPX-300B-Ⅱ型生化培养箱(北京市永光明医疗仪器有限公司)、普通天平(赛多利斯科学仪器有限公司)、人工气候箱(宁波东南仪器有限公司)、电热鼓风恒温干燥箱(上海市崇明实验仪器厂)。蛋白胨、牛肉膏、葡萄糖、酵母浸粉和氯化钠等分析纯试剂均购自广东环凯微生物科技有限公司。
1. 2 拮抗细菌分离
参照何明川等(2021)的方法,先将罹病黄粉甲用75%酒精处理,后用无菌水漂洗3次,将处理好的黄粉甲放入装有1 mL无菌水的离心管中用研磨棒充分研磨,制备梯度稀释菌悬液。取10-5、10-6和10-7稀释度的菌悬液100 µL分别涂布于NA培养基上,每个梯度3次重复。倒置平皿于28 ℃培养箱中培养3 d。在超净工作台中用无菌挑针挑取NA培养基上长出的单菌落并于LB培养基上划线培养;纯化3~4次,将菌株保存于4 ℃冰箱备用。
1. 3 拮抗细菌抑菌效果测定
1. 3. 1 平板对峙法 将培养4 d的齐整小核菌打成6 mm大小的菌饼,接种于PDA培养基中央,用无菌牙签在距菌饼2 cm左右处十字线对称接种细菌,以不接种细菌的PDA培养基为对照,于28 ℃培养4 d后观察并记录抑菌圈大小,20 d后观察并记录菌核产生情况。重复3次。
菌落直径(cm)=(横径+纵径)/2
抑菌率(%)=(对照菌落直径-处理菌落直径)/对照菌落直径×100
式中,处理菌落直徑为对称拮抗细菌的两点间距离减去两点拮抗细菌的抑菌圈半径。
菌核萌发抑制率(%)=(对照菌核数量-处理菌核数量)/对照菌核数量×100
1. 3. 2 拮抗细菌挥发物对附子白绢病菌生长的影响 参考张霞等(2020)的方法并加以改进。将拮抗细菌在LB培养基上划线培养,同时将齐整小核菌6 mm大小的菌饼接种于PDA培养基上,采用对扣法(刘海洋等,2018)将有病原菌的一面置于上方,以不划线作对照,3次重复,于28 ℃培养4 d后观察并记录抑菌圈大小。培养20 d后观察并记录菌核产生情况。计算方法参照1.3.1。
1. 3. 3 拮抗细菌无菌发酵液对附子白绢病菌菌丝生长的影响 参照李玉龙(2019)及彭启超等(2022)的方法并加以改进。将拮抗细菌发酵液以8000 r/min离心15 min,收集上清液,用0.22 µm滤膜过滤得到无菌滤液。无菌滤液用无菌水进行5倍和10倍稀释后,将原液、5倍和10倍稀释液与加热冷却至50~55 ℃的PDA培养基以1∶4的比例混合后倒入90 mm的平板中,即得到最终稀释为5倍、25倍和50倍发酵液PDA平板。将齐整小核菌6 mm大小的菌饼接于平板中央,以添加等量无菌水的PDA培养基平板为对照,3次重复,于28 ℃下培养,每天观察并记录抑菌圈大小。培养20 d后观察并记录菌核产生情况。计算方法参照1.3.1。
1. 3. 4 拮抗细菌无菌发酵液对附子白绢病菌菌核萌发的影响 参照李玉龙(2019)的方法并加以改进。将拮抗细菌发酵液以8000 r/min离心15 min,收集上清液,用0.22 µm滤膜过滤得到无菌滤液。无菌滤液用无菌水进行5倍和10倍稀释后,将原液、5倍和10倍稀释液与加热冷却至50~55 ℃的PDA培养基以1∶4的比例混合后倒入90 mm的平板中,即得到最终稀释为5倍、25倍和50倍发酵液PDA平板。每个平板放置12个菌核,以添加等量无菌水的PDA培养基平板为对照,3次重复,于28 ℃培养,每24 h观察菌核萌发情况并记录。计算方法参照1.3.1。
1. 4 拮抗细菌鉴定
1. 4. 1 形态结构及生理生化特征 在LB培养基上接种拮抗细菌,28 ℃培养3 d,待长出单菌落观察形态。根据《微生物学实验》对菌株的生理生化特性进行测定(何明川等,2021)。
1. 4. 2 系统发育进化树构建 采用细菌16S rDNA基因通用引物27F(5'-AGAGTTTGATCCTGGCTCA-3')和1492R(5'-GGTTACCTTGTTACGACTT-3')对拮抗细菌的16S rDNA进行PCR扩增(引物由上海生工生物工程技术有限公司合成)。PCR反应体系50 µL:PCR Mix 25 µL,上、下游引物各2 µL,DNA模板3 µL,Rnase H2O 18 µL。扩增程序:94.8 ℃预变性2.5 min;98 ℃ 10 s,55 ℃ 10 s,72 ℃ 20 s,进行30个循环;72 ℃延伸2 min。PCR产物经1%琼脂糖凝胶电泳检测合格后送至昆明擎科生物科技有限公司测序。测序结果在NCBI上进行BLAST比对,并选择同源性较高的序列使用ClustalX 1.83和MEGA 7.0构建系统发育进化树(何明川等,2021)。
1. 5 拮抗细菌发酵条件筛选
1. 5. 1 种子液制备 挑取拮抗细菌单菌落于100 mL LB液体培养基中28 ℃、180 r/min振荡培养24 h,备用。
1. 5. 2 培养基优化 配制YSP、NYBD、NA、LB和CM培养基各100 mL,分别接入50 µL种子液,于28 ℃下180 r/min摇床振荡培养24 h,取出测定不同培养基中细菌的OD600,筛选最佳培养基(何明川等,2021)。每处理3次重复(下同)。
1. 5. 3 碳源对拮抗细菌生长速度的影响 以最佳培养基为基础培养基,分别以麦芽糖、乳糖、葡萄糖、蔗糖和淀粉作为碳源,其余成分保持不变,接入50 µL种子液在28 ℃下180 r/min摇床振荡培养24 h,取出测定不同培养基中细菌的OD600,筛选出最佳碳源。
1. 5. 4 氮源对拮抗细菌生长速度的影响 以最佳培养基为基础培养基,分别以蛋白胨、酵母浸粉、硝酸铵、氯化铵和甘氨酸作为氮源,其余成分保持不变,接入50 µL种子液在28 ℃下180 r/min摇床振荡培养24 h,取出测定不同培养基中细菌的OD600,筛选出最佳氮源。
1. 5. 5 初始接菌量对拮抗细菌生长速度的影响 采用最佳培养基,种子液为液体培养基体积比的0.05%、0.10%、0.50%、1.00%和2.00%,接入菌种在28 ℃下180 r/min摇床振荡培养24 h,取出测定不同培养基中细菌的OD600,筛选出最佳初始接菌量。
1. 5. 6 装液量对拮抗细菌生长速度的影响 采用最佳培养基,装液量分别配置为30、60、90、120和150 mL,接入50 µL种子液在28 ℃下180 r/min摇床振荡培养24 h,取出测定不同培养基细菌的OD600,筛选出最佳装液量。
1. 5. 7 转速对拮抗细菌生长速度的影响 采用最佳培养基,分别设置120、150、180、210和240 r/min的转速,接入50 µL种子液在28 ℃下不同转速摇床振荡培养24 h,取出测定不同培养基中细菌的OD600,筛选出最佳转速。
1. 5. 8 温度对拮抗细菌生长速度的影响 采用最佳培养基,分别设置20、24、28、32、36、40和46 ℃,接入50 µL种子液在优化条件下摇床振荡培养24 h,取出测定不同培养基中细菌的OD600,筛选出最佳培养温度。
1. 5. 9 初始pH对拮抗细菌生长速度的影响 采用最佳培养基,分别调节pH为4、5、6、7、8、9和10,接入50 µL种子液在优化条件下摇床振荡培养24 h,取出测定不同培养基中细菌的OD600,筛选出最佳初始pH。
1. 5. 10 培养时间对拮抗细菌生长速度的影响 采用最佳培养基,接入50 µL种子液在优化条件下摇床振荡培养,开始培养24 h内每隔2 h测量1次OD600,24 h后每隔12 h测量1次OD600,绘制细菌生长曲线,筛选出最佳培养时间。
1. 6 附子白绢病室内盆栽防效试验
参考何明川等(2022)、彭启超等(2022)的方法并加以改进。采用拮抗细菌菌液灌根处理附子测定其对白绢病的防效。试验共设4个处理,每处理9盆附子,每盆1株,试验盆栽随机摆放。保护试验:分别用拮抗细菌发酵液(1×108 CFU/mL)、噻呋酰胺和无菌水进行灌根处理,2 d后接种病原菌。治疗试验:先接种病原菌,2 d后分别用拮抗细菌发酵液(1×108 CFU/mL)、噻呋酰胺和无菌水进行灌根处理。接种病原菌后每隔20 d对附子白绢病发病情况进行调查。病情分級:按附子茎叶枯萎程度分为4级,0级,无病叶;1级,病叶数量小于总叶片数的50%;2级,病叶数量为50%~100%,但茎秆未枯萎;3级,病叶数量为100%,茎秆枯萎。分别统计各处理各病级的株数,计算发病率、病情指数及防治效果。
发病率(%)=发病株数/调查总株数×100
病情指数=[∑(各级病株×各级代表值)/调查总株数×3]×100
防治效果(%)=(对照病情指数-处理病情指数)/对照病情指数×100
1. 7 统计分析
采用SPSS 26.0、GraphPadPrism 8.0和Excel 2010对试验数据进行处理分析和图表制作,采用Duncan’s新复极差法检验不同处理间的差异显著性。
2 结果与分析
2. 1 拮抗细菌的分离与筛选
从罹病黄粉甲初步分离得到4株细菌。经平板对峙法进行筛选,发现菌株Z1和T2对齐整小核菌菌丝无抑制效果,菌株TS1和TZ1均有抑制效果,且菌株TS1的效果最佳,对齐整小核菌菌丝的抑制率可达68.03%(表1)。表明菌株TS1对齐整小核菌有较好的抑制作用,选取菌株TS1进行后续试验。
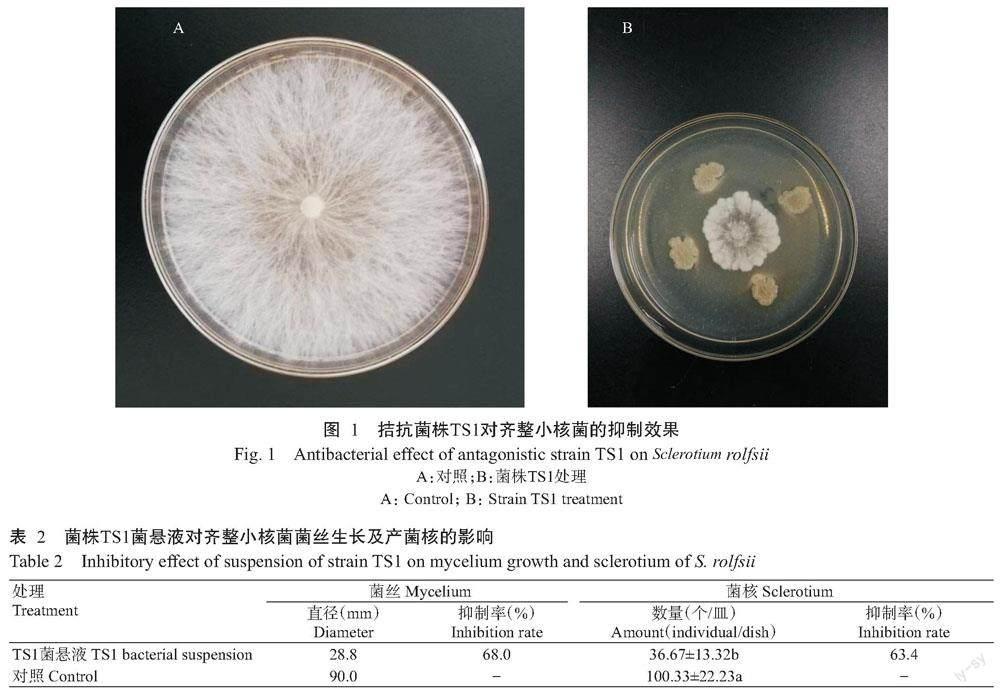
2. 2 拮抗菌株TS1对齐整小核菌的抑制效果
2. 2. 1 平板对峙结果 由图1和表2可知,菌株TS1对齐整小核菌菌丝的生长具有较好的抑制效果,抑制率可达68.03%;菌株TS1处理与对照产生的菌核数量也存在较大差异,处理的菌核数量显著少于对照(P<0.05,下同)。
2. 2. 2 拮抗细菌挥发物对附子白绢病菌菌丝生长及产菌核的影响 由表3可知,菌株TS1产生的挥发性物质对齐整小核菌菌丝的抑制率可达71.8%;处理与对照产生的菌核数量也存在较大差异,处理的菌核数量显著少于对照。
2. 2. 3 拮抗细菌无菌发酵液对附子白绢病菌菌丝生长及产菌核的影响 不同稀释倍数的拮抗细菌无菌发酵液对齐整小核菌菌丝生长及菌核产生均有一定影响,且随着稀释倍数的增加,无菌发酵液对菌丝生长及菌核产生的抑制效果总体上呈逐渐下降的趋势(表4和表5)。
2. 2. 4 拮抗细菌无菌发酵液对附子白绢病菌菌核萌发的影响 由表6可知,拮抗细菌无菌发酵液可抑制附子白绢病菌菌核萌发,且随着稀释倍数的增加呈现抑制率降低的趋势。
2. 3 拮抗细菌鉴定结果
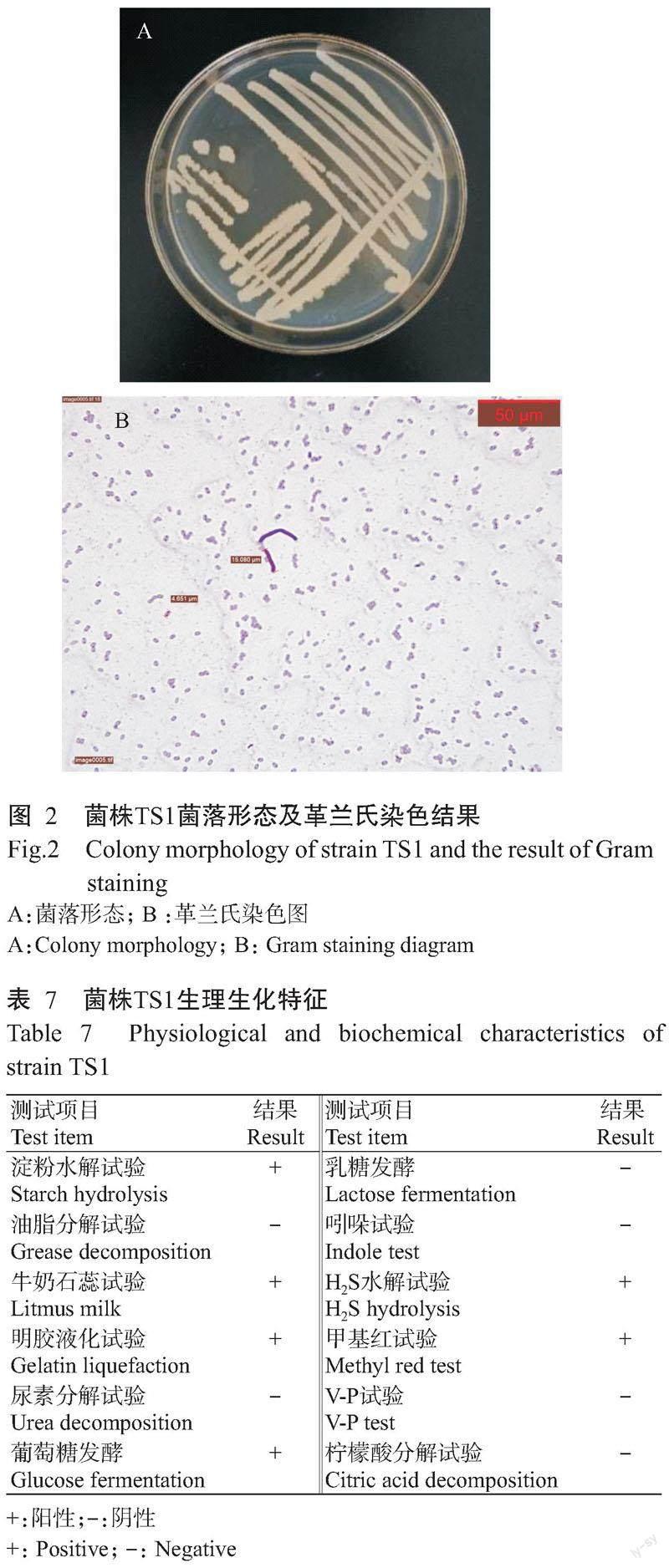
2. 3. 1 拮抗菌形态特征及其生理生化特征 菌株TS1在LB培养基上培养2~3 d后,形成圆形乳白稍黄菌落,表面干燥,边缘完整且凸起有褶皱,菌体杆状,产生椭圆形芽孢,为革兰氏阳性菌(图2)。生理生化特征测定结果(表7)显示,淀粉水解试验、牛奶石蕊试验、明胶液化试验、葡萄糖发酵、甲基红试验、H2S水解试验均为阳性。
2. 3. 2 拮抗细菌分子鉴定结果 将菌株TS1校对后的序列提交至GenBank数据库进行同源性比对,结果显示该序列与B. subtilis的相似性为87%。下载同源性高的序列,使用ClustalX 1.83和MEGA 7.0构建系统发育进化树,结果(图3)表明,菌株TS1与B. subtilis subsp.聚为一类。综合拮抗细菌的形态特征及分子鉴定结果,初步鉴定菌株TS1为枯草芽孢杆菌。
2. 4 拮抗细菌发酵条件优化结果
2. 4. 1 培养基优化 由图4可知,菌株TS1分别在YSP、NYBD、NA、LB和CM等5种培养基上培养24 h的OD600分别为1.640、1.490、1.460、1.630和0.586,各处理间存在一定差异,其中YSP培养基最适合菌株TS1生长,是菌株TS1生长的最佳培养基。
2. 4. 2 碳源对菌株TS1生长速度的影响 由图5可知,分别以麦芽糖、乳糖、葡萄糖、蔗糖和淀粉作为YSP培养基的碳源,其余成分保持不变,所培养菌株TS1的OD600存在一定差异,其中麦芽糖为碳源时的OD600最高,为1.796,说明麦芽糖是菌株TS1的最佳碳源。
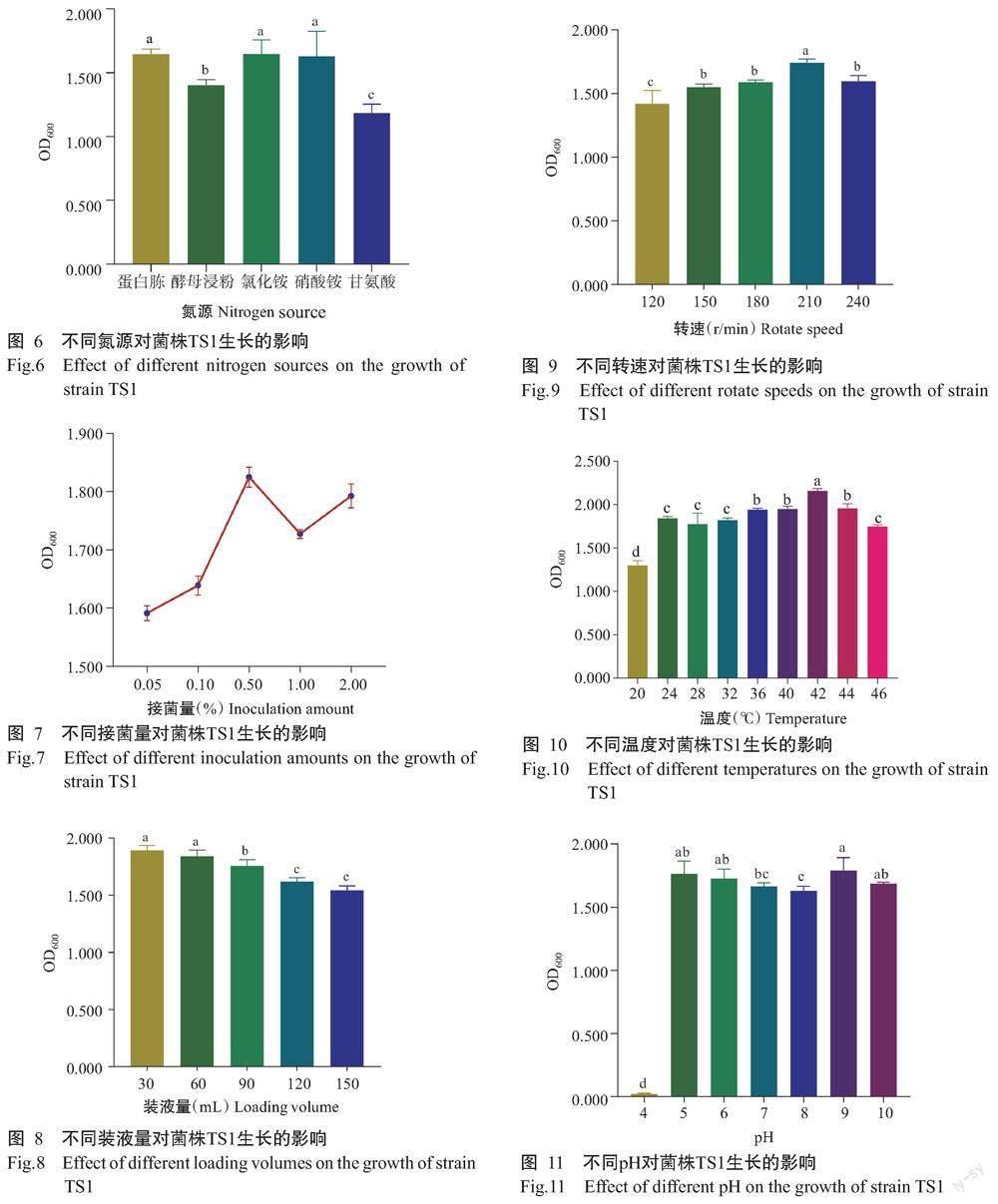
2. 4. 3 氮源对菌株TS1生长速度的影响 由图6可知,分别以蛋白胨、酵母浸粉、氯化铵、硝酸铵和甘氨酸作为YSP培养基的氮源,其余成分保持不变,所培养菌株TS1的OD600存在一定差异,其中蛋白胨作为氮源时的OD600最高,为1.647,说明蛋白胨为最佳氮源。
2. 4. 4 初始接菌量对菌株TS1生长速度的影响 由图7可知,不同初始接菌量下培养的菌株TS1的OD600相近,各处理间无显著差异(P>0.05),其中接菌量为0.50%时OD600最大值,为1.821,说明0.50%的初始接菌量为最佳接菌量。
2. 4. 5 装液量对菌株TS1生长速度的影响 由图8可知,不同装液量下培养的菌株TS1的OD600存在一定差异,其中,当装液量为30 mL时的OD600最高,为1.890,说明30 mL为最佳装液量。
2. 4. 6 转速对菌株TS1生长速度的影响 由图9可知,不同转速条件下培养的菌株TS1的OD600存在一定差异,当转速为210 r/min时菌株TS1的OD600达最大值,为1.740,说明210 r/min为最佳转速。
2. 4. 7 温度对菌株TS1生长速度的影响 由图10可知,在20~46 ℃条件下菌株TS1均可生长,但不同温度下的OD600存在一定差异,其中42 ℃时菌株TS1的生长最好,OD600达2.158,说明42 ℃为最佳生长温度。
2. 4. 8 初始pH对菌株TS1生长速度的影响 由图11可知,不同pH条件下培养的菌株TS1的OD600存在一定差异。菌株TS1在pH 5~10时均可生长,其中pH为9时菌株生长情况最好,OD600可达1.790,说明pH 9为最佳初始pH。
2. 4. 9 发酵时间对菌株TS1生长速度的影响 由图12可知,不同培养时间下菌株TS1的生长速度存在一定差异。刚开始培养时菌株TSI的OD600随培养时间增加而逐渐上升,培养4 h后菌株的生长速度加快,在48 h时达最大值,此时的OD600为1.960,继续在摇床上培养,72~120 h时菌株的生长速度开始减缓,呈现一个平稳下降的趋势,说明48 h为最适发酵时间
2. 5 室内盆栽防效试验结果
保护试验结果(表8)显示,噻呋酰胺处理的平均防效为66.67%,而用菌株TS1发酵液处理的防效也可达49.39%,二者间差异显著;治疗试验结果显示,菌株TS1发酵液处理与噻呋酰胺处理的平均防效相当,分别为62.97%和58.03%。
3 讨论
芽孢杆菌具有耐高温、抗紫外线、耐盐等特性,同时与大多数根际促生细菌相似,可产生细胞壁降解酶类以及脂肽类抗生素,对真菌和一些细菌病原体具有拮抗活性,其代谢物可促进植物生长,并且通过影响根际微生物,触发宿主的防御反应提高植物的抗逆性,使其成为很好的生物防治剂(Wulff et al.,2002;李永丽等,2021;王蕊等,2021)。枯草芽孢杆菌属于细菌,其作为芽孢杆菌的模式菌株,具有生长速度快、营养简单以及产生耐高温、具抗逆性的芽孢等特点,在生物防治应用方面具有较大潜力(黄曦等,2010;何艺琴等,2019)。目前,具有拮抗作用的枯草芽孢杆菌通常从土壤或植物体内分离获得,少有从昆虫体内分离并应用。而昆虫的生命活动与其体内存在的微生物有着密切关系,二者相互依存,相互影响,对昆虫体内微生物的研究开发具有深远的意义(何明川等,2022)。
本研究对从黄粉甲分离到的1株枯草芽孢杆菌菌株TS1进行抑菌试验,发现该菌对齐整小核菌的平板抑制率可达68.03%。本研究采用单因素试验方法对其基础培养基和发酵条件进行优化,结果表明最佳培养基为YSP培养基,麦芽糖为最佳碳源,蛋白胨为其最佳氮源,其优化培养基配方为:蛋白胨10.0 g/L、酵母浸粉5.0 g/L、麦芽糖15.0 g/L;最佳发酵条件为装液量30 mL、接菌量0.50%、转速为210 r/min、培养温度42 ℃、初始pH 9、培养时间48 h。將菌株TS1与金黎明等(2020)和夏俊芳等(2020)从土壤中分离得到的枯草芽孢杆菌21-1-2、T3,何明川等(2021)从美洲大蠊体内分离得到的枯草芽孢杆菌MC4-2的最佳发酵条件进行比较,可发现除菌株TS1外其他3株菌株在pH的选择上相似,集中在6~7,而菌株TS1的最适pH为9;转速基本集中在180~210 r/min;菌株TS1与MC4-2在最适装液量的选择相同,而且二者对于氮源的选择也相同。将菌株TS1与实验室保存的菌株枯草芽孢杆菌ZLSY-2的生理生化测定结果进行比较,发现在尿素分解、葡萄糖发酵和H2S水解等方面存在差异,可能是不同菌株对尿素、葡萄糖和硫化氢的不同作用所致。
本研究探究了生防菌株TS1的挥发物和非挥发物对附子白绢病菌菌丝营养生长及菌核产生情况的影响,结果表明,菌株TS1的挥发物和非挥发物可有效抑制齐整小核菌菌丝的生长和菌核的形成。叶云峰等(2011)发现枯草芽孢杆菌B47可通过产生环状脂肽iturin A进而对多种病原真菌产生抑制作用;王雅等(2014)从柑橘叶片分离得到枯草芽孢杆菌Bv10,从该菌株的无菌发酵液中提取得到A、B两种对芝麻白绢病具有较好抑制作用的活性物质,经鉴定,纯化物A为脂肽化合物伊枯草菌素iturinA2,纯化物B为iturinA4;李广等(2022)发现枯草芽孢杆菌1151通过产生抗菌肽物质降低辣椒软腐病发病程度和病斑直径,其抗菌肽类物质可能包括AP01339(BHP)、AP00889(SP-B)、AP02860(Hb 98-114)、subtilosin A和Subtilosin Sbox等。综上,菌株TS1也极有可能通过产生上述物质从而抑制附子白绢病病原菌的生长以及菌核的产生。
本研究对附子白绢病进行了室内盆栽防效测定,发现菌株TS1发酵液在保护试验中有49.39%的防效,在治疗试验中可达到62.97%的防治效果。本研究结果与文毅(2010)用枯草芽孢杆菌B8对鱼腥草白绢病和杨义等(2010)用枯草芽孢杆菌Bv22对茉莉花白绢病进行室内盆栽防效测定,20 d时分别达66.1%和56.8%的防效相似。综上可以看出,同一种病原菌在不同作物上的发生情况不同,而且来源不同的枯草芽孢杆菌对齐整小核菌的影响效果也不尽相同。
本研究为枯草芽孢杆菌应用于生物防治提供了更多的参考和依据,并丰富了昆虫内生细菌的研究,同时也表明菌株TS1存在较好的生防潜力,下一步可加强对该菌株的代谢产物、生防机制的研究。
4 结论
枯草芽孢杆菌菌株TS1对齐整小核菌具有较好的抑制作用,其最佳培养基为YSP,最佳碳源为麦芽糖,最佳氮源为蛋白胨;优化培养基配方为:蛋白胨10.0 g/L、酵母浸粉5.0 g/L、麦芽糖15.0 g/L;最佳发酵条件为装液量30 mL、接种量0.50%、转速210 r/min、培养温度42 ℃、初始pH 9、培养时间48 h。优化的发酵方案可用于快速、大批量培养菌株TS1菌悬液。室内盆栽试验结果表明,菌株TS1对附子白绢病有较好的防治效果,具有开发成附子白绢病生防菌的潜力。
参考文献:
陈芳. 2007. 附子病虫害的发生发展规律及防治研究[D]. 杨凌:西北农林科技大学. [Chen F. 2007. Study about the disease occurrence principal and prevention of plant di-sease and pest in Aconitum carmichaeli farmland[D]. Yang-ling:Northwest A & F University.]
丁梦琪. 2021.黄粉虫和黑粉虫幼虫降解聚乙烯效能的研究[D]. 哈尔滨:哈尔滨工业大学. [Ding M Q. 2021. Polye-thylene-degradation capacity in dark-versus yellow-mealworms (Larvae of Tenebrio obscurus versus Tenebrio molitor[D]. Harbin:Harbin Institute of Technology.] doi:10.27061/d.cnki.ghgdu.2021.002491.
郭军,吴杰,邓先余,林连兵,刘珊,李继莲. 2015. 昆虫肠道菌群的功能研究进展[J]. 应用昆虫学报,52(6):1345-1352. [Guo J,Wu J,Deng X Y,Lin L B,Liu S,Li J L. 2015. Advances in research on insect gut microbiota and their functions[J]. Chinese Journal of Applied Entomology,52(6):1345-1352.] doi:10.7679/j.issn.2095-1353.2015. 160.
何俊烺,吳卓慧,程东美. 2021. 木霉和杀菌剂联用对橡胶榕白绢病菌的抑制作用[J]. 湖南农业大学学报(自然科学版),47(3):312-316. [He J L,Wu Z H,Cheng D M. 2021. Inhibitory effects of Trichoderma and fungicides on southern blight disease of Ficus elastica caused by Sclerotium rolfsii[J]. Journal of Hunan Agricultural University (Natural Science Edition),47(3):312-316.] doi:10.13331/j.cnki.jhau.2021.03.010.
何明川,王志江,谢永辉,詹莜国,柯昌磊,李微杰,张忠,吴国星. 2022. 烟草黑胫病拮抗菌的筛选、鉴定及发酵条件优化[J]. 中国生物防治学报,38(2):428-439. [He M C,Wang Z J,Xie Y H,Zhan Y G,Ke C L,Li W J,Zhang Z,Wu G X. 2022. Screening,identification and fermentation optimization of antagonists against tobacco black shank disease[J]. Chinese Journal of Biological Control,38(2):428-439.] doi:10.16409/j.cnki.2095-039x.2022. 02.013.
何明川,曾舒泉,王志江,詹莜国,柯昌磊,李微杰,张忠,吴国星,谢永辉. 2021. 一株烟草疫霉拮抗菌MC4-2的鉴定、发酵条件优化及防效测定[J]. 微生物学通报,48(12):4636-4648. [He M C,Zeng S Q,Wang Z J,Zhan Y G,Ke C L,Li W J,Zhang Z,Wu G X,Xie Y H. 2021. Identification,fermentation condition optimization and control effect of an antagonistic strain MC4-2 against Phytophthora parasitica var. nicotianae[J]. Microbiology China,48(12):4636-4648.] doi:10.13344/j.microbiol.china. 210334.
何藝琴,卢晨,徐文杰,张兴,杨蕾,张慧丽,刘海峰,马东方,张长青. 2019. 小麦内生细菌XG-7对赤霉病菌的拮抗作用及其生物学特性[J]. 甘肃农业大学学报,54(1):110-116. [He Y Q,Lu C,Xu W J,Zhang X,Yang L,Zhang H L,Liu H F,Ma D F,Zhang C Q. 2019. Antagonistic effects of wheat endophytic bacteria XG-7 on Fusarium graminerum and its biological characteristics[J]. Journal of Gansu Agricultural University,54(1):110-116.] doi:10.13432/j.cnki.jgsau.2019.01.015.
胡朝晖,陈秋强,王博林,倪方方,徐红梅,宋腾蛟,袁小凤. 2017. 枯草芽孢杆菌等益生菌对白术白绢病的防治研究[J]. 中华中医药学刊,35(10):2621-2624. [Hu Z H,Chen Q Q,Wang B L,Ni F F,Xu H M,Song T J,Yuan X F. 2017. Prevent and control southern blight of atractylides macrocephala by adding probiotic such as Bacillus subtilis[J]. Chinese Archives of Traditional Chinese,35(10):2621-2624.] doi:10.13193/j.issn.1673-7717. 2017.10.039.
黄曦,许兰兰,黄荣韶,黄庶识. 2010. 枯草芽孢杆菌在抑制植物病原菌中的研究进展[J]. 生物技术通报,(1):24-29. [Huang X,Xu L L,Huang R S,Huang S S. 2010. Research advance in controlling plant diseases by Bacillus subtilis[J]. Biotechnology Bulletin,(1):24-29.] doi:10. 13560/j.cnki.biotech.bull.1985.2010.01.026.
金黎明,王晓彤,宫小明,权春善,赵晶,侯熙彦. 2020. 拮抗黄曲霉枯草芽孢杆菌21-1-2发酵条件的优化[J]. 中国酿造,39(3):47-51. [Jin L M,Wang X T,Gong X M,Quan C S,Zhao J,Hou X Y. 2020. Optimization of fermentation conditions of Bacillus subtilis 21-1-2 against Aspergillus flavus[J]. Chinese Brewing,39(3):47-51.] doi:10.11882/j.issn.0254-5071.2020.03.010.
李广,李晓芬,易兰花. 2022. 拮抗菌枯草芽孢杆菌1151及其所产抗菌肽对辣椒采后软腐病的控制作用[J/OL]. 食品与发酵工业. https://doi.org/10.13995/j.cnki.11-1802/ts.033223.] [Li G,Li X F,Yi L H. 2022. Control effect of antagonistic Bacillus subtilis 1151 and its antimicrobial peptides on soft rot of postharvest pepper[J/OL]. Food and Fermentation Industries. https://doi.org/10.13995/j.cnki.11-1802/ts.033223.]
李界秋,宋文欣,蒙姣荣,王忠文. 2022. 6株贝莱斯芽胞杆菌对土传病原菌的抑制活性及其作用机理[J]. 福建农业学报,37(3):371-380. [Li J Q,Song W X,Meng J R,Wang Z W. 2022. Inhibitory activity and mechanism of Bacillus velezensi strains against soil-borne pathogens[J]. Fujian Journal of Agricultural Sciences,37(3):371-380.] doi:10.19303/j.issn.1008-0384.2022.003.012.
李敏,何磊鸣,赵特,杜鹏强,高飞,汪梅子,张静静,崔凯娣,游秀峰,孙淑君,周琳. 2022. 齐整小核菌研究进展[C]//河南省植物保护学会第十二次、河南省昆虫学会第十一次、河南省植物病理学会第六次会员代表大会暨学术讨论会论文集:70-81. [Li M,He L M,Zhao T,Du P Q,Gao F,Wang M Z,Zhang J J,Cui K D,You X F,Sun S J,Zhou L. 2022. Advances in studies of Sclerotium rolfsii Saccardo[C] // Proceedings of the 12th Plant Protection Socie-ty of Henan Province,the 11th Entomological Society of Henan Province,and the 6th Member Congress and Symposium of the Plant Pathology Society of Henan Province:70-81.] doi:10.26914/c.nkihy.2022.001316.
李玉龙. 2019. 生防菌对两种作物病害的防治作用及机理[D]. 杨凌:西北农林科技大学. [Li Y L. 2019. Biocontrol effect and the mechanism of isolates on plant diseases of two crops[D]. Yangling:Northwest A & F University.]
李永丽,周洲,曲良建,尹新明. 2021. 贝莱斯芽孢杆菌 Pm9 生物防治潜力及全基因组分析[J]. 河南农业大学学报,55(6):1081-1088. [Li Y L,Zhou Z,Qu L J,Yin X M. 2021. Biological control potential and complete genome analysis of Bacillus velezensis Pm9[J]. Journal of Henan Agricultural University,55(6):1081-1088.] doi:10.16445/j.cnki.1000-2340.20210816.002.
刘海洋,王琦,王伟,张仁福,韩万里,姚举. 2018. 拮抗菌AL7的鉴定及其生防特性的初步研究[J]. 植物保护,44(2):53-60. [Liu H Y,Wang Q,Wang W,Zhang R F,Han W L,Yao J. 2018. Species identification and biocontrol chara-cteristics of antagonistic bacterium AL7[J]. Plant Protection,44(2):53-60.] doi:10.16688/j.zwbh.2017215.
刘任,程东美,卢鹏飞,刘菁. 2005. 哈茨木霉T2菌株提取物对齐整小核菌抑菌活性的测定[J]. 仲恺农业技术学院学报,18(4):25-28. [Liu R,Cheng D M,Lu P F,Liu J. 2005. Primary study on inhibitory activity of the crude extracts from the conidia of Trichoderma harzianum T2 against Sclerotium rolfsii[J]. Journal of Zhongkai University of Agriculture and Technology,18(4):25-28.] doi:10.3969/j.issn.1674-5663.2005.04.006.
刘玉升,王付彬,崔俊霞,张丽. 2010. 黄粉虫资源研究利用现状与进展[J]. 环境昆虫学报,32(1):106-114. [Liu Y S,Wang F B,Cui J X,Zhang L. 2010. Recent status and advances on study and utilization of tenebrio molitor[J]. Journal Environmental Entomology,32(1):106-114.] doi:10.3969/j.issn.1674-0858.2010.01.017.
彭启超,黄德龙,张志鹏,魏浩,吴书凤,吴妍,李俊,邓祖科,王宗抗. 2022. 贝莱斯芽孢杆菌DPT-03对花生白绢病菌的防控效果[J]. 河南农业科学,51(2):97-103. [Peng Q C,Huang D L,Zhang Z P,Wei H,Wu S F,Wu Y,Li J,Deng Z K,Wang Z K. 2022. The biocontrol effect of Bacillus velezenisi DPT-03 on Sclerotium rolfsii in peanut[J]. Journal of Henan Agricultural Science,51(2):97-103.] doi:10.15933/j.cnki.1004-3268.2022.02.011.
阮盈盈,刘峰. 2020. 木霉菌生物防治作用机制与应用研究进展[J]. 浙江农业科学,61(11):2290-2294. [Ruan Y Y,Liu F. 2020. Research progress of biological control mechanism and application of Trichoderma[J]. Journal of Zhejiang Agruicultural Sciences,61(11):2290-2294.] doi:10.16178/j.issn.0528-9017.20201130.
宋漳,陳辉. 2002. 绿色木霉对土传病原真菌的体外拮抗作用[J]. 福建林学院学报,22(3):219-222. [Song Z,Chen H. 2002. In vitro antagonism of Trichoderma viride against the soilborne fungal pathogens[J]. Journal of Fujian College of Foresty,22(3):219-222.] doi:10.13324/j.cnki.jfcf. 2001.03.007.
唐莉,梁丽娟,叶华智,曾拥军. 2004. 附子常见病害的调查研究[J]. 现代中药研究与实践,(6):29-32. [Tang L,Liang L J,Ye H Z,Zeng Y J. 2004. Study on pests plaguing Aco-nitum carmichaeli debx[J]. Research and Practice on Chinese Medicines,(6):29-32.] doi:10.13728/j.1673-6427.2004.06.008.
王蕊,王腾,李二峰. 2021. 生防芽孢杆菌在植物病害领域的研究进展[J]. 天津农学院学报,28(4):71-77. [Wang R,Wang T,Li E F. 2021. Research advances of biocontrol Bacillus in the field of plant diseases[J]. Journal of Tianjin Agricultural College,28(4):71-77.] doi:10.19640/j.cnki.jtau.2021.04.015.
王雅,黎起秦,谭小艳,邱东方,郭应臣,王坦,牛小瑞,黄思良. 2014. 枯草芽孢杆菌菌株Bv10胞外抗菌物质的纯化与鉴定[C]//中国植物病理学会2014年学术年会论文集. [Wang Y,Li Q Q,Tan X Y,Qiu D F,Guo Y C,Wang T,Niu X R,Huang S L. 2014. Purification and identification of extracellular antibacterial substances from Bacillus subtilis strain Bv10[C]//Proceedings of the 2014 Annual Conference of Chinese Society of Plant Pathology.]
魏晓莹,郭晨亮,褚栋. 2019. 昆虫体内微生物多样性的影响因素研究进展[J]. 生物安全学报,28(3):170-176. [Wei X Y,Guo C L,Chu D. 2019. Research progress on the factors influencing microbiota diversity in insect[J]. Journal of Biosafety,28(3):170-176.] doi:10.3969/j.issn. 2095-1787.2019.03.002.
文毅. 2010. 利用芽孢杆菌防治鱼腥草白绢病的研究[D]. 雅安:四川农业大学. [Wen Y. 2010. Study on biocontrol of southern blight on Houttuynia cordata thumb by Bacillus spp.[D]. Ya’an:Sichuan Agricultural University.]
夏俊芳,郑素慧,翟少华,张志东,苏金花,艾赛提,武运. 2020. 一株拮抗酿酒葡萄灰霉病的枯草芽孢杆菌T3筛选、鉴定及抑菌分析[J]. 食品工业科技,41(23):99-105. [Xia J F,Zheng S H,Qu S H,Zhang Z D,Su J H,Ai S T,Wu Y. 2020. Screening and identification of antagonistic Bacillus subtilis T3 against wine grapr gray mold and analysis of its antimicrobial activity[J]. Science and Technology of Food Industry,41(23):99-105.] doi:10.13386/j.issn1002-0306.2020030200.
杨义,黄永禄,张献强,黎起秦,甘启范,罗一东,林纬. 2010. 芽孢杆菌Bv22菌株对茉莉花白绢病的防治效果试验[J]. 廣西农业科学,41(6):554-557. [Yang Y,Huang Y L,Zhang X Q,Li Q Q,Gan Q F,Luo Y D,Lin W. 2010. Control effects of Bacillus subtilis strain Bv22 on jasmine sclerotium blight[J]. Guangxi Agricultural Sciences,41(6):554-557.] doi:10.3969/j.issn.2095-1191.2010. 06.012.
叶云峰,黎起秦,袁高庆,付岗,缪剑华,林纬. 2011. 枯草芽孢杆菌B47菌株抗菌物质的分离纯化及其对玉米小斑病的防治作用[J]. 中国生物防治学报,27(3):357-361. [Ye Y F,Li Q Q,Yuan G Q,Fu G,Liao J H,Lin W. 2011. Purification of antimicrobial substance produced by Bacillus subtilis B47 and its effect on southern corn leaf blight[J]. Chinese Journal of Biological Control,27(3):357-361.] doi:10.16409/j.cnki.2095-039x.2011.03.012.
张霞,许曼琳,郭志青,于静,吴菊香,于建垒,刘同金,李新国,迟玉成,万书波. 2020. 暹罗芽孢杆菌ZHX-10的分离鉴定及其对花生白绢病的生防效果[J]. 中国油料作物学报,42(4):674-680. [Zhang X,Xu M L,Guo Z Q,Yu J,Wu J X,Yu J L,Liu T J,Li X G,Chi Y C,Wan S B. 2020. Isolation and identification of Bacillus sinensis ZHX-10 and analysison its biological control activities against Sclerotium rolfsii[J]. Chinese Journal of Oil Crop Sciences,42(4):674-680.] doi:10.19802/j.issn.1007-9084. 2019207.
Iquebal M A,Tomar R S,Parakhia M V,Singla D,Jaiswal S,Rathod V M,Padhiyar S M,Kumar N,Rai A,Kumar D. 2017. Draft whole genome sequence of groundnut stem rot fungus Athelia rolfsii revealing genetic architect of its pathogenicity and virulence[J]. Scientific Reports,7(1):1-10. doi:10.1038/s41598-017-05478-8.
Li Y L,Guo Q,Wei X M,Xue Q H,Lai H X. 2019. Biocontrol effects of Penicillium griseofulvum against monkshood (Aconitum carmichaelii Debx.) root diseases caused by Sclerotium rolfsiii and Fusarium spp.[J]. Journal of Applied Microbiology,127(5):1532-1545. doi:10.1111/jam.14382.
Thampi A,Bhai R S. 2017. Rhizosphere actinobacteria for combating Phytophthora capsici and Sclerotium rolfsii,the major soil borne pathogens of black pepper (Piper nigrum L.)[J]. Biological Control,109:1-13. doi:10.1016/j.biocontrol.2017.03.006.
Volpiano C G,Lisboa B B,São José J F B,de Oliveira A M R,Beneduzi A,Passaglia L M P,Vargas L K. 2018. Rhizobium strains in the biological control of the phytopathogenic fungi Sclerotium (Athelia) rolfsii on the common bean[J]. Plant and Soil,432(1-2):229-243. doi:10.1007/s11104-018-3799-y.
Wulff E G,Mguni C M,Mansfeld-Giese K,Fels J,Lübeck M,Hockenhull. 2002. Biochemical and molecular characteri-zation of Bacillus amyloliquefaciens,B. subtilis and B. pumilus isolates with distinct antagonistic potential against Xanthomonas campestris pv. campestris[J]. Plant Patho-logy,51(5):574-584. doi:10.1046/j.1365-3059.2002.00753.x.
(責任编辑 麻小燕)
收稿日期:2022-09-14
基金项目:四川省区域创新合作项目(2021YFQ0022);云南省科技计划项目(202105AC160037)
通讯作者:吴国星(1975-),https://orcid.org/0000-0002-7308-2161,博士,教授,主要从事农业有害生物综合治理研究工作,E-mail:wugx1@163.com
第一作者:施春兰(1998-),https://orcid.org/0000-0001-6914-1774,研究方向为生物农药开发与利用,E-mail:shiclan22@163.com
